安寐丹调控OXA/CREB/PER1信号通路改善SD模型大鼠昼夜节律紊乱*
2022-04-26谢光璟
徐 波,谢光璟,夏 婧,王 平
(湖北中医药大学老年医学研究所 武汉 430065)
睡眠充足是国际社会公认的三项健康标准之一,而随着社会生活节奏的加快,睡眠剥夺(SD)现象持续增加[1]。昼夜节律与睡眠息息相关[2],调整SD 造成的昼夜节律紊乱是治疗失眠的常见方法[3]。近年来,中医药防治失眠尤其是中医古方作用机制研究成为广大科研工作者的研究热点。中医经典名方安寐丹源自清·陈士铎《石室秘录》,主治虚证失眠,由人参、生熟枣仁、茯神、当归等10 味药物组成。方以人参滋补气血为君药,臣以生熟枣仁养血补肝、宁心安神,再以茯神、当归等补血宁神为佐,共奏补益气血、养心安神之功。该治法符合近10 年中药复方治疗失眠的用药规律[4],乃失眠虚证尤其是中老年失眠患者的常用治疗方剂,临床疗效显著、应用广泛[5-9]。
前期已有多数文章报道酸枣仁汤[10,11]或酸枣仁-茯苓-党参等水提物[12,13]防治失眠的作用机制,但关于安寐丹的基础研究较少报道,笔者前期研究发现该方能改善不同周期SD 模型大鼠的昼夜节律紊乱、学习记忆障碍,其机制可能与调节OXA、OXB 有关[14,15],但安寐丹防治失眠的深入作用机制暂不明确,进一步探索其作用机制将为安寐丹的临床运用提供实验依据。Orexin 是影响睡眠-觉醒的重要因素,Orexin 拮抗剂Suvorexant是目前常用于失眠治疗的药物之一[16],其效果已经过临床实验证实并通过FDA 的批准,为此探讨安寐丹对Orexin 的作用可为临床治疗失眠提供新思路,故本实验拟基于Orexin 信号通路开展安寐丹改善SD 模型大鼠昼夜节律紊乱的作用及相关分子机制研究具有十分重要的研究价值和必要性。
1 材料与方法
1.1 实验动物与分组
由中国食品药品检定研究院供应的健康清洁级6月龄SD 雄性大鼠40 只,许可证号:SCXK(京)2016-0002,动物合格证号:11401500043208。常规适应饲养1 周,使用随机数字将其分为空白组、模型组、艾司唑仑组、安寐丹组,各10 只;实验全程遵照《关于善待动物的指导性意见》和相关生物安全制度及相关规章执行。
1.2 造模方法与模型评价
1.2.1 造模方法
采用弱碱性生理盐水配置PCPA 混悬液,遵循人和动物间体表面积折算的等效剂量比值及预试验结果,除空白组,余下三组大鼠均按350 mg/kg/天体质量以10 mL·kg-1体积腹腔注射[17],连续3 天,腹腔注射的同时连续10天叠加国际公认的多平台水环境剥夺法,以保证造模更加准确。
1.2.2 模型评价
第3 天腹腔注射PCPA 后,将所有大鼠放入ZZ-6自主活动仪(每天光照时间为8:00-20:00点,黑暗时间为20:01-7:59),待其适应环境3 min 后,每隔3 h 记录大鼠2 min 内的自主活动距离及时间,即分别记录21:00、00:00、03:00、06:00、9:00、12:00、15:00、18:00时的活动情况,记录期间保持正常的摄食摄水。若大鼠第3 d腹腔注射PCPA 后24 小时活动距离和活动时间异常,则表明造模成功[18]。
1.3 干预方法及疗程
腹腔注射第3 d起开始每日8:00时安寐丹组给予安寐丹水煎剂9.09 mg·kg-1,艾司唑仑组给予艾司唑仑0.09 mg·kg-1灌胃,空白组、模型组给予等容生理盐水灌胃,1天1次*28天。
1.4 主要药物与试剂、仪器
1.4.1 主要药物与试剂
安寐丹:人参11 g,生熟枣仁各19 g,茯神11 g,当归11 g,丹参7 g,麦冬11 g,五味子4 g,石菖蒲4 g,甘草4 g,购自湖北中医药大学附属黄家湖医院药剂室,经湖北中医药大学药学院中药学鉴定专家鉴定,使用煎药机煎煮、过滤、浓缩至1:1 比例,冷却置于4℃冰箱。余下主要药物试剂如下表1。

表1 主要药物试剂
1.4.2 主要仪器
主要仪器见下表2.

表2 主要仪器
1.5 疗效性指标评价
1.5.1 ZZ-6自主活动仪检测昼夜节律
方法同1.2.2模型评价。
1.5.2 Morris水迷宫实验检测学习记忆
水迷宫分4 个象限,主要分为定位航行试验和空间探索试验。定位航行实验分别从4个象限正中贴壁放入水中,记录大鼠90 s 内上平台潜伏期和游泳总路程。空间探索实验为第6天移除平台后各组均同一点放入水中,记录大鼠90 s 跨越原平台位置的次数和持续时间。
1.5.3 主要检测方法
免疫荧光检测下丘脑Orexin 神经元的表达,ELISA 检测大鼠下丘脑组织OXA、OXB 含量,WB 和RT-PCR 检测下丘脑组织OXA/CREB/PER1 信号通路蛋白和mRNA表达。
1.6 标本采集及检测方法
1.6.1 标本采集
各组大鼠干预结束后禁食12 h,麻醉、处死,分组使用灌流法采集下丘脑,生理盐水冲洗后按组迅速置于液氮中冻存,随即将标本置于-80℃冰箱保存,待用于后续检测。
1.6.2 免疫荧光检测下丘脑Orexin
各组大鼠运用水合氯醛麻醉,开胸,灌流,断头,开颅,取出下丘脑组织,用多聚甲醛固定后石蜡包埋。下丘脑切片冠状切片,冻存,脱蜡至水,漂洗,孵育,加相应指标蛋白的特异性兔抗鼠一抗(1:1000)、羊抗兔二抗(1:200),漂洗并晾干,使用荧光显微镜观察并记录。
1.6.3 ELISA检测下丘脑组织OXA、OXB含量
-80℃冰箱取出下丘脑,常温解冻,组织匀浆机中匀浆,离心取上清,预热酶标仪,按照试剂盒使用说明依次配置洗涤液等工作液,随即在96孔板依次加标准品或样品、生物素化抗体工作液、酶结合物工作液、底物溶液、终止液,测量OD 值,并根据OD 值结果画出标准曲线,再套用相关公式计算OXA、OXB的含量。
1.6.4 WB 法测定下丘脑区OXA、CREB、PER1 蛋白表达水平
称取大鼠下丘脑组织,匀浆器匀浆,离心,加PBS,离心,加RIPA 裂解液,离心,提取大鼠下丘脑组织总蛋白,以PBS 缓冲液稀释后加入96 孔板中,加入BCA工作液,酶标仪测定各孔A562 吸光度,绘制标准曲线并计算各组组织总蛋白浓度。玻璃板加入TEMED 后灌胶装在电泳槽上,放入电泳盒中,上样,两侧分别加Prestained protein loading buffer 和Prestained protein MW marker 后电泳。漂洗,切胶,浸泡,转膜,漂染,漂洗,平铺于凝胶图像成像分析仪上,等体积混合Western Blot 超敏发光液,运行Bio-Rad 凝胶图像成像分析系统,曝光获得各组蛋白条带,拍照,分析各组条带灰度值,并作统计分析。
1.6.5 RT-PCR 法测定下丘脑区OXA、CREB、PER1 mRNA表达水平
-80℃冰箱取出大鼠下丘脑组织,加TRIzol,匀浆,离心,加氯仿,离心,吸上清,加异丙醇、75%乙醇、无RNA 酶水,配制反应混合液与冰上,均量分装,加total RNA 样品,充分混匀,设置PCR 仪反应程序为65℃、5 min,4℃、∞;加入5×Prime Script Buffer 2 等,充分混合均匀,设置PCR 仪反应程序为42℃、60 min,70℃、5 min,4℃、∞。配置PCR 反应液,加入PCR Forward Primer、PCR Reverse Primer、DNA 模板、ddH2O 等。充分混合均匀,离心,采用Actin 为内参,设置Real Time-PCR 仪反应条件:96℃、30 min,95℃、5 min,60℃、30 min,95℃、10 min,65℃、5 min,95℃、6 min,共进行40个循环,绘制溶解曲线,采用2-△△ct法计算目的基因相对表达量。引物序列见表3。

表3 引物序列表
△Ct=Ct目的基因-Ct内参基因
△△Ct=△Ct给药组-△Ct模型组
1.7 统计学处理采用
2 结果
2.1 24 h内不同时间自主活动距离、时间比较
空白组大鼠24h自主活动时间和距离均呈昼少夜多的节律。与空白组比较,模型组大鼠24 h 自主活动时间和活动距离均高于空白组(P<0.01),并未呈现出昼夜节律特征(表4、图1、图2)。

图1 24 h内不同时间自主活动距离

图2 24 h内不同时间自主活动时间
表4 空白组和模型组大鼠24 h内不同时间自主活动距离、时间( ± s, n=10)

表4 空白组和模型组大鼠24 h内不同时间自主活动距离、时间( ± s, n=10)
注:与空白组比较,**P<0.01,*P<0.05。
组别空白组模型组活动距离(cm)928.56±48.71 1105.96±71.31**活动时间(s)100.81±3.25 115.6±2.67**
2.2 安寐丹对SD模型大鼠学习记忆能力的影响
与空白组比,模型组上平台潜伏期与游泳总路程均显著延长(P<0.01),穿越站台次数、象限活动时间降低(P<0.01);艾司唑仑组和安寐丹组均可减少其上平台潜伏期(P<0.01)和游泳总路程(P<0.01),增加其穿越站台次数(P<0.05)和象限活动时间(P<0.01)。与模型组比较,艾司唑仑组可减少其上平台潜伏期(P<0.05)和游泳总路程(P<0.01),增加其穿越站台次数(P<0.05)和象限活动时间(P<0.01);安寐丹组可减少其上平台潜伏期(P<0.01)和游泳总路程(P<0.05),增加其穿越站台次数(P<0.05)和象限活动时间(P>0.05)(表5、图3至6)。

图3 各组大鼠上平台潜伏期时间
表5 各组大鼠学习记忆的能力( ± s,n=10)

表5 各组大鼠学习记忆的能力( ± s,n=10)
注:与空白组比较,**P<0.01,*P<0.05;与模型组比较,△△P<0.01,△P<0.05。
组别空白组模型组艾司唑仑组安寐丹组定位航行实验上平台潜伏期(s)25.53±8.71 53.64±5.43**46.94±7.28**△40.65±6.34**△△游泳总路程(cm)333.03±44.01 989.41±41.98**643.73±34.16**△△862.74±33.78**△空间探索实验穿越站台次数3.5±0.82 1.33±0.47**2.67±0.55*△2.33±0.52*△象限活动时间(s)33.92±4.05 14.74±4.24**21.39±5.60**△△15.32±2.76**
2.3 安寐丹对SD 模型大鼠下丘脑Orexin 含量的影响
2.3.1 ELISA检测结果
与空白组比较,SD 大鼠下丘脑组织OXA、OXB 均显著升高(P<0.01)。与模型组比较,艾司唑仑组可显著降低OXA和OXB含量(P<0.01);安寐丹组可显著降低OXA 含量(P<0.01)和OXB 含量(P<0.05)(表6、图7、图8)。

图8 各组大鼠下丘脑OXB含量的表达
表6 各组大鼠下丘脑组织OXA、OXB含量表达( ± s,n=10)

表6 各组大鼠下丘脑组织OXA、OXB含量表达( ± s,n=10)
注:与空白组比较,**P<0.01;与模型组比较,△△P<0.01,△P<0.05。
组别空白组模型组艾司唑仑组安寐丹组OXA(pg·μL-1)2855.50±142.96 3790.70±104.91**3380.95±105.63**△△3567.60±128.17**△△OXB(pg·μL-1)3643.55±118.36 3930.45±104.91**3745.70±151.14**△△3926.00±108.12**△
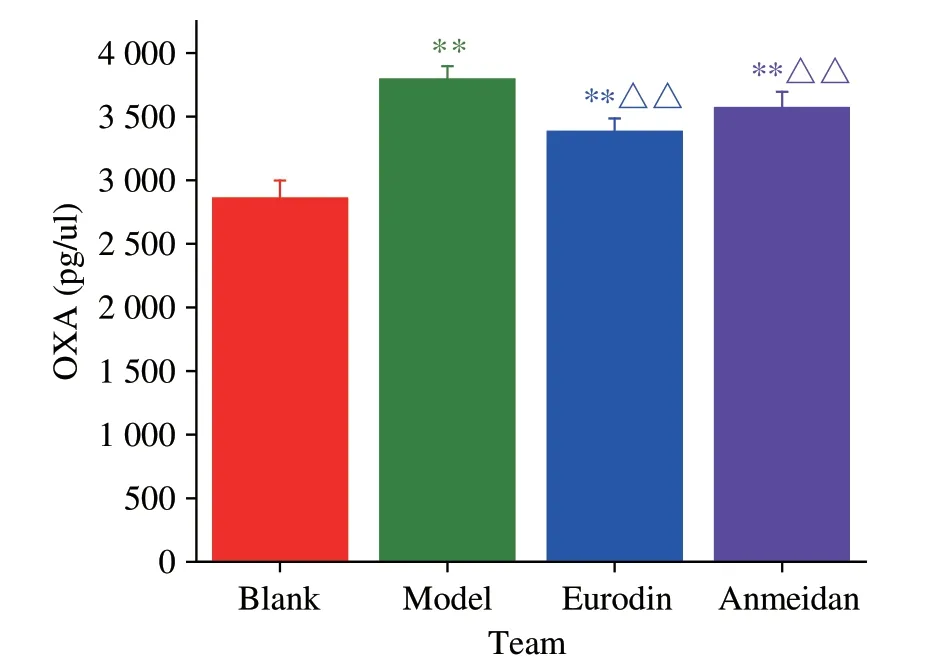
图7 各组大鼠下丘脑OXA含量的表达
2.3.2 免疫荧光检测结果
如图所示,SD 大鼠下丘脑区OX 含量较空白组增多,艾司唑仑组和安寐丹组与模型组相比OX 含量呈不同程度下降(图9)。

图4 各组大鼠游泳总路程

图5 各组大鼠穿越站台次数

图6 各组大鼠象限活动时间

图9 各组大鼠模型下丘脑区OX免疫荧光图(400×)
2.4 WB检测结果
与空白组比较,模型组下丘脑组织OXA、CREB 蛋白表达均上调(P<0.01)、PER1 蛋白表达下调(P<0.01),艾司唑仑组下丘脑组织OXA、CREB 蛋白表达均上调(P<0.05)、PER1 蛋白表达下调(P<0.05),安寐丹组下丘脑组织OXA 蛋白相对表达上调(P<0.01)、CREB 蛋白相对表达上调(P<0.05)、PER1 蛋白表达下调(P<0.01)。与模型组比较,艾司唑仑组下丘脑组织OXA蛋白表达下调(P<0.05)、CREB蛋白表达下调(P<0.01),PER1 蛋白表达上调(P<0.01),安寐丹组下丘脑组织OXA 蛋白表达下调(P<0.05)、CREB 蛋白表达下调(P<0.01)、PER1 蛋白表达上调(P<0.01)(表7、图10-13)。

图10 各组大鼠OXA、CREB、PER1蛋白WB结果
表7 各组大鼠下丘脑OXA、CREB、PER1蛋白的表达( ± s,n=10)

表7 各组大鼠下丘脑OXA、CREB、PER1蛋白的表达( ± s,n=10)
注:与空白组比较,**P<0.01,*P<0.05;与模型组比较,△△P<0.01,△P<0.05。
组别空白组模型组艾司唑仑组安寐丹组OXA 0.78±0.03 1.01±0.08**0.85±0.07*△0.87±0.04**△CREB 0.10±0.01 0.25±0.03**0.17±0.06*△△0.22±0.05*△△PER1 0.17±0.01 0.06±0.03**0.10±0.04*△△0.09±0.01**△△

图11 各组大鼠OXA蛋白表达

图12 各组大鼠CREB蛋白表达
2.5 RT-PCR检测结果

图13 各组大鼠PER1蛋白表达
与空白组比较,模型组OXA、CREB mRNA 表达均上调(P<0.01),PER1 mRNA 表达均下调(P<0.01);艾司 唑 仑 组OXA mRNA 表 达 上 调(P<0.05)、CREB mRNA 表达上调(P<0.01),PER1 mRNA 表达下调(P<0.01);安寐丹 组OXA mRNA 表达 上 调(P<0.01)、CREB mRNA 表达上调(P<0.05),PER1 mRNA 表达下调(P<0.01)。与模型组比较,艾司唑仑组OXA mRNA表达下调(P<0.01)、CREB mRNA 表达下调(P<0.01),PER1 mRNA 表 达 上 调(P<0.05);安 寐 丹 组OXA mRNA 表达下调(P<0.01),CREB mRNA 表达下调(P<0.05),PER1 mRNA 表 达 上 调(P<0.05)(表8、图14-16)。
表8 各组大鼠下丘脑OXA、CREB、PER1 mRNA的表达( ± s,n=10)

表8 各组大鼠下丘脑OXA、CREB、PER1 mRNA的表达( ± s,n=10)
注:与空白组比较,**P<0.01,*P<0.05;与模型组比较,△△P<0.01,△P<0.05。
组别空白组模型组艾司唑仑组安寐丹组OXA 0.83±0.12 1.00**0.96±0.13*△△0.98±0.14**△△CREB 0.42±0.13 1.00**0.55±0.13**△△0.47±0.11*△PER1 1.71±0.28 1.00**1.15±0.13*△1.38±0.19**△

图14 各组大鼠OXA mRNA表达图
4 讨论
本次实验采用国际公认的PCPA 腹腔注射以及改良多平台水环境法进行造模。PCPA 作为国际公认的SD模性,具有操作简单、成模时间短、可重复性高等特征,广泛应用于失眠的研究,是失眠机制研究中应用最广泛的模型[19],腹腔注射PCPA 可使昼夜节律紊乱、白昼睡眠行为几乎消失,以此表明造模成功[20]。本研究运用ZZ-6 自主活动仪对比空白组和模型组24h 自主活动时间和距离发现,空白组大鼠“昼伏夜出”的节律明显,具体表现为白天活动时间和距离少,夜间活动时间距离长;而SD 大鼠24h活动时间和活动距离丧失“昼伏夜出”的节律而呈现24 h“持续躁动”的节律紊乱的现象,说明造模成功。

注:与空白组比较,**P<0.01,*P<0.05;与模型组比较,△△P<0.01,△P<0.05。

图15 各组大鼠CREB mRNA表达图
SD、昼夜节律和学习记忆三者息息相关,学习记忆包括信息获取、编码、短时储存、长期巩固及记忆提取等复杂的过程,最新研究表明失眠相关的日间认知障碍很可能是由于认知控制受损[21],进一步研究发现,SD损害学习记忆的病理机制常涉及到突触可塑性、昼夜节律、内质网应激以及能量代谢等方面的改变[22],分子机制主要包括损害长时程增强、改变谷氨酸受体表达和功能、改变节律基因表达和翻译过程、损害海马的神经发生、改变OX 系统等[23-24]。本次实验结果表明PCPA 所致昼夜节律紊乱的SD 大鼠上平台的潜伏期和游泳总路程均高于空白组、穿越站台次数和象限活动时间均低于空白组,说明SD 导致大鼠昼夜节律紊乱后会使大鼠学习记忆能力降低;而安寐丹可以降低其上平台的潜伏期、缩短其游泳总路程,增加其穿越站台次数和象限活动时间,从而改善其认知受损,但是否能改善其昼夜节律紊乱尚不得而知。
昼夜节律是睡眠产生的重要生理基础,位于下丘脑的视交叉上核(SCN)可根据环境明暗独自产生并维持机体的日周期节律,是人类昼夜节律起搏器,是控制昼夜节律的关键部位,被称作“大脑中的主控时钟”。中医称“脑为元神之腑”“脑主神明”,具有主宰精神、意识、思维功能,为精神、意识、思维活动的枢纽;而SCN 的重要作用则进一步丰富和阐释了“脑为元神之腑”“脑主神明”的中医内涵。进一步研究发现,SCN 损伤的大鼠24h 昼夜节律消失、记忆下降,生物钟基因也发生相应改变[25]。昼夜节律相关基因有生物钟基因Clock、时钟管理基因Bmal1、系列周期基因Per1、Per2、Per3 以及晶体蛋白基因Cry 1、Cry2 等;而PER 基因最早被复制和鉴定且在SCN 中表达明显[26],大鼠的PER mRNA 表达具有夜晚高早晨低的节律变化[27],将PER 基因导入PER 基因突变的果蝇可恢复其昼夜节律[28];哺乳动物PER 基因有PER1、PER2、PER3三个亚型,PER1、PER2亚型是维持和调控昼夜节律的核心基因,且其中枢调节点位于SCN 上[29],而PER1 亚型又可以调控其他钟基因如PER2、PER3、CRY1、CRY2 等表达[30],昼夜节律紊乱会导致PER1 mRNA 表达下降[31]。研究还发现,光信号主要是通过启动CREB 的转录激活通过视网膜-下丘脑通路传给SCN,增加PER1表达,即光诱导CREB/PER1信号通路[32]。
Orexin是下丘脑分泌的具有促进和兴奋作用的神经元,包括OXA 和OXB,在睡眠状态下OX 神经元处于相对静息状态,在清醒状态下OX 神经元激活并且脑脊液中OX 的含量明显升高[33]。包含Orexin 受体-1(Orexin Receptor-1, OX1R)和Orexin 受体-2(Orexin Receptor-2, OX2R),且OX1R 与OXA 的亲和力高于OXB[34];当Orexin被激活时,OX1R活化会导致Gq/磷酸酯酶C(Phospho lipase C,PLC)/蛋白激酶C(Protein kinase C,PKC)途径激活,进而调节离子通道活性、细胞去极化、增加胞浆中钙离子浓度以增强信号在突触间传导,进一步上调CREB 等激酶,最终调节相关的生理学功能[35]。由前文可知PER1 在昼夜节律系统中处于核心地位,而光信号经视网膜细胞传递给SCN 导致mPER1 基因的表达主要是通过启动子上的CREB 的转录激活实现的,即Orexin/CREB/PER1信号通路。进一步研究发现SCN调控着PER1基因[36],SCN 损毁的大鼠体内Orexin 分泌昼夜节律紊乱[37],研究亦发现SCN区的PER1-增强绿色荧光蛋白(PER1-Enhanced Green Fluorescent Protein,PER1-EGFP)神经元被OXA纤维包围,而Orexin 可抑制PER1-EGFP 的时钟细胞表达,阐明Orexin 可通过反向调控SCN 区节律基因PER1 来改善睡眠[38]。因“脑为一身之宗,百神之会”,可以调节机体各类气血津液,卫气亦不例外,故SCN调控PER1 基因影响睡眠隶属于中医“脑主神明”的范畴。
Orexin 虽在下丘脑产生,但广泛分布于外周系统并参与众多生理活动,中药可以通过调节Orexin 神经元或其受体改善模型动物的相关病理现象,如研究发现疏肝和胃汤可能通过调节Orexin 及其受体改善抑郁模型大鼠胃排空延迟[26];宁心方加减可调节神经递质OXA 的表达而改善睡眠质量[39];天王补心丹可调节OXA信号保护慢性SD小鼠糖脂代谢异常[40];镇惊温胆汤可以调控大鼠Orexin 系统及其受体缓解不寐、善惊等病理状态[41]。本实验免疫荧光和Elisa 结果均表明SD 模型大鼠下丘脑区Orexin、OXA、OXB 含量均增多,而艾司唑仑组和安寐丹组可降低其含量;WB 结果进一步表明模型组大鼠下丘脑组织OXA、CREB 蛋白表达均上调、PER1 蛋白表达下调,而艾司唑仑组和安寐丹组大鼠下丘脑组织的OXA、CREB 蛋白表达均下调,PER1 蛋白表达上调;RT-PCR 再次佐证SD 大鼠下丘脑区的OXA mRNA、CREB mRNA 表达上调、PER1 mRNA 表达下调,而艾司唑仑、安寐丹可降低SD 大鼠下丘脑区的OXA mRNA、CREB mRNA 表达,上调其PER1 mRNA表达,从而改善SD模型昼夜节律紊乱,说明艾司唑仑、安寐丹可能是通过调节Orexin 及其介导的OXA/CREB/PER1 信号通路而发挥作用。且单从行为学和RT-PCR 实验数据上看,艾司唑仑组增多SD大鼠穿越站台次数和象限活动时间,降低下丘脑组织OXA、OXB含量,下调下丘脑组织OXA mRNA 表达,上调PER1 mRNA 表达均优于安寐丹;而安寐丹在降低SD 上平台潜伏期、下调下丘脑组织CREB mRNA 表达优于艾司唑仑,说明二者在改善SD 导致的学习记忆障碍和节律紊乱各有优势。该研究结果较充分阐明了安寐丹基于“脑主神明”的理论指导防治失眠的物质基础与Orexin息息相关。
综上所述,安寐丹能够改善SD 模型大鼠的昼夜节律紊乱及学习记忆,其作用途径可能与调节Orexin及其介导的OXA/CREB/PER1 信号通路相关,但其深入机制尚需展开进一步研究。
