尤瑞克林通过提高ALDH2 表达改善糖尿病合并脑缺血再灌注大鼠神经元损伤
2022-04-26王少津许丽娃吴和弟
王少津,许丽娃,吴和弟
(1.海口市人民医院全科医学科,海南海口570000;2.海口市人民医院老年病科,海南海口570000)
2 型糖尿病是指因机体胰岛素分泌不足或是胰岛素抵抗所致机体的血糖水平呈持续性异常升高的慢性疾病,全球2 型糖尿病病例数在1994 年约1.20 亿、1999 年约1.35 亿、2000 年约1.75 亿、2010 年约2.39 亿,预计2025 年可能会突破3 亿,其发病趋势在近几十年呈现出难以缓解的趋势[1]。过去的几十年中2 型糖尿病在老年群体中的发病率较高,但如今在青壮年群体中的发病率呈现出显著升高趋势,甚至在儿童或青少年中也可发生,有的国家小儿2 型糖尿病占糖尿病患者的一半以上[2]。在全球糖尿病恶化趋势的大环境下,我国每年新增糖尿病患者120万人,其发病率仅次于印度,由于我国的人口基数大且老龄化加剧,我国糖尿病病例数有可能超过印度[3]。2型糖尿病患者若血糖水平控制不佳,可引起心、脑、肾等重要器官组织损伤,产生严重的并发症,尤其是脑卒中[4]。尤瑞克林是一种用于治疗急性脑缺血的血管药物,具有选择性地扩张脑缺血组织部位的脑血管的作用,还可以减轻脑组织中神经细胞的损伤和促进脑内源性的神经再生,但其中的干预机制尚不清楚[5]。乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)是乙醛脱氢酶的同工酶,是催化多种醛类物质代谢的关键酶,也参与脑梗死调节过程[6]。尤瑞克林对脑缺血损伤的保护作用是否与ALDH2 有关尚不清楚。因此,本研究主要是基于ALDH2 探讨尤瑞克林对糖尿病合并脑缺血再灌注大鼠神经元损伤的影响。
1 材料与方法
1.1 实验动物
SPF 级SD 大鼠,6~7 周龄,体质量(240±10)g,购于广州赛业百沐生物科技有限公司,生产许可证号SCXK(粤)2020‑0055,于SPF级环境饲养。
1.2 主要试剂与仪器
ALDH2 阻断剂氨基氰(cyanamide,Cya)(美国Sigma 公司);尤瑞克林(广东天普生化医药股份有限公司);链脲佐菌素(streptozocin,STZ)、过氧化氢酶(catalase、CAT)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、肿瘤坏死因子‑α(tumor necrosis factor‑α,TNF‑α)、白细胞介素‑6(interleukin‑6,IL‑6)、白细胞介素‑1β(inter‑leukin‑1β,IL‑1β)试剂盒(北京索莱宝科技有限公司);TUNEL 试剂盒(德国Roche 公司);兔多抗B淋巴细胞瘤‑2(Bcl‑2)、Bcl‑2相关x蛋白(Bax)、活化半胱氨酸天冬氨酸蛋白酶‑3(Cleaved‑caspase‑3)、ALDH2、甘油醛‑3‑磷酸脱氢酶(glyceraldehyde‑3‑phosphate dehydrogenase,GAPDH)一抗(英国Ab‑cam 公司)。脑立体定位仪(美国STOELTING 公司);普通光学显微镜(日本Olympus 公司);Light‑cyce480实时定量PCR仪(罗氏诊断公司)。
1.3 糖尿病合并脑缺血再灌注大鼠模型制备和分组
60 只SPF 级SD 大鼠,使用体质量编号和随机数表法分为对照组、模型组、尤瑞克林组、尤瑞克林+Cya 组,每组15 只。使用无菌STZ 联合Zea‑Longa法制备糖尿病合并脑缺血再灌注大鼠模型[7],糖尿病造模前禁食、禁水8 h,腹腔注射STZ,注射剂量为2 mg/100 g,1周后使用血糖仪检测大鼠外周血血糖浓度,若连续7 d测得空腹血糖浓度≥16.7 mmol/L表示2型糖尿病模型制备成功,此次制模全部成功。对照组给予等体积的缓冲液。随后将大鼠用1%戊巴比妥钠麻醉,固定在脑立体定位仪,常规消毒、暴露颅骨,前囟点作为定点并标记,尤瑞克林+Cya 组使用微量注射器将1 mg/5 μL阻断剂Cya注入给药,模型组、尤瑞克林组注射等体积的助溶剂DMSO,对照组不做任何注射。完成后24 h,使用Zea‑Longa法将糖尿病大鼠制成脑缺血再灌注大鼠模型,阻断2 h再恢复血供,若大鼠出现身体不自主旋转视为模型制备成功,此次制模全部成功。对照组除不进行尼龙线插入,其余操作其他各组大鼠一样。在恢复血供30 min时,尤瑞克林组、尤瑞克林+Cya组舌下静脉给药尤瑞克林8.75×10‑3PNA 单位/kg,对照组、模型组舌下静脉注射同体积的生理盐水。
1.4 观察指标
1.4.1 神经功能评分各组大鼠缺血再灌注24 h,Longa 法[8]进行大鼠神经功能评估:无异常表现(0 分,无神经损伤),左侧前肢不完全伸展(1 分,轻度神经功能缺损),爬行过程中向左转圈(2 分,中度神经功能缺损),爬行过程中倾倒、翻转(3 分,重度神经功能缺损),意识不清、无法行走(4 分),死亡(5分)。
1.4.2 脑含水量神经功能评分评估后,断头处死大鼠,迅速分离脑组织,沿矢状缝切开,左脑称质量(计为湿质量),100 ℃恒温烘箱中烤72 h 并再次称质量(计为干质量),计算脑含水量=(脑组织湿质量-脑组织干质量)/脑组织湿质量×100%。
1.4.3 HE 染色将大鼠脑组织置于4%(φ)多聚甲醛固定,常规石蜡包埋、10 μm 切片、二甲苯脱蜡、复水、苏木素和伊红染色、脱水、透明、固定封片,显微镜镜检。
1.4.4 TUNEL 染色取“1.3.4”中的石蜡切片,经脱蜡、水化,严格按照TUNEL 检测试剂盒进行试验,封片后,随机选取5 个不重叠视野,用Image J 软件分析细胞凋亡率。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.4.5 SOD、CAT、MDA、TNF‑α、IL‑6、IL‑1β水平检测将脑组织制成组织匀浆,酶联免疫吸附法检测SOD、CAT、MDA、TNF‑α、IL‑6、IL‑1β水平。
1.4.6 Western blot 检测蛋白水平提取脑组织总蛋白,Bradford 调整各组蛋白浓度一致,经SDS‑PAGE凝胶电泳(浓缩胶100 V电泳1.5 h、12%分离胶70 V电泳至距离胶边缘5 mm 停止电泳),电转膜至PVDF 膜(200 mA 电流转移2 h),5%脱脂奶粉室温密封2 h,加入Cleaved‑caspase‑3(1∶1 000)、Bcl‑2(1∶1 000)、Bax(1∶1 000)、ALDH2(1∶1 000)、GAP‑DH(1∶100)一抗4 ℃孵育过夜,TBST 漂洗40 min,加入HRP标记的二抗(1∶1 000)室温孵育1 h,显色、定影、采集影像,Image J 软件对条带灰度值进行分析。
1.5 统计学分析
运用SPSS 22.0 软件对数据进行统计分析,使用GraphPad Prism 6.0软件进行作图,实验所得数据用±s表示,多组间数据分析使用单因素方法分析,后两两比较使用SNK 法,P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能评分和脑含水量比较
模型组大鼠的神经功能评分和脑含水量均高于对照组(P<0.05),尤瑞克林组、尤瑞克林+Cya 组大鼠的神经功能评分和脑含水量均低于模型组(P<0.05),尤瑞克林+Cya 组大鼠的神经功能评分和脑含水量均高于尤瑞克林组(P<0.05),见表1、2。

表1 各组大鼠神经功能评分比较Table 1 Comparison on scores of nerve function in each group

表2 各组大鼠脑含水量比较Table 2 Comparison on brain water content in each group
2.2 各组大鼠脑组织病理情况
对照组大鼠脑组织细胞形态正常、细胞排列和组织染色均匀。模型组大鼠脑组织细胞形态异常、细胞排列紊乱,神经细胞空泡化和核固缩、裂解严重。尤瑞克林组、尤瑞克林+Cya组大鼠脑组织神经细胞形态异常和排列紊乱现象较模型组得到明显改善,见图1。
2.3 各组大鼠脑组织凋亡情况
模型组大鼠的细胞凋亡率、Cleaved‑caspase‑3蛋白表达均高于对照组(P<0.05),而Bcl‑2/Bax、ALDH2蛋白表达均低于对照组(P<0.05);尤瑞克林组、尤瑞克林+Cya 组大鼠的细胞凋亡率、Cleaved‑caspase‑3蛋白表达均低于模型组(P<0.05),而Bcl‑2/Bax、ALDH2蛋白表达均高于模型组(P<0.05);尤瑞克林+Cya 组大鼠的细胞凋亡率、Cleaved‑caspase‑3蛋白表达均高于尤瑞克林组(P<0.05),而Bcl‑2/Bax、ALDH2蛋白表达均低于尤瑞克林组(P<0.05),见图2、表3。
2.4 各组脑组织SOD、CAT、MDA水平比较
模型组大鼠的MDA 水平高于对照组(P<0.05),而SOD、CAT活性均低于对照组(P<0.05);尤瑞克林组、尤瑞克林+Cya 组大鼠的MDA 水平低于模型组(P<0.05),而SOD、CAT 活性均高于模型组(P<0.05);尤瑞克林+Cya 组大鼠的MDA 水平高于尤瑞克林组(P<0.05),而Bcl‑2/Bax、ALDH2 蛋白表达均低于尤瑞克林组(P<0.05),见表4。
2.5 各组脑组织TNF‑α、IL‑6、IL‑1β含量比较
模型组大鼠的TNF‑α、IL‑6、IL‑1β水平高于对照组(P<0.05),尤瑞克林组、尤瑞克林+Cya 组大鼠的TNF‑α、IL‑6、IL‑1β水平低于模型组(P<0.05),尤瑞克林+Cya 组大鼠的TNF-α、IL‑6、IL‑1β水平高于尤瑞克林组(P<0.05),见表5。
3 讨论
糖尿病是短暂性脑缺血发作早期卒中和晚期复发卒中的独立危险因素,高血糖可以引起内膜损伤、乳酸累积、破坏血脑屏障、促进兴奋性氨基酸聚集,一旦出现脑缺血、缺氧时,机体组织中无氧酵解增多,酸性物质堆积增多,从而使细胞内外的酸中毒加重,进一步加剧患者的脑组织中能量代谢过程[9]。因此,急性脑缺血患者发病期间必须了解患者血糖情况,控制血糖升高程度。糖尿病所致的动脉粥样硬化先是损伤动脉的内皮细胞,若还存在代谢障碍、内分泌紊乱或免疫功能障碍会进一步加重内皮细胞损伤[10]。糖尿病患者机体的血小板的聚集性增强,内皮细胞损伤处容易聚集血小板和形成血小板、白色的血栓,产生释放反应,同时释放能够促进血小板聚集、动脉收缩等物质,加重脑血管疾病发生风险[11]。本研究通过构建糖尿病合并脑缺血再灌注大鼠模型显示模型组大鼠的神经功能评分和脑含水量均较健康大鼠呈出明显升高趋势,脑含水量增加表明脑组织存在组织损伤,本研究结果表明糖尿病合并脑缺血再灌注大鼠确实存在神经功能损伤。
尤瑞克林为人尿激肽原酶,对激肽有裂解作用,从而产生激肽,目前常用于急性进展性脑梗死临床治疗,表现出良好的治疗效果[12]。ALDH2基因是位于人12号染色体上,其编码的蛋白属于核基因编码蛋白,具有酯酶、脱氢酶和还原酶的活性,通过多肽入线粒体中发挥作用,可在心、肝、脑等重要器官组织中表达[13]。本研究结果显示模型组大鼠脑组织中的ALDH2 蛋白表达较健康大鼠呈现出明显降低趋势,经尤瑞克林干预大鼠脑组织中的ALDH2蛋白表达较模型组大鼠呈现出明显升高趋势,而在尤瑞克林干预增加ALDH2 阻断剂Cya 大鼠的脑组织中的ALDH2 蛋白表达较尤瑞克林干预组降低,推测尤瑞克林可提高ALDH2 蛋白表达。通过大鼠脑组织病理HE 染色观察发现模型组大鼠脑组织细胞形态结构异常、分布紊乱,尤瑞克林干预可以明显改善糖尿病合并脑缺血再灌注大鼠脑组织病理情况,增加ALDH2阻断剂Cya干预可部分逆转尤瑞克林的改善效果,再次说明尤瑞克林可以改善糖尿病合并脑缺血再灌注大鼠脑组织损伤,可能与ALDH2有关。
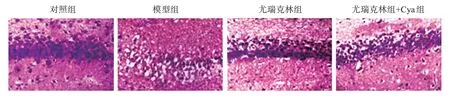
图1 大鼠脑组织HE染色Figure 1 HE staining of brain tissues in rats(200×,n=5)
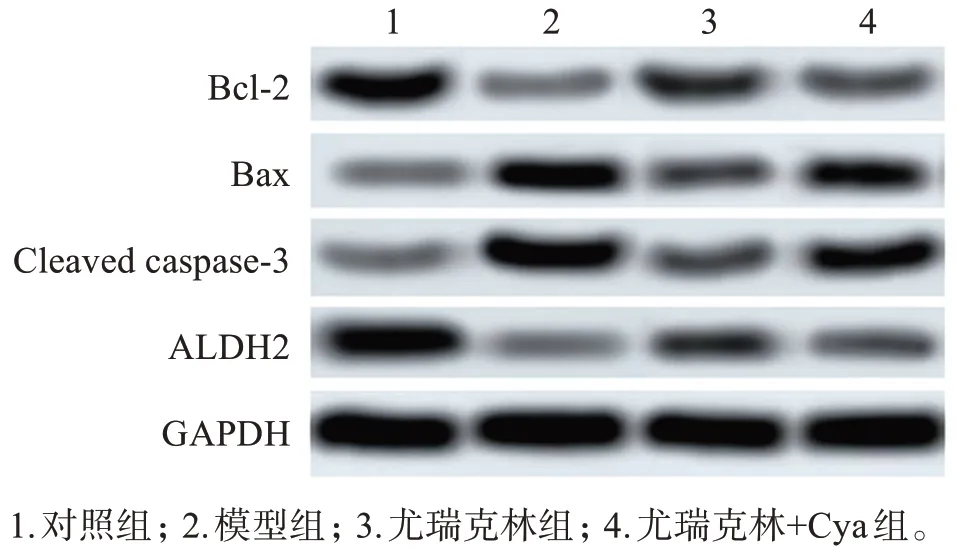
图2 各组大鼠海马组织中细胞蛋白及ALDH2表达Figure 2 Expressions of cellular proteins and ALDH2 in hippocampus of each group
脑缺血再灌注损伤会引起脑神经功能损伤,此过程受到多种生理过程调节,本研究结果显示模型组大鼠脑组织细胞凋亡率、Cleaved caspase‑3 蛋白表达升高,而Bcl‑2/Bax 比值降低,尤瑞克林干预降低糖尿病合并脑缺血再灌注大鼠脑组织凋亡率、Cleaved caspase‑3 蛋白表达和提高Bcl‑2/Bax 比值,而ALDH2 阻断剂Cya 干预可部分逆转尤瑞克林的调节趋势。Bcl‑2、Bax均为Bcl‑2家族中参与细胞凋亡调节的重要蛋白,其比值与线粒体的功能有关,同时其在线粒体结构完整性方面表现出拮抗作用,在细胞凋亡过程分别发挥抑制、促进细胞凋亡作用[14]。caspase‑3是介导细胞凋亡多种途径的最终执行者,其在正常生理状态下是以非生物活性形式存在,当接受到细胞凋亡信号刺激时,caspase 家族成员通过剪切作用转化为生物活性的状态,参与细胞凋亡过程[15]。由此说明,尤瑞克林对糖尿病合并脑缺血再灌注大鼠神经损伤的改善作用可能与调节ALDH2水平有关。
脑缺氧缺血时,机体会产生大量的氧自由基并诱导机体的氧化应激增强,适当的氧化应激可以提
表3 各组大鼠脑组织细胞凋亡率及凋亡蛋白相对表达水平比较Table 3 Comparison on apoptosis rates and relative expression levels of apoptosis proteins in brain tissues of each group(±s,n=15)
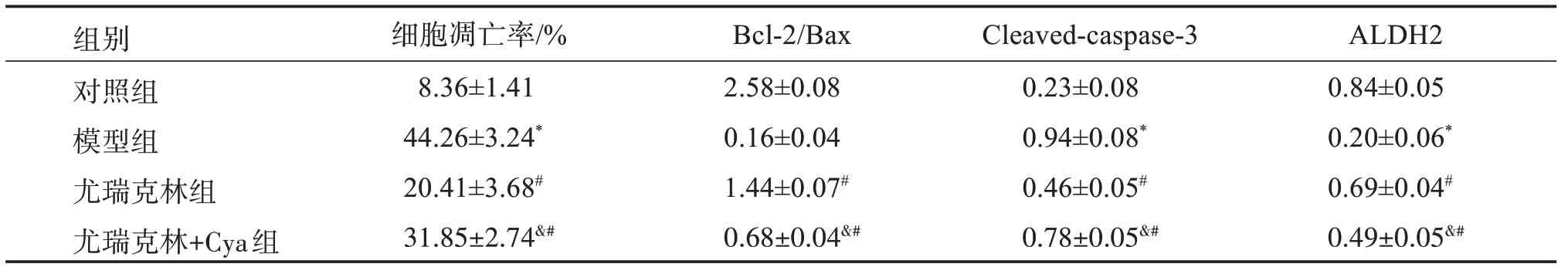
表3 各组大鼠脑组织细胞凋亡率及凋亡蛋白相对表达水平比较Table 3 Comparison on apoptosis rates and relative expression levels of apoptosis proteins in brain tissues of each group(±s,n=15)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与尤瑞克林组比较:&P<0.05。
组别对照组模型组尤瑞克林组细胞凋亡率/%8.36±1.41 44.26±3.24*20.41±3.68#Bcl‑2/Bax 2.58±0.08 0.16±0.04 1.44±0.07#Cleaved‑caspase‑3 0.23±0.08 0.94±0.08*0.46±0.05#ALDH2 0.84±0.05 0.20±0.06*0.69±0.04#尤瑞克林+Cya组31.85±2.74�.68±0.04�.78±0.05�.49±0.05&#
表4 各组脑组织SOD、CAT、MDA水平比较Table 4 Comparison of SOD,CAT and MDA levels in brain tissues of each group(±s,n=15)

表4 各组脑组织SOD、CAT、MDA水平比较Table 4 Comparison of SOD,CAT and MDA levels in brain tissues of each group(±s,n=15)
与对照组比较:*P<0.05;与模型组比较:#P<0.05;与尤瑞克林组比较:&P<0.05。
组别对照组模型组尤瑞克林组尤瑞克林+Cya组SOD/(U·L-1)16.39±1.74 3.98±1.05*13.69±1.87#7.98±1.85&#MDA/(mmol·mL-1)14.99±1.69 49.62±2.84*26.98±2.87#37.11±3.22&#CAT/(U·L-1)21.94±2.99 8.96±1.42*17.58±2.34#12.67±2.41&#
表5各组脑组织TNF‑α、IL‑6、IL‑1β含量比较

与对照组比较:*P<0.05;与模型组比较:#P<0.05;与尤瑞克林组比较:&P<0.05。
Table 5Comparison on the levels of TNF‑α,IL‑6 and IL‑1βin brain tissues of each group(±s,n=15)高机体自身抵抗力,但是过度的氧化应激会超出机体自身SOD、CAT 清除氧自由基能力,过量的氧化应激反应会发生细胞膜攻击和细胞膜结构被破坏,对细胞产生细胞毒性损伤,并给机体造成损伤,而MDA 就是此损伤过程中的代谢产物之一[16]。糖尿病患者自身血糖一直处于较高水平,机体处于应激状态,脑组织缺氧缺血会加重这种应激状态,高血糖还会加重内皮细胞损伤,炎症反应增强可促进血小板等物质在损伤处聚集,加重脑缺血缺氧性损伤。本研究结果显示尤瑞克林可以降低糖尿病合并脑缺缺血再灌注大鼠脑组织MDA、TNF‑α、IL‑6、IL‑1β水平和提高SOD、CAT 活性,而Cya 可以部分逆转这种趋势。已有研究[17]表明抑制ALDH2 表达可以明显提高脂多糖诱导下的心肌细胞的IL‑6 和TNF‑α水平升高,并促进细胞凋亡。还有学者[18]研究显示ALDH2 可在氯胺酮所致的膀胱炎中发挥抗炎、抗纤维化的作用,Tsai 等[19]发现ALDH2 可以通过减少活性氧、血管炎症和血管平滑肌细胞凋亡来预防腹主动脉瘤的发生。本研究结果也呈现出相似的趋势,说明尤瑞克林对糖尿病合并脑缺血再灌注大鼠神经损伤、氧化应激和炎症反应的改善作用可能与提高ALDH2表达有关。
综上所述,尤瑞克林可改善糖尿病合并脑缺血再灌注大鼠神经损伤、细胞凋亡和氧化应激、炎症反应,其发挥这些作用可能与提高ALDH2 表达有关,但其中的详细机制还需要在分子生物学层面开展探讨。
