一测多评法同时测定土茯苓配方颗粒中5种成分的含量
2022-04-26何荣荣严玉晶王瑜婷田清清徐东婷余欣彤魏梅
何荣荣,严玉晶,王瑜婷,田清清,徐东婷,余欣彤,魏梅
(广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东佛山528244)
土茯苓为百合科植物光叶菝葜Smilax glabraRoxb.的干燥根茎,始载于《本草经集注》,别称禹余粮、过山龙、刺猪苓等,其味甘、淡,性平,归肝、胃经,具有解毒、除湿、通利关节的功效[1]。土茯苓主要含有黄酮类、皂苷类、生物碱类、有机酸类、苯丙素类、鞣质等多种有效成分,是治疗痛风的传统中药,具有抗炎、抗氧化、抗肿瘤、保护肝损伤、免疫调节、利尿、抑菌等诸多药理活性[2‑6]。
国家药品监督管理局颁发的土茯苓配方颗粒质量标准含量测定项下只规定了落新妇苷的含量[7],而中药成分复杂多样,单一指标成分的定量分析模式,难以全面反映土茯苓配方颗粒的质量,不能满足中药现代化对质量控制的要求。一测多评法(quantitative analysis of multi‑components by single‑maker,QAMS)是根据中药有效成分内在函数关系和比例关系,只测定一个成分(对照品易得、稳定者)即可实现多个成分(对照品匮乏者)的同步测定[8],是一种用于多成分质量控制的新模式。本研究以相对价廉、易得的落新妇苷为内标物,通过相对校正因子(relative correction fator,RCF)计算各待测成分的质量分数,并与外标法(esternal standard method,ESM)测定结果进行对比,考察QAMS 在土茯苓配方颗粒多指标成分质量评价中的准确性、适用性,以期为土茯苓配方颗粒的质量控制提供参考。
1 仪器与材料
1.1 仪器
Waters H‑CLASS 型超高效液相色谱仪(美国Waters公司);Agilent 1290型超高效液相色谱仪(美国Agilent公司);XP26型百万分之一天平、ME204E型万分之一天平(瑞士METTLER TDLEDO 公司);Milli‑Q Direct 型超纯水系统(德国Merck 公司);KQ‑500DE 型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
新落新妇苷(批号:DSTDX007701,纯度≥98%)、新异落新妇苷(批号:DXTDX021601,纯度≥98%)、异落新妇苷(批号:DXTDX007801,纯度≥95%)对照品均购自成都德思特生物技术有限公司;落新妇苷(批号:111798‑201805,纯度93.6%)、黄杞苷(批号:111906‑201102,纯度93.7%)对照品均购自中国食品药品检定研究院;甲醇、乙腈为色谱纯(德国Merck公司);乙酸为色谱纯(天津市科密欧化学试剂有限公司);水为超纯水,其他试剂为分析纯。10 批土茯苓配方颗粒(编号S1-S10)由广东一方制药有限公司制备,具体批号见表1。
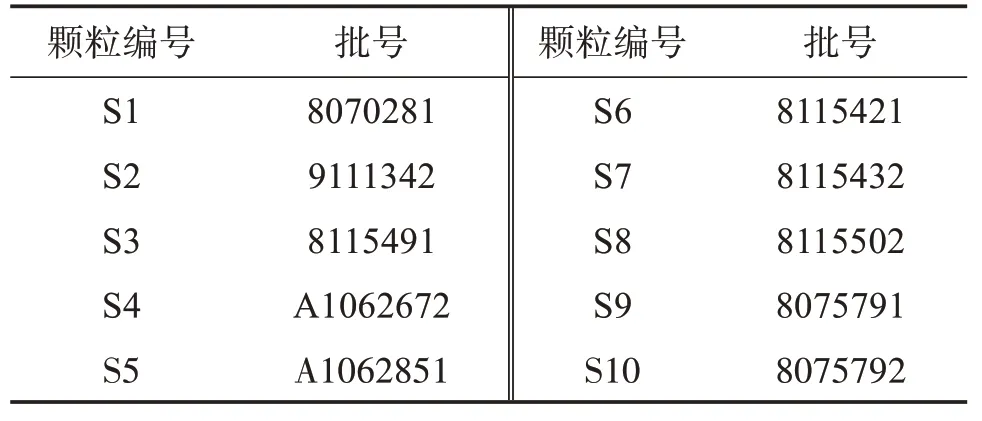
表1 样品信息表Table 1 Sample information table
2 方法与结果
2.1 色谱条件[7]
色谱柱:Agilent ZORBAX SB‑C18(100 mm×2.1 mm,1.8 μm);流动相:乙腈(A)‑0.2%乙酸溶液(B)梯度洗脱(0~2 min,13%A;2~5 min,13%~17%A;5~14 min,17%~23%A);检测波长:291 nm;柱温:30 ℃;流速:0.4 mL/min;进样量:1 μL。
2.2 混合对照品溶液的制备
分别取新落新妇苷、落新妇苷、新异落新妇苷、异落新妇苷、黄杞苷适量,精密称定,置25 mL 量瓶中,加60%(体积分数,下同)甲醇定容至刻度,制成质量浓度分别为49.705 6、46.949 8、48.222 0、49.666 4、47.149 8 μg/mL的混合对照品溶液。
2.3 供试品溶液的制备
取土茯苓配方颗粒适量,研细,取约0.1 g,精密称定,置具塞锥形瓶中,精密加入70%(体积分数,下同)乙醇100 mL,称定质量,超声处理(功率300 W,频率45 kHz)40 min,放冷,再称定质量,用70%乙醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.4 方法学考察
2.4.1 专属性试验分别精密吸取空白溶剂、混合对照品溶液及供试品溶液,按“2.1”项下色谱条件进样测定,结果见图1。可见,供试品溶液色谱与混合对照品溶液色谱在相应的保留时间处具有相同的色谱峰,且空白溶剂无干扰,表明方法专属性良好。
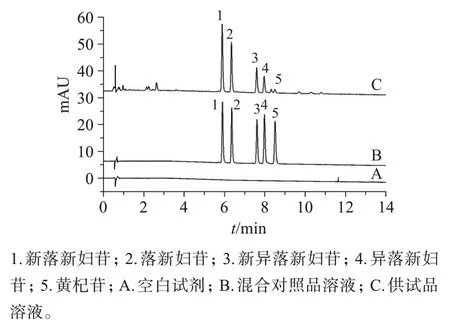
图1 专属性试验UPLC色谱图Figure 1 UPLC chromatograms of specificity test
2.4.2 线性关系考察分别精密吸取“2.2”项下混合对照品溶液0.2、1、2、4、6、8 mL 置10 mL 量瓶中,加60%甲醇定容至刻度,得线性混合对照品溶液。按“2.1”项下色谱条件进样测定,记录色谱图。以对照品溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线,结果见表2,表明各成分在各自浓度范围内线性关系良好。
2.4.3 精密度试验精密吸取“2.2”项下混合对照品溶液,按“2.1”项下色谱条件连续进样6 次,计算新落新妇苷、落新妇苷、新异落新妇苷、异落新妇苷、黄杞苷峰面积的RSD 值分别为0.05%、0.22%、0.13%、0.18%、0.12%,表明仪器精密度良好。
2.4.4 重复性试验取土茯苓配方颗粒(编号S1)适量,按“2.3”项下方法平行制备6 份供试品溶液,按“2.1”项下色谱条件进样测定,计算新落新妇苷、落新妇苷、新异落新妇苷、异落新妇苷、黄杞苷的平均质量分数分别为1.74%、1.30%、0.84%、0.51%、0.11%,其RSD 值分别为1.33%、1.46%、1.55%、1.34%、2.34%,表明方法重复性良好。
2.4.5 稳定性试验取土茯苓配方颗粒(编号S1)适量,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件分别在0、2、4、6、8、12 h 进样测定,计算新落新妇苷、落新妇苷、新异落新妇苷、异落新妇苷、黄杞苷峰面积的RSD 值分别为0.57%、0.68%、0.34%、0.61%、1.41%,表明供试品溶液在12 h 内稳定性良好。
2.4.6 加样回收率试验取已知质量分数的土茯苓配方颗粒(编号S1)适量,研细,精密称取9 份,每份约0.05 g,置具塞锥形瓶中,分为3组,分别精密加入相当于供试品中各被测成分质量分数50%、100%、150%的混合对照品溶液(新落新妇苷、落新妇苷、新异落新妇苷、异落新妇苷、黄杞苷质量浓度分别为52.420 2、61.177 0、40.935 5、23.373 0、6.156 1 μg/mL),挥干溶剂,按“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定,计算加样回收率和RSD,结果见表3,表明该方法准确性良好。
2.5 相对校正因子(RCF)的确定[9‑10]
分别精密吸取“2.2”项下混合对照品溶液0.2、0.5、0.8、1.0、1.5、2.0 μL,按“2.1”项下色谱条件进样测定,以落新妇苷为内标物,按公式fj/s=fj/fs=(Aj*Cs)/(As*Cj)(As、Aj分别为内标物和待测成分峰面积,Cs、Cj分别为内标物和待测成分质量浓度)计算新落新妇苷、新异落新妇苷、异落新妇苷、黄杞苷的RCF,结果见表4。
2.6 耐用性和系统适应性研究[11‑12]
2.6.1 不同仪器及色谱柱对RCF 的影响以落新妇苷为内标物,考察其他4 种成分在Waters H‑CLASS、Agilent 1290 型2 种超高效液相色谱系统,Waters HSS T3(100 mm×2.1 mm,1.8 μm)、Waters CORTECS T3(100 mm×2.1 mm,1.8 μm)、Agilent ZORBAX SB‑C18(100 mm×2.1 mm,1.8 μm)3 种色谱柱下的RCF,结果见表5。可见,各成分RCF 的RSD 均小于3%,表明不同的仪器和色谱柱对各成分RCF无显著影响。
2.6.2 不同柱温对RCF的影响采用Waters H‑CLASS型超高效液相色谱仪、Agilent ZORBAX SB‑C18柱(100 mm×2.1 mm,1.8 μm),考察3 种不同柱温(25、30、35 ℃)对各成分RCF 的影响,结果见表6。可见,各成分RCF的RSD 均小于3%,表明柱温的变化对各成分RCF无显著影响。
2.6.3 不同流速对相对校正因子的影响采用Waters H‑CLASS 型超高效液相色谱仪、Agilent ZORBAX SB‑C18柱(100 mm×2.1 mm,1.8 μm),考察3 种不同流速(0.2、0.3、0.4 mL/min)对各成分RCF的影响,结果见表7。可见,各成分RCF 的RSD 均小于3%,表明流速的变化对各成分RCF无显著影响。
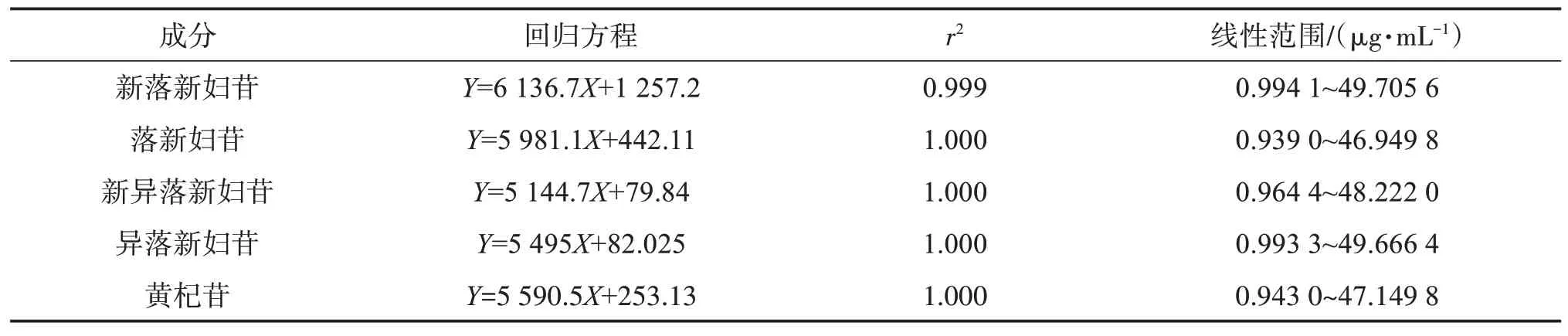
表2 线性关系考察结果Table 2 Results of linear relationship
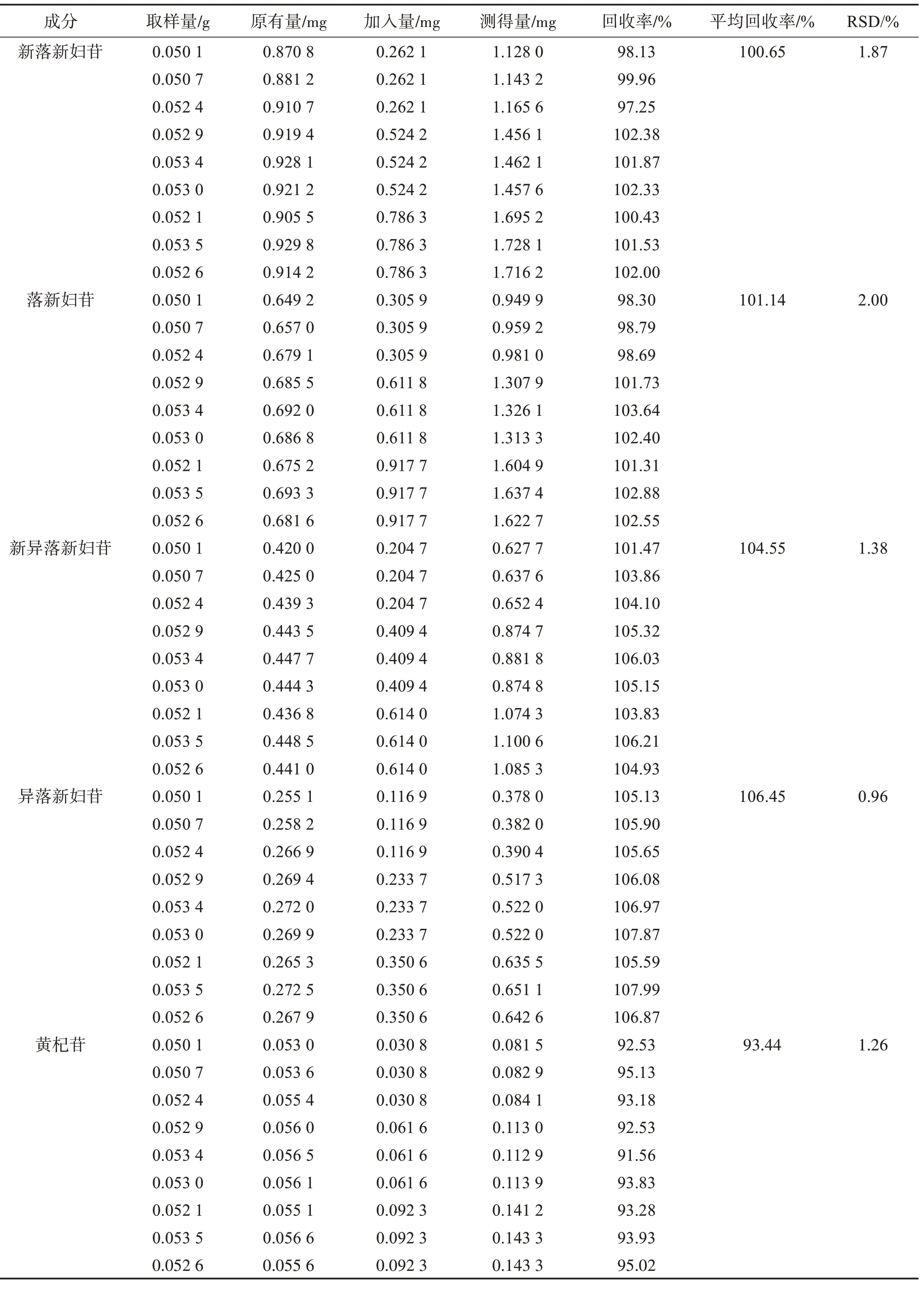
表3 土茯苓配方颗粒中5种成分的加样回收率试验结果Table 3 Sample recovery test results of 5 components inSmilax glabraformula granules
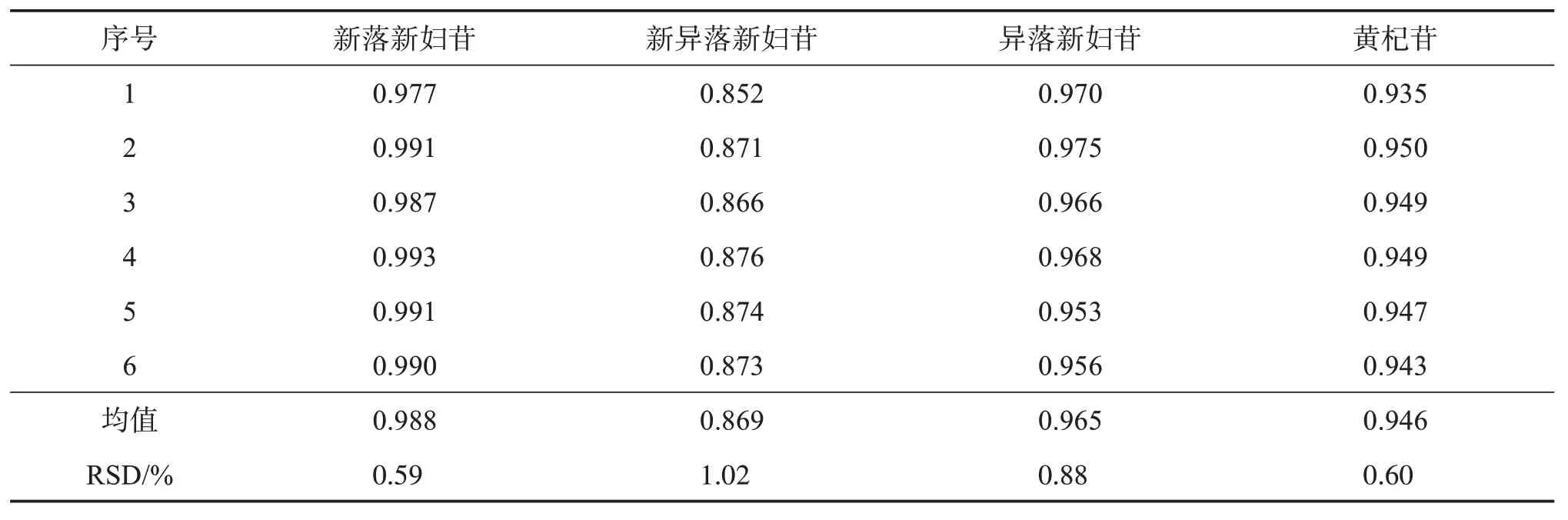
表4 各成分的RCFTable 4 RCF of various constituents
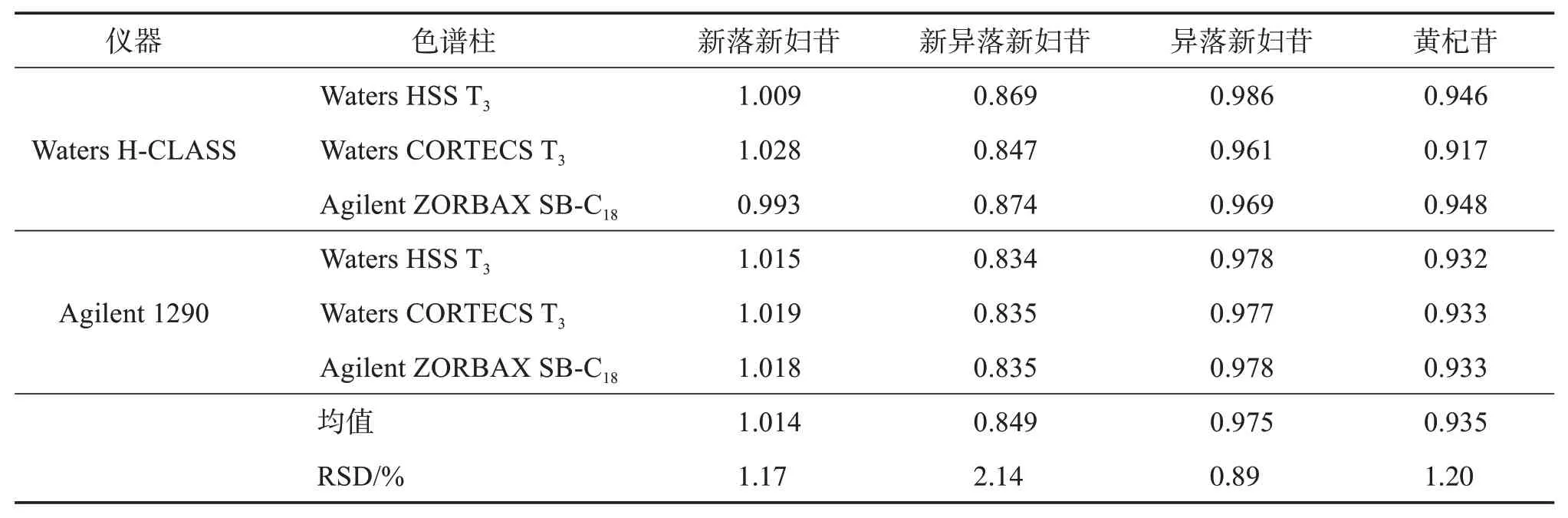
表5 不同仪器、色谱柱下各成分的RCFTable 5 Effects of different instruments and columns on RCF
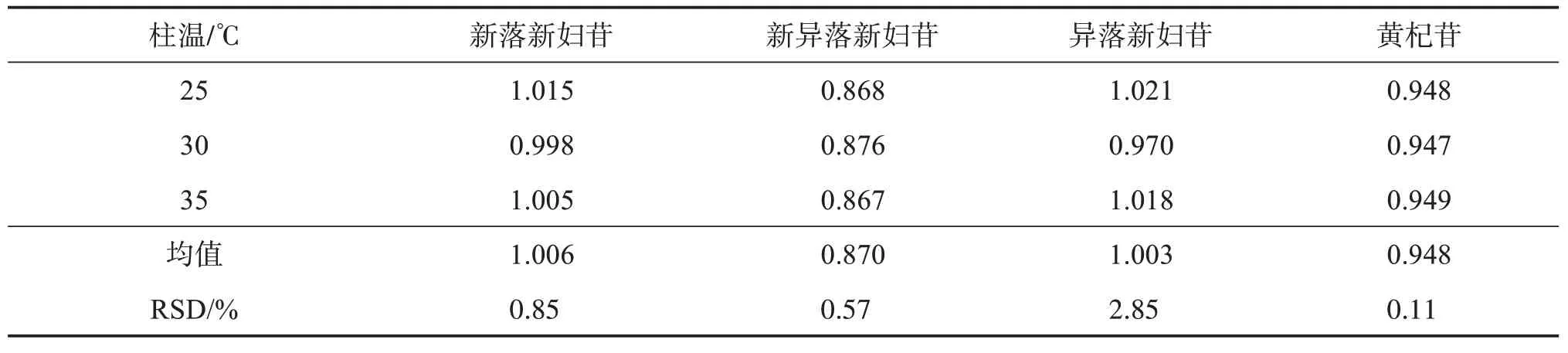
表6 不同柱温下各成分的RCFTable 6 Effects of different column temperature on RCF
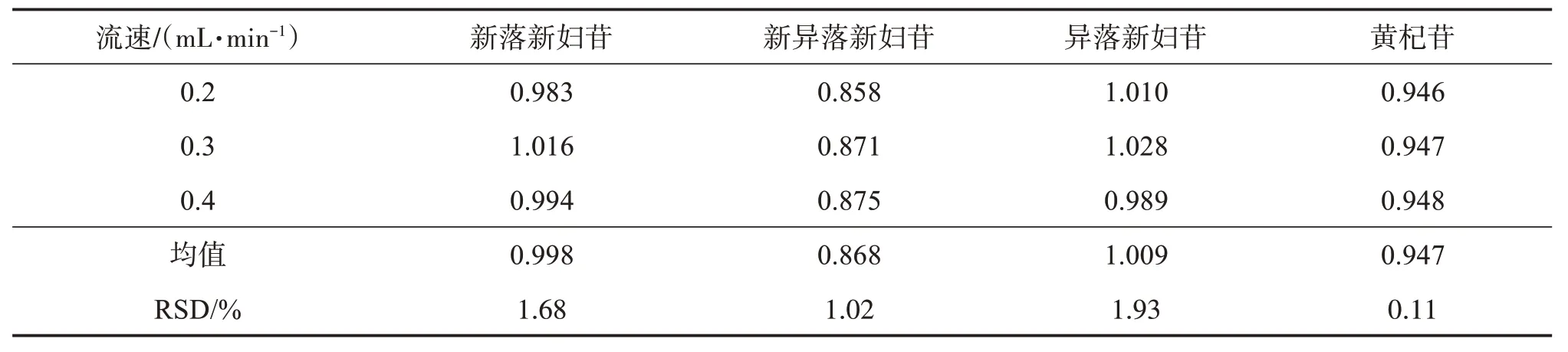
表7 不同流速下各成分的RCFTable 7 Effects of different flow rates on RCF
2.7 待测成分色谱峰的定位
一测多评法可利用相对保留时间法、保留时间差法来准确定位各待测成分色谱峰[13‑14]。本研究以落新妇苷为内标物,考察其他4 种成分在Waters H‑CLASS、Agilent 1290 型2 种超高效液相色谱系统,Waters HSS T3(100 mm×2.1 mm,1.8 μm)、Wa‑ters CORTECS T3(100 mm×2.1 mm,1.8 μm)、Agi‑lent ZORBAX SB‑C18(100 mm×2.1 mm,1.8 μm)3 种色谱柱下的相对保留时间,以此增加各定位组分的可信度,结果见表8。可见,各成分相对保留时间的RSD 均小于3%,表明采用相对保留时间进行色谱峰定位是可行的。
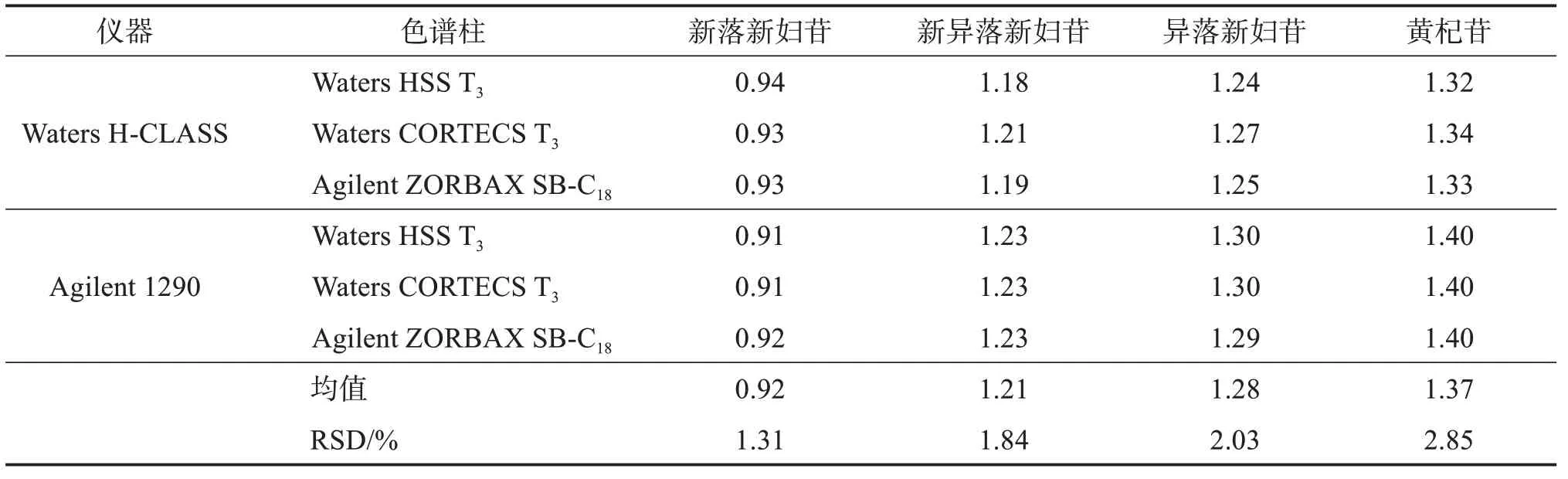
表8 各成分的相对保留时间Table 8 Relative retention time of various constituents
2.8 QAMS与ESM比较
取10 批土茯苓配方颗粒,按“2.3”项方法制备供试品溶液,按“2.1”项下色谱条件进样测定,运用SPSS20.0 软件对ESM 实测值和QAMS 计算结果进行成对t检验及Pearson相关系数(r)分析,结果见表9。可见,2 种方法之间的相关系数r均为1.000,t检验显示差异无统计学意义(P>0.05),表明建立的QAMS准确、可行。
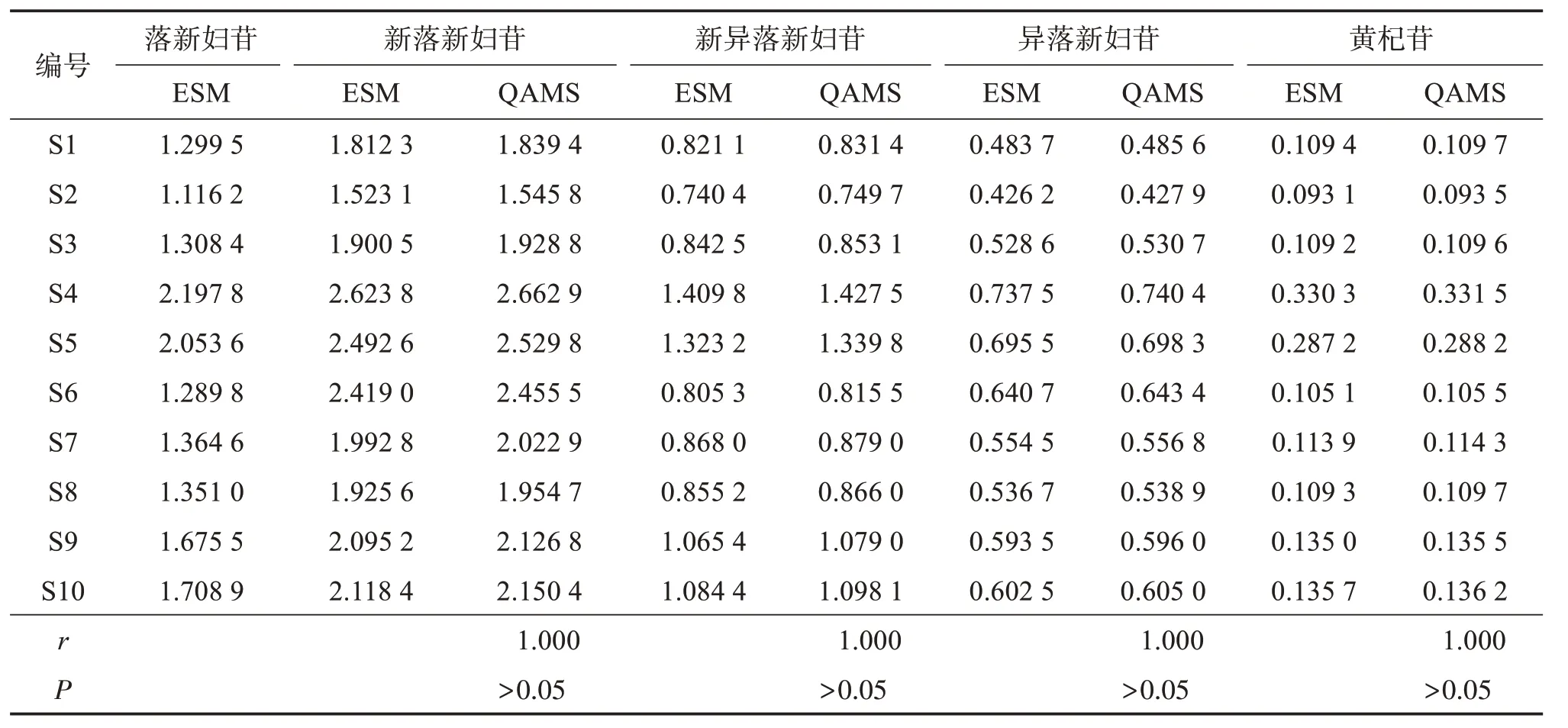
表9 ESM与QAMS测定结果比较Table 9 Comparison of results obtained by ESM and QAMS method w/(g·100 mg-1)
3 讨论
中药成分的复杂性和多效性致使单一指标成分的定量测定难以体现其整体质量,建立多成分质量分数测定方法能更全面地反映其内在质量。传统的ESM 进行多成分检测时需用到多种对照品,且有些中药化学对照品价格昂贵、不易获得,QAMS只需1 种对照品即可计算其他多个成分的质量分数,可以有效解决对照品稀缺问题,节约检验成本、提高检测效率。
土茯苓的主要有效成分为黄酮类化合物,包括黄酮醇类、二氢黄酮类、异黄酮类和黄烷醇类等,这些成分与其抗炎、抗癌、抑菌等药理作用密切相关[15]。已有将QAMS应用于土茯苓药材中5种黄酮类成分含量测定的报道,结果表明建立的方法稳定可行[16]。中药配方颗粒是由单味中药饮片经水提、浓缩、干燥、制粒等工序制得的一种颗粒剂,具有疗效确切、服用方便、患者顺应性强等优点,具有良好的发展前景,对其产品质量的全面把控也尤为重要。本研究将新落新妇苷、落新妇苷、新异落新妇苷、异落新妇苷、黄杞苷5种黄酮类成分作为土茯苓配方颗粒质量控制的指标,选择化学性质较稳定且价格适中的落新妇苷为内标物,建立了土茯苓配方颗粒中5 种黄酮类成分的QAMS,确定了4 种成分的RCF。结果表明,不同仪器、色谱柱、柱温及流速等外部条件对RCF 无显著影响,且各待测成分色谱峰的相对保留时间均稳定。采用QAMS 与ESM 2种方法测定10 批土茯苓配方颗粒中5 种黄酮类成分的质量分数,所得结果基本一致,说明建立的QAMS 法科学、可靠,可为土茯苓配方颗粒多指标质量控制研究提供参考。
