菟丝子饮片、水煎液和配方颗粒的HPLC 指纹图谱相关性研究
2022-04-26姚晓璇王瑜婷邱彩月何荣荣陈铭恩黎桃敏刘燎原
姚晓璇,王瑜婷,邱彩月,何荣荣,陈铭恩,黎桃敏,刘燎原
(广东一方制药有限公司/广东省中药配方颗粒企业重点实验室,广东佛山528244)
菟丝子为旋花科植物南方菟丝子Cuscuta australisR.Br.或菟丝子Cuscuta chinensisLam.的干燥成熟种子。始载于《神农本草经》,被列为上品。菟丝子性平,味辛、甘,具有补益肝肾、固精缩尿、安胎明目的功效[1‑2]。现代研究表明,菟丝子主要包括黄酮类、有机酸、多糖、木脂素类、氨基酸和生物碱等成分,其主要药理作用有保肝、抗骨质疏松、调节免疫、抗氧化、肿瘤、增强内分泌系统功能、抑制黑色素合成等[3‑4],具有良好的药用价值。
中药配方颗粒是以中药饮片为原料,经水提、浓缩、干燥、制粒而成的可供中医临床调配使用的颗粒制剂[5],中药配方颗粒是中药汤剂的一种现代剂改形式,是中药饮片的一种补充。中药配方颗粒与中药汤剂之间的差异来源于汤液浓缩、干燥过程中相关成分的物理遗失与化学变化[6]。目前,有关菟丝子药材的化学成分测定和指纹图谱研究较多[7‑9],尚无对菟丝子及其制剂产品相关性研究的报道。本研究分别建立了菟丝子饮片、水煎液、配方颗粒的HPLC指纹图谱,比较3者之间HPLC指纹图谱的相关性和差异性,探讨菟丝子配方颗粒制备过程中的化学成分转化,确保颗粒剂与汤剂质量的一致性,以期为菟丝子配方颗粒的质量控制和临床安全有效用药提供参考。
1 仪器与试药
1.1 仪器
Waters Arc 型高效液相色谱仪(美国Waters 公司);XP26 型百万分之一天平、ME204E 型万分之一天平(瑞士METTLER TOLEDO 公司);Milli‑Q Direct 型超纯水系统(德国Merck 公司);SODA‑12型喷雾干燥机(上海大川原干燥设备有限公司);LGS20 型干法制粒机(南京迦南科技有限公司);YRE‑501 型旋转蒸发仪(巩义市予华仪器有限责任公司);DLSB‑5/20 型低温冷却液循环水泵(郑州长城科工贸有限公司);KQ‑500DE 型数控超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药
绿原酸(批号:110753‑202018,纯度96.1%)、金丝桃苷(批号:111521‑201809,纯度94.9%)、异槲皮苷(批号:111809‑201804,纯度97.2%)对照品均购自中国食品药品检定研究院;隐绿原酸(批号:DST210427‑035,纯度98.24%)对照品购自成都乐美天医药科技有限公司;乙腈、甲醇为色谱纯(德国Merck 公司),磷酸为色谱纯(天津市科密欧化学试剂有限公司),水为超纯水,其余试剂均为分析纯。
16 批菟丝子药材(样品编号为S1-S16)经广东一方制药有限公司魏梅主任药师鉴定为正品,均为南方菟丝子Cuscuta australisR. Br.的干燥成熟种子,药材产地信息见表1。16批菟丝子饮片(样品编号为Y1-Y16)严格按照2020 年版《中国药典》一部菟丝子项下饮片炮制规定进行炮制[1];16 批菟丝子水煎液(样品编号为T1-T16)严格按照《医疗机构中药煎药室管理规范》相关要求进行煎煮[10],取每批菟丝子的提取液,减压浓缩,定容至100 mL,得样品水煎液;16批菟丝子配方颗粒(样品编号为P1-P16)由水煎液经浓缩、干燥、制粒等步骤得到。

表1 16批菟丝子药材的来源信息Table 1 Source information of 16 batches of Cuscutae Semen
2 方法与结果
2.1 色谱条件[11]
色谱柱:Xselect HSS T3(250 mm × 4.6 mm,5 μm);流动相:乙腈(A)‑0.1%磷酸溶液(B)梯度洗脱(0~30 min,7%~12%A;30~35 min,12%~15%A;35~55 min,15%A;55~80 min,15%~30%A;80~85 min,30%~93%A;85~90 min,93%A);流速:1.0 mL/min;柱温:30 ℃;检测波长:360 nm;进样量:5 μL。
2.2 对照品溶液的制备
分别取绿原酸、隐绿原酸、金丝桃苷、异槲皮苷对照品适量,精密称定,加甲醇制成质量浓度分别为78.42、62.20、58.27、56.86 μg/mL 的混合对照品溶液。
2.3 供试品溶液的制备
2.3.1 菟丝子饮片供试品溶液取菟丝子饮片粉末(过四号筛)约1.0 g,精密称定,置具塞锥形瓶中,精密加入70%(体积分数,下同)甲醇50 mL,称定质量,加热回流30 min,取出,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得饮片供试品溶液。
2.3.2 菟丝子水煎液供试品溶液精密吸取混合均匀的菟丝子水煎液10 mL,置50 mL 量瓶中,加水5 mL,加甲醇定容至刻度,称定质量,超声处理(300 W,45 kHz)30 min,取出,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得水煎液供试品溶液。
2.3.2 菟丝子配方颗粒供试品溶液取菟丝子配方颗粒适量,研细,取约0.2 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇25 mL,称定质量,超声处理(300 W,45 kHz)30 min,取出,放冷,再称定质量,用70%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得配方颗粒供试品溶液。
2.4 方法学考察
2.4.1 专属性试验分别精密吸取空白溶剂、对照品溶液及供试品溶液,按“2.1”项色谱条件进样测定,结果见图1。可见,供试品溶液色谱在与对照品溶液色谱相应的保留时间处具有相同的色谱峰,且空白溶剂无干扰,表明方法专属性良好。

图1 专属性试验HPLC色谱图Figure 1 The HPLC chromatograms of specific test
2.4.2 精密度试验精密吸取“2.2”项对照品溶液,按“2.1”项色谱条件连续进样6 次,以5 号峰金丝桃苷为参照峰,计算得各共有峰相对保留时间和相对峰面积的RSD 范围分别为0.15%~0.22%和0.23%~0.64%,表明仪器精密度良好。
2.4.3 稳定性试验取菟丝子饮片(编号Y16),精密称定,按“2.3.1”项方法制备供试品溶液,分别于制备0、4、8、12、24、48 h 后按“2.1”项色谱条件进样测定,以5号峰金丝桃苷为参照峰,计算得各特征峰相对保留时间和相对峰面积的RSD 范围分别为0.16%~1.21%和1.32%~2.57%,表明菟丝子饮片供试品溶液在48 h内稳定性良好。
2.4.4 重复性试验取菟丝子饮片(编号Y16)6 份,精密称定,按“2.3.1”项方法制备供试品溶液,按“2.1”项色谱条件进样测定。以5 号峰金丝桃苷为参照峰,计算得各特征峰相对保留时间和相对峰面积的RSD 范围分别为0.10%~0.12% 和0.13%~2.20%,表明方法重复性良好。
2.5 HPLC指纹图谱的建立与相似度评价
2.5.1 指纹图谱的建立分别取16 批菟丝子饮片、水煎液和配方颗粒,按“2.3”项方法分别制备供试品溶液,按“2.1”项色谱条件进样测定,记录色谱图。采用国家药典委员会颁布的“中药色谱指纹图谱相似度评价系统2012 版”对色谱图进行匹配,确定菟丝子饮片、水煎液、配方颗粒均有8 个共有峰,如图2-4 所示。通过与对照品图谱对比,确定1 号峰为绿原酸,2 号峰为隐绿原酸,5 号峰为金丝桃苷,6号峰为异槲皮苷。

图2 16批菟丝子饮片的HPLC指纹图谱叠加图Figure 2 The HPLC fingerprints of 16 batches of Cuscutae Semen pieces
2.5.2 相似度评价分别将16 批菟丝子饮片、水煎液、配方颗粒HPLC指纹图谱导入“中药色谱指纹图谱相似度评价系统2012 版”软件,分别计算各批次菟丝子饮片、水煎液、配方颗粒HPLC指纹图谱与其对照图谱的相似度,结果见表2。可见,16批菟丝子饮片、水煎液、配方颗粒HPLC指纹图谱与其相应对照指纹图谱(R1、R2、R3)的相似度均大于0.900,表明不同批次菟丝子饮片、水煎液、配方颗粒的质量较为稳定。
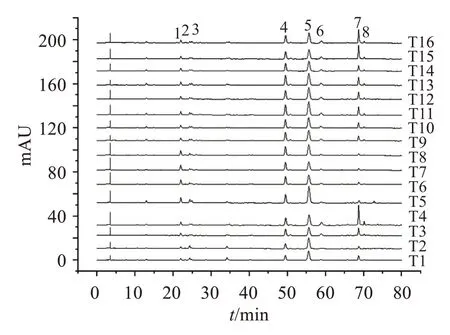
图3 16批菟丝子水煎液的HPLC指纹图谱叠加图Figure 3 The HPLC fingerprints of 16 batches of Cuscutae Semen water decoction

图4 16批菟丝子配方颗粒的HPLC指纹图谱叠加图Figure 4 The HPLC fingerprints of 16 batches of Cuscutae Semen formula granules
2.5.3 对照指纹图谱的比较分别将16批菟丝子饮片、水煎液和配方颗粒指纹图谱生成的对照指纹图谱R1、R2 和R3(见图5)导入“中药色谱指纹图谱相似度评价系统2012版”软件,结果显示:与菟丝子饮片比较,菟丝子水煎液和配方颗粒的相似度分别为0.998 和0.997,菟丝子水煎液和配方颗粒指纹图谱相似度为1.000,表明菟丝子饮片、水煎液与配方颗粒成分基本一致,菟丝子水煎液在提取、浓缩、干燥、制粒过程中,其成分种类无明显变化。

表2 16 批菟丝子饮片、水煎液和配方颗粒HPLC 指纹图谱相似度评价结果Table 2 Results of similarity analysis of 16 batches of Cuscu‑tae Semen pieces,water decoction,formula granules

图5 菟丝子饮片对照指纹图谱(R1)、水煎液对照指纹图谱(R2)和配方颗粒对照指纹图谱(R3)Figure 5 Reference fingerprints of Cuscutae Semen pieces,water decoction,formula granules by HPLC
2.6 化学模式识别研究
2.6.1 共有峰相关性分析采用SPSS 26.0 软件,以16批菟丝子饮片、水煎液和配方颗粒共48个样品各特征峰的“峰面积占比”值(各特征峰峰面积占特征峰总面积的比例)为变量进行皮尔逊相关性分析,结果见表3。可见,菟丝子饮片与水煎液或配方颗粒比较,除色谱峰峰3 外,菟丝子饮片、水煎液及其配方颗粒的7 个共有峰均具有显著的正相关性;菟丝子水煎液与配方颗粒比较,8 个峰均具有极显著的正相关性。

表3 16批菟丝子饮片、水煎液、配方颗粒指纹图谱共有峰的相关性分析结果Table 3 Correlation analysis results of common peaks of Cuscu‑tae Semen pieces,water decoction and formula granules
2.6.2 聚类分析采用SPSS 26.0 软件,以16 批菟丝子饮片、水煎液和配方颗粒共48个样品各特征峰面积为变量进行聚类分析[12],结果见图6。可见,当距离为10 时,48 批样品可以分为4 类,Y6-Y8、T1-T16、P1-P4、P6-P16 聚为一类,Y3-Y4、Y9-Y16 聚为一类,Y2、Y5、P5 聚为一类,Y1 单独聚为一类。表明甘肃与黑龙江产地与其他2个产地的菟丝子饮片存在差异,菟丝子水煎液与配方颗粒之间无明显差异,可聚为一类。
2.6.3 主成分分析(PCA) 采用SPSS 26.0 软件,对16批菟丝子饮片、水煎液和配方颗粒共48个样品各特征峰面积的标准化值(Xi)进行主成分分析,主成分结果以特征值>1 为标准提取得到2 个主成分,计算得特征值和方差贡献率见表4,主成分因子载荷矩阵见表5。由结果可知,前2个主成分累积贡献率为78.80%,表明提取的2 个主成分能反映菟丝子指纹图谱的大部分信息。主成分1 的特征值为3.958,方差贡献率为49.48%,载荷较高的峰有绿原酸、峰4、金丝桃苷、异槲皮苷、峰7 和峰8,表明这6 个峰主要反映主成分1的信息;主成分2的特征值为2.345,方差贡献率为29.32%,载荷较高的峰有隐绿原酸、峰3,表明这2个峰主要反映主成分2的信息。


表4 菟丝子饮片、水煎液和配方颗粒主成分分析特征值及方差贡献率Table 4 Characteristic value and variance contribution rate of Cuscutae Semen pieces,water decoction,formula granules

表5 菟丝子饮片、水煎液和配方颗粒主成分因子载荷矩阵Table 5 Factors loading matrix of Cuscutae Semen pieces,water decoction,formula granules

图7 菟丝子饮片、水煎液和配方颗粒HPLC 指纹图谱主成分得分图Figure 7 PCA Score plot of principal component analysis of Cuscutae Semen pieces,water decoction,formula granules
2.6.4 正交偏最小二乘判别分析(OPLS‑DA) 采用SIMCA 14.1 软件,以16 批菟丝子饮片、水煎液和配方颗粒共48 个样品各特征峰峰面积为变量进行OPLS‑DA 分析,结果见图8-9。由模型参数可知,数据矩阵的解释率参数R2X(cum)=0.900,模型区分参数R2Y(cum)=0.702,模型预测参数Q2=0.651,均>0.500,表明该数学模型稳定可靠[15‑16]。48 个样品可分成3 类。以VIP 值>1 为提取标准,得到峰3、金丝桃苷、峰4是影响分类的主要标志性成分。

图8 菟丝子饮片、水煎液和配方颗粒HPLC 指纹图谱OPLS‑DA得分图Figure 8 OPLS‑DA Score plot of Cuscutae Semen pieces,waterdecoction,formula granules
3 讨论
中药配方颗粒既保留了传统中医药辨证论治、复方配伍、随证加减的优势和特色,同时弥补了传统中药汤剂煎煮费时、储存携带不便等不足,相比中药饮片具有更高的附加值,更能体现中药用药的现代化、规范化和标准化,是对传统中药的重要创新[17]。目前中药配方颗粒与中药饮片水煎液的成分对比研究,大多以单个指标成分含量进行比较,整体成分比较的研究较少,不能全面反映中药质量水平。中药指纹图谱是中药整体性的化学表征,可以直观地反映制备工艺的稳定性和配方颗粒的质量,是中药配方颗粒进行质量控制的重要方法[18]。

图9 菟丝子饮片、水煎液和配方颗粒HPLC 指纹图谱VIP值Figure 9 Result of VIP of Cuscutae Semen pieces,water decoc‑tion,formula granules
本文建立的菟丝子饮片、水煎液和配方颗粒HPLC指纹图谱及分析方法共确定了8个共有峰,并指认了其中4个共有峰分别为绿原酸、隐绿原酸、金丝桃苷和异槲皮苷。相似度评价结果显示,16 批菟丝子饮片、水煎液和配方颗粒均与相应的对照指纹图谱的相似度较高,表明不同批次的菟丝子整体的化学成分具有较好的一致性;水煎液和配方颗粒的制备工艺稳定。散点图中点与点之间的距离代表各样品之间存在的差异程度[19]。CA、PCA和OPLS‑DA结果显示,不同批次菟丝子饮片较为分散,不同批次水煎液、配方颗粒之间较为紧密,表明经过水煎煮后菟丝子中各类化学成分具有较好的一致性;饮片与水煎液、配方颗粒之间的差异较大,可能是由于菟丝子中的热敏性成分(如绿原酸)经过煎煮后含量发生变化;水煎液和配方颗粒之间的关系较为紧密,差异较小,表明菟丝子从水煎液到配方颗粒的制备过程中各类化学成分得到了较好地保留。由皮尔逊相关性分析可得,除峰3 外,其他7 个峰均具有显著正相关性。该方法能较好地反映三者的相关性及差异性,可为菟丝子配方颗粒的生产过程和质量控制提供依据。
