盐胁迫下3种外源物对高羊茅生理指标的影响
2022-04-26林之林于景金杨志民
林之林,郝 田,于景金,杨志民
(南京农业大学草业学院, 江苏 南京 210095)
盐胁迫作为非生物胁迫之一,是限制作物生长的一个重要的环境因素[1-2],导致草类植物发育不良和秋季早衰[3]。随着人类对土壤的不合理利用,土壤盐渍化已成为世界农业生产最大的环境威胁之一[4]。预计到2050年,将有50%可耕地严重盐碱化[5]。盐胁迫对植物的伤害主要体现在两个方面,分别为渗透胁迫和离子毒害。盐胁迫使植物细胞水势降低,限制根系对水分的吸收,同时因摄入过量的钠离子(Na+)和氯离子(Cl-)使膜的完整性和功能受到干扰[6]。经过长期进化,植物可以通过形态的变化和生理机制的改变等途径,耐受一定程度的盐胁迫[7]。比如通过调控小分子有机物(脯氨酸、甜菜碱以及一些多糖分子物质)[8]和无机离子(Na+、Cl-、K+等)的浓度维持细胞内膨压,稳定酶分子活性,使盐离子在不直接伤害植物细胞的同时,还可形成相对稳定的吸水能力[9-10]。然而,在重度盐胁迫条件下,单靠植物自身调节难以维持其正常的生命活力。
目前研究表明,可以通过改良土壤和改进灌溉技术控制土壤中盐分积累,或借助系统选育、辐射诱变、分子标记辅助育种等手段选育耐盐品种[11],但利用外施化学物质对植物进行耐盐性调控的方法更加简便有效。前人研究发现外源施用钾盐可在一定程度上弥补盐胁迫下小麦(Triticum aestivum)体内K+亏缺引起的离子失衡,使小麦得以维持相对正常的生理活动[12];外源甜菜碱可通过调节紫花苜蓿(Medicago sativa)体内抗氧化酶的活性保持细胞膜的稳定性,最终达到缓解盐胁迫的目的[13];外源抗坏血酸使黄芩(Scutellaria baicalensis)体内脯氨酸和可溶性糖含量积累,从而增强黄芩的渗透调节能力,进一步缓解盐胁迫对其造成的伤害[14]。
高羊茅(Festuca arundinace)是禾本科羊茅属的多年生草本植物,因适应性强、产量高、绿期长而被作为草坪草和饲草广泛应用[15]。由于近年来土壤盐渍化的问题愈发严重,如何提高高羊茅在盐胁迫下的适应能力,对今后草坪的建植和管理具有重要的现实意义。因此,本研究以高羊茅为试验材料,探讨3种外源物质K2SO4、GB和AsA缓解高羊茅盐害的生理机制,以期为高羊茅在盐碱地的应用和管理提供理论依据。
1 材料与方法
1.1 试验材料
本试验在南京农业大学草业学院人工气候室进行,供试材料选用高羊茅(F.arundinace‘Arid 3’)。选择均匀一致的种子按3.0 g·m-2的播种量播于PVC管(深度50 cm,直径11 cm)中,基质为长江水洗沙。播种后每2 d浇灌去离子水1次,每次每盆500 mL,生长期间按照1/3原则定期修剪,修剪高度为5 cm。材料经3个月预培养,待健康状况良好、生长均匀一致后开始处理。
1.2 试验设计
在材料处理期间,生长室环境条件为25 ℃/18 ℃(昼/夜),相对湿度为70%,810 μmol·(m2·s)-1光照,处理期间不修剪。所有试验材料保持每日浇灌,每次每管浇灌250 mL去离子水或NaCl水溶液于基质中,避免溶液接触叶片。为避免盐激伤害,盐胁迫各处理的盐浓度从0开始,以每天50 mmol·L-1浓度逐渐增加,直至达到预定浓度250 mmol·L-1。试验分别在非盐胁迫(CK)及盐胁迫处理下设置3个外源喷施处理:3.27 mmol·L-1的K2SO4、100 mmol·L-1甜菜 碱(glycine bataine, GB)[16]和20 mmol·L-1抗 坏 血酸(ascorbate, AsA)[17],3种 化 学 物 质 的 浓 度 通 过 前期浓度梯度筛选试验确定。每7 d进行一次叶面喷施[17],每次每管20 mL,并保证均匀喷施至药液呈水滴状自然落下。第一次叶面喷施为正式试验前3 d的 17:00,之后每次均在取样后同一时间喷施。每个处理4个重复,分别在盐处理开始的0、7、14、21、28、35 d观测并随机选取完全展开叶用于后续测定。
1.3 测定指标和方法
1.3.1 形态指标的测定
采用目测法评定草坪质量(turf quality, TQ),以全美草坪草评价体系(The National Turfgrass Evaluation Program, NTEP)为参考标准[18]。
1.3.2 生理指标的测定
参考Barrs和Weatherley[19]的方法测定叶片相对 含水量(relative water content, RWC);采用Vapor Pressure Osmometer 5520渗透仪(Wescor, Inc., Logan,UT)测定渗透调节(osmotic ajustment, OA);电解质渗漏率(electronic leakage, EL)通过电导率仪测定并计算[20];利用巴比妥酸显色法测定叶片中丙二醛(MDA)含量[20];叶片中过氧化氢(H2O2)含量通过二氨基联苯胺水溶液(DAB, pH 5.8)染色鉴定。
1.3.3 Na+、K+含量及抗氧化物酶的测定
剪取并称量大约1.0 g完全展开叶,叶片用去离子水冲洗干净后装袋烘干。将干样磨碎并称取0.1 g,微波消解后用电感藕合等离子体发光光谱分析(ICP)测量对应离子含量。过氧化氢酶(catalase, CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase, APX)活性的测定分别参考Aebi[21]和Nakano[22]的方法。
1.4 数据处理
采用SPSS 13.0程序分析软件对试验数据进行显著性检测,平均数间采用Fisher最小显著差数法(LSD)检测差异,显著水平P< 0.05。用SigmaPlot 12.5作图。
2 结果与分析
2.1 3种外源物质对盐胁迫下高羊茅草坪质量的影响
非盐胁迫下喷施3种外源物对高羊茅的草坪质量影响差异不显著(P> 0.05) (图1、图2)。在盐胁迫下,高羊茅的草坪质量总体上随着处理时间延长而下降,叶片逐渐枯黄。盐胁迫处理35 d时,喷施去离子水、K2SO4、GB、AsA处理的草坪质量相较于0 d分别下降了69.94%、57.41%、38.42%、47.85%,叶面喷施K2SO4、GB和AsA处理的草坪质量与去离子水处理相比分别显著升高了19.72%、30.09%和24.14%(P< 0.05)。这表明喷施3种外源物质后,均可以显著抑制盐胁迫下高羊茅草坪质量的下降。

图1 盐胁迫下3种外源物对高羊茅表型的影响Figure 1 Effect of three substances on phenotype of tall fescue under salt stress
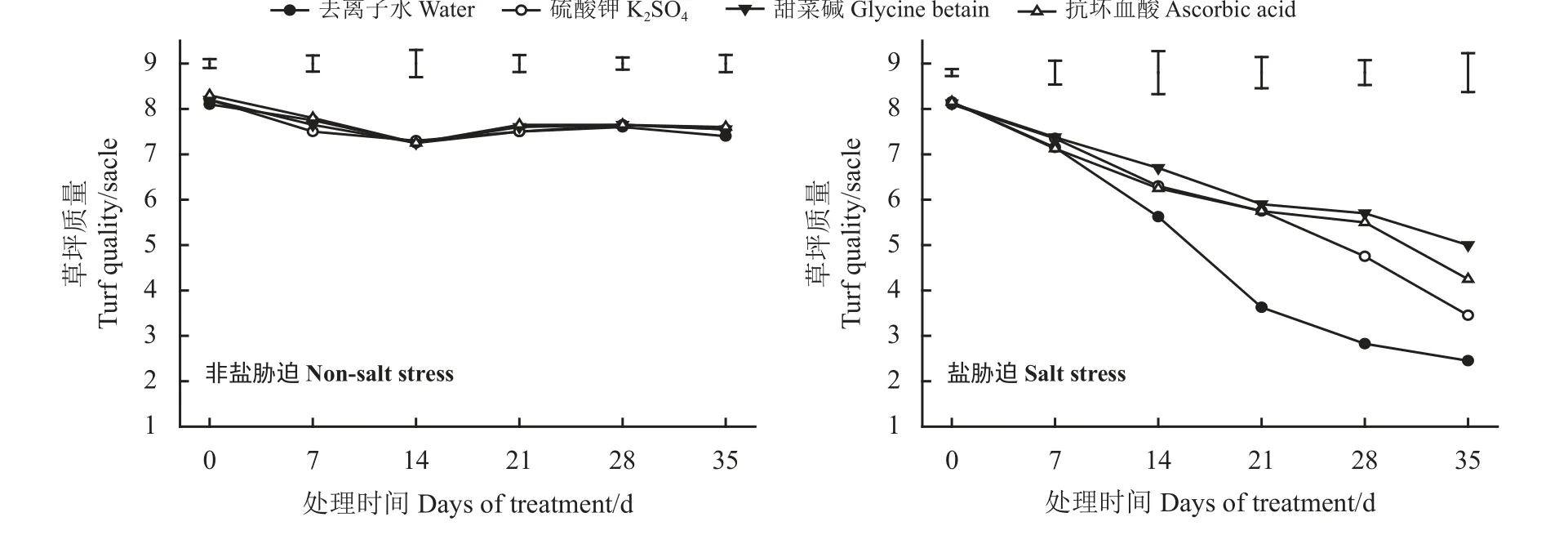
图2 非盐胁迫和盐胁迫下3种外源物对高羊茅草坪质量的影响Figure 2 Effect of three substances on the turf quality of tall fescue under non-salt stress and salt stress
2.2 3种外源物质对盐胁迫下高羊茅叶片相对含水量的影响
盐胁迫下,各处理叶片相对含水量均随着盐处理时间的增加而持续下降(图3)。0和7 d的叶片相对含水量均无明显变化,14 d时叶面喷施K2SO4和GB处理比同时期去离子水处理分别升高了4.91%和5.67% (P< 0.05)。35 d时喷施AsA、K2SO4和GB处理比同时期去离子水处理分别显著升高了6.89%、2.61%和8.77%。未受盐胁迫时,喷施K2SO4、GB、AsA对其相对含水量的影响均没有显著差异。

图3 非盐胁迫和盐胁迫下3种外源物对高羊茅相对含水量的影响Figure 3 Effect of three substances on the relative water content of tall fescue under non-salt stress and salt stress
2.3 3种外源物质对盐胁迫下高羊茅渗透调节的影响
在盐胁迫下,高羊茅叶片渗透压随时间增加呈现上升的趋势(图4)。盐胁迫7 d时,仅喷施GB的高羊茅叶片渗透压与去离子水处理呈显著差异(P<0.05);35 d时,喷施GB、K2SO4和AsA的高羊茅叶片渗透压分别比喷施去离子水处理显著高出171.74%、89.13%和93.47%。
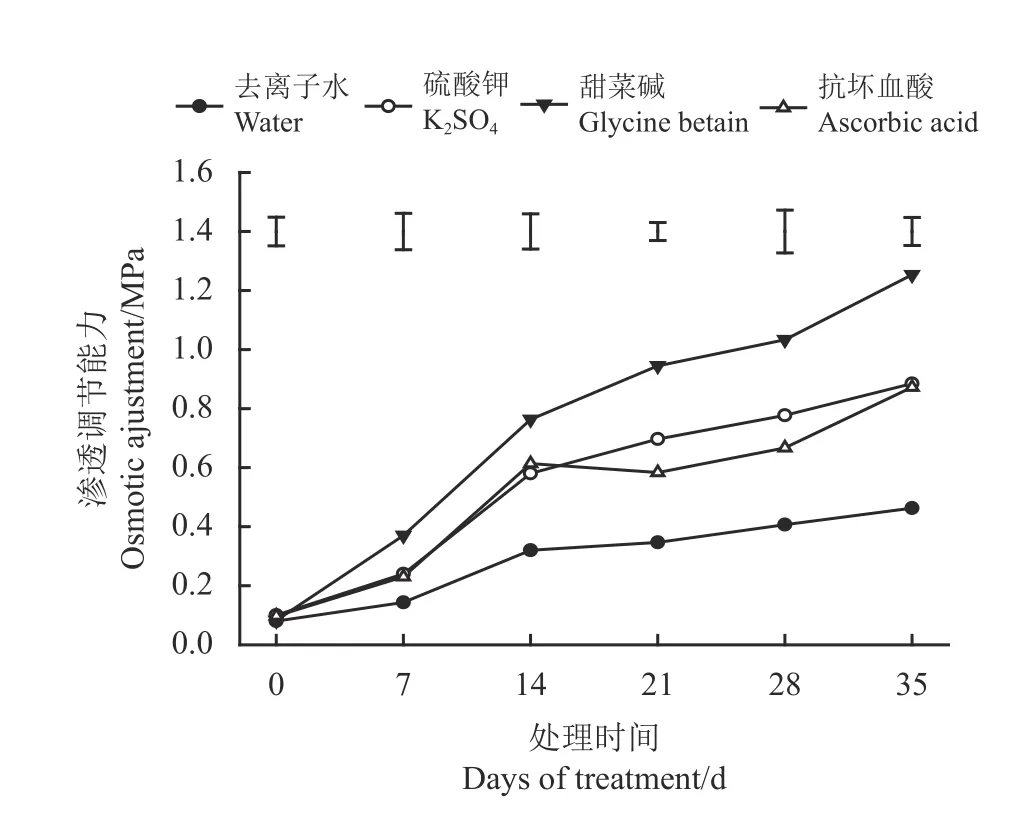
图4 盐胁迫下3种外源物对高羊茅渗透压的影响Figure 4 Effect of three substances on the osmotic adjustment of tall fescue under salt stress
2.4 3种外源物质对盐胁迫下高羊茅电解质渗漏率的影响
高羊茅在正常环境下,各处理间电解质渗漏率均无显著差异(P> 0.05) (图5)。在盐胁迫下,各处理高羊茅叶片的电解质渗漏率均随盐处理时间增加而升高,而喷施K2SO4、GB、ASA后电解质渗漏率均有一定程度的下降。盐胁迫14 d时喷施GB和AsA处理比同时期的去离子水处理的电解质渗漏率分别下降了19.89%和19.32%,35 d时则分别下降了41.84%和27.42% (P< 0.05),喷施K2SO4处理仅在盐处理28 d时显著低于去离子水。
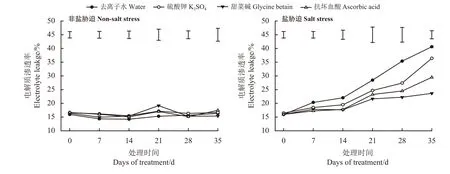
图5 非盐胁迫和盐胁迫下3种外源物对高羊茅电解质渗漏率的影响Figure 5 Effect of three substances on the electrolyte leakage of tall fescue under non-salt stress and salt stress
2.5 3种外源物质对盐胁迫下高羊茅离子含量的影响
正常环境下叶面喷施去离子水、K2SO4、GB、AsA,对其叶片Na+浓度均无显著影响(P> 0.05) (图6)。而在盐胁迫下,叶片Na+浓度随处理时间的增加而增加,喷施3种外源物质可以明显抑制Na+浓度的上升。各处理间7 d时叶面喷施K2SO4、AsA和GB处理相比同时期去离子水处理的Na+浓度分别显著降低了36.67%、55.85%和69.07% (P< 0.05),35 d时分别显著降低了34.64%、43.49%和37.15%。
在正常环境下,喷施去离子水、K2SO4、GB和AsA对高羊茅叶片K+浓度影响均无明显差异(P> 0.05)(图6)。在盐胁迫下,只有叶片喷施K2SO4处理的高羊茅叶片K+浓度呈现明显上升趋势,35 d时叶片中K+浓度比0 d上升102.55%,其余3个处理的叶片K+浓度均未随处理时间延长而变化。
高羊茅叶片在正常环境下,各处理高羊茅叶片Na+/K+均无明显变化(P> 0.05) (图6)。而在盐胁迫下,随处理时间增加逐渐上升。其中叶面喷施去离子水处理的高羊茅叶片Na+/K+上升最为明显,35 d时,叶面喷施K2SO4、GB和AsA处理的叶片Na+/K+较之去离子水处理分别显著降低了59.65%、51.54%和38.99% (P< 0.05),但3个处理间无明显差异。
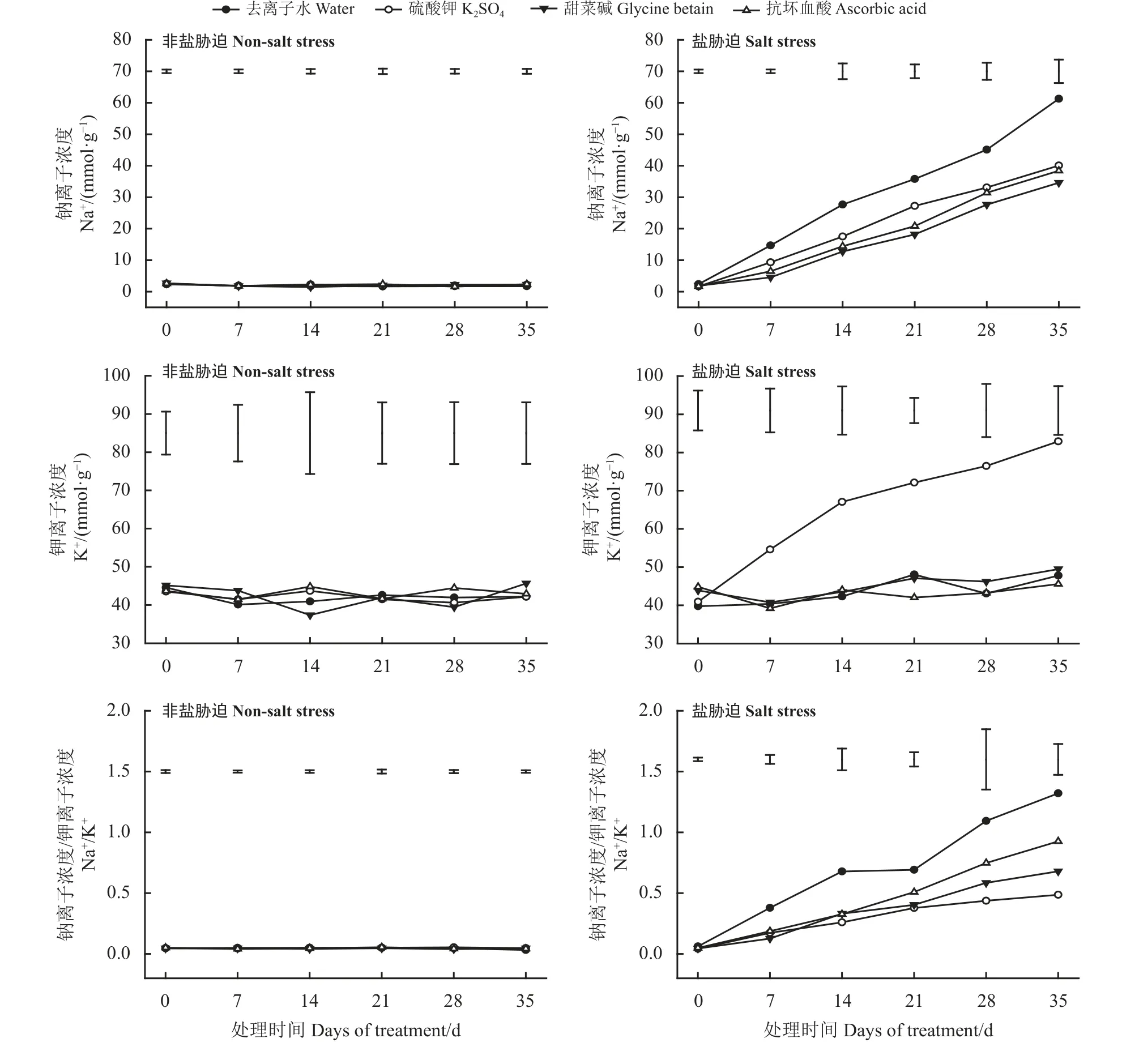
图6 非盐胁迫和盐胁迫下3种外源物对高羊茅离子含量的影响Figure 6 Effect of three substances on the ion content of tall fescue under non-salt stress and salt stress
2.6 3种外源物质对盐胁迫下高羊茅丙二醛含量的影响
在正常环境下,叶面喷施去离子水、K2SO4、GB、AsA后高羊茅叶片丙二醛含量均无明显变化(P>0.05) (图7)。在盐胁迫下,各处理高羊茅叶片的丙二醛含量均随盐处理时间的延长而逐渐增加,喷施3种外源物质可以抑制丙二醛的积累。28 d时叶面喷施K2SO4、GB和AsA处理相比同时期去离子水处理的MDA含量分别显著降低了32.54%、32.76%和36.84% (P< 0.05),35 d时叶面喷施GB和AsA处理相比去离子水处理的丙二醛含量显著降低了32.01%和28.67%,而喷施K2SO4处理丙二醛含量无显著差异。
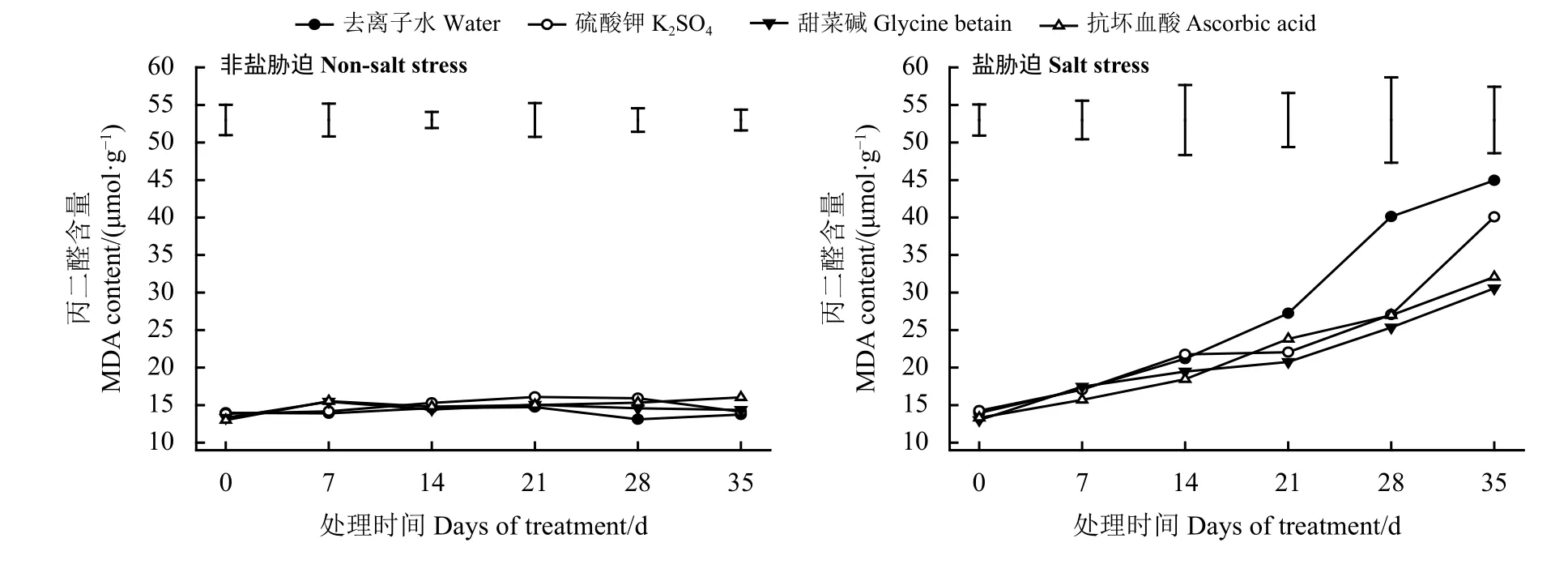
图7 非盐胁迫和盐胁迫下3种外源物对高羊茅丙二醛含量的影响Figure 7 Effect of three substances on the MDA content of tall fescue under non-salt stress and salt stress
2.7 3种外源物质对盐胁迫下高羊茅抗氧化酶活性的影响
正常条件下,高羊茅叶片经过DAB染色后,颜色没有明显变化(图8)。而在盐胁迫下,叶片喷施去离子水处理的叶片经DAB染色后,处理7 d的叶片颜色开始明显加深,这一趋势一直持续到35 d。喷施K2SO4和AsA处理7 d时叶片颜色没有明显变化,二者均在14 d时颜色加深。相比之下,喷施GB处理的叶片经DAB染色后,直到21 d才开始出现颜色加深的现象。盐胁迫处理35 d时,喷施去离子水处理叶片颜色最深,K2SO4次之,喷施GB处理的叶片颜色最浅。

图8 非盐胁迫和盐胁迫下3种外源物对高羊茅叶片DAB染色观察Figure 8 Effect of three substances on the DAB staining observed in tall fescue under non-salt stress and salt stress
正常条件下,叶面喷施去离子水、K2SO4、GB、AsA处理的高羊茅叶片CAT酶活性并无明显变化,处理间也无显著差异(P> 0.05) (图9)。在盐胁迫初期,由于受到NaCl胁迫,各处理高羊茅叶片CAT活性均明显上升,而后随盐胁迫时间的延长而逐渐下降。其中喷施K2SO4、GB、AsA处理后叶片CAT含量均在14 d时达到峰值,相较于0 d分别上升了55.45%、61.81%和51.92%,而后明显下降;喷施去离子水处理的叶片CAT含量在21 d达到峰值,相较于0 d上升了53.09%,后随之下降。盐胁迫处理35 d时,叶面喷施去离子水或K2SO4的高羊茅叶片CAT活性相较于28 d分别骤降40.93%和34.09%,而GB、AsA处理分别下降了7.92%和7.44%。

图9 非盐胁迫和盐胁迫下3种外源物对高羊茅CAT活性的影响Figure 9 Effect of three substances on the CAT activity of tall fescue under non-salt stress and salt stress
正常条件下各处理高羊茅叶片APX酶活性均在1.21~1.23 nmol·(mg·min)-1,且处理间无显著差异(P> 0.05) (图10)。在盐胁迫初期,APX活性受到NaCl诱导上升,而后随着盐胁迫时间的延长逐渐下降。其中叶面喷施去离子水、K2SO4和AsA处理均在14 d达到峰值,相较于0 d分别上升了52.81%、57.09%和62.53%,但4个处理间并无显著差异。叶面喷施GB处理在21 d达到峰值,相较于0 d上升了63.00%。自21 d开始直至处理结束,喷施去离子水处理与其他3种处理相比均表现为差异显著(P<0.05)。盐胁迫下,35 d时各处理之间APX活性较之峰值均明显下降。值得注意的是,盐胁迫下喷施去离子水和K2SO4处理的高羊茅在35 d时APX活性均低于0 d,而喷施GB、AsA处理则明显高于0 d。

图10 非盐胁迫和盐胁迫下3种外源物对高羊茅APX活性的影响Figure 10 Effect of three substances on the APX activity of tall fescue under non-salt stress and salt stress
3 讨论
3.1 3种外源物质可以改善盐胁迫下高羊茅的生长状态
在自然环境中,干旱、高温和盐害等非生物胁迫对植物生长造成不利的影响[23],而草坪质量能够直观反映草坪受盐胁迫的程度。本研究中,高羊茅在250 mmol·L-1NaCl的胁迫下生长缓慢,叶片逐渐枯黄、老化,外源喷施GB、AsA和K2SO4均可延缓盐胁迫下叶片枯黄,从而维持较好的草坪质量。其中以喷施GB效果最佳,AsA次之,K2SO4最差,说明相对于其他两个处理,喷施GB对盐胁迫下高羊茅的生长发育的促进作用更明显。
植物体内进行正常的生理生化反应均需水的参与,水分亏缺势必会影响植物的正常生长。因而,叶片相对含水量通常可以用来衡量植物在逆境中的生长情况,在盐胁迫条件下提高植物的持水能力尤为重要[24]。本研究中,随着盐胁迫时间的增加,高羊茅叶片含水量持续下降,而喷施GB、AsA和K2SO4均可有效延缓盐胁迫中相对含水量的下降,且喷施GB后叶片相对含水量下降速度慢于其他两个处理,与草坪质量表现一致,这表明GB处理在缓解植物由于水分缺失引起的生理代谢失调效果更好,此结果在弯叶画眉草(Eragrostis curvula)[25]和小麦[26]等植物中也得到了证实。
3.2 3种外源物质可以促进盐胁迫下高羊茅的渗透调节能力和离子平衡
渗透调节是植物应对逆境时重要的生理调节机制之一[27]。根据本研究结果,叶面喷施GB、K2SO4、AsA均可以显著提高盐胁迫下高羊茅的渗透势,其中喷施GB效果最佳,可能由于甜菜碱本身是一种渗透调节物质,同时可以诱导可溶性糖、脯氨酸等物质积累,从而提高渗透调节作用[26]。细胞质膜是隔开细胞与外界环境的一道屏障。盐胁迫下,由于细胞质膜透性增大而导致大量电解质外排,故电解质渗漏率通常可以反映细胞膜的完整性和植物受胁迫的程度[28]。本研究中,高羊茅的电解质渗漏率随着盐处理时间的增加而显著上升,这与江生泉等[29]对高羊茅耐盐性的研究结果相似,说明盐胁迫下高羊茅细胞质膜的完整性和稳定性受到严重破坏。喷施GB后叶片电解质渗漏率增加程度低于喷施AsA和K2SO4,说明甜菜碱对盐胁迫下植物叶片的细胞膜有较强的保护作用,在棉苗(Gossypium hirsutum)上也有类似的结果[30]。
离子毒害也是NaCl伤害植物的一种主要形式[31],盐胁迫下,Na+等离子在植物体内大量积累,K+浓度降低,破坏植物体内的水分和离子平衡,最终对植株造成伤害[32],因此在盐胁迫条件下重建离子稳态是提高植物耐受盐胁迫的策略之一。本研究在盐处理期间,叶面喷施K2SO4、GB和AsA后,叶片中Na+积累速度变缓,这和盐胁迫下杂交狼尾草(Pennisetum americanum)的试验结果一致[33]。本研究中仅喷施K2SO4处理叶片K+浓度显著上升,在蒋乔峰等[34]对沟叶结缕草(Zoysia matrella)的研究中,盐胁迫导致叶片中K+浓度明显降低。这可能由于喷施K2SO4提供大量的K+,促进植物叶片对K+的吸收。以上结果说明在一定浓度的盐胁迫中,叶面喷施GB在抑制高羊茅叶片Na+浓度的增加引起的离子毒害作用以及维持叶片中离子平衡方面效果更佳。
3.3 3种外源物质可以提高盐胁迫下高羊茅的抗氧化能力
H2O2是叶绿体中光电子传递与酶反应的产物,与自由基结合形成的·OH可以直接引发脂质过氧化,进而破坏植物细胞的结构和功能。同时,H2O2在植物体中累积导致AsA含量降低,严重影响植物体内正常代谢[35-36],因此H2O2的含量可以直接反映植物体受胁迫的程度。研究结果表明叶面喷施3种物质均可以显著抑制盐处理下叶片中H2O2的积累,证明喷施K2SO4、GB和AsA可以缓解盐胁迫对高羊茅叶片造成的氧化损伤。另外,喷施GB叶片颜色浅于喷施K2SO4和AsA的叶片,由此可知,高羊茅在盐胁迫条件下,叶面喷施GB缓解盐胁迫的效果优于K2SO4和AsA。
植物受到胁迫时,体内活性氧的过量积累会造成细胞结构和功能的紊乱甚至导致其死亡,其自身形成的保护酶体系可以使植物体内活性氧的产生和清除处于动态平衡[37]。因此,逆境下植物体内的抗氧化酶活性被视为评价植物抗逆性的重要指标之一[38]。CAT可以催化H2O2分解,APX可以利用抗坏血酸作为电子供体清除H2O2[39-40],因此,CAT和APX活性的增强可以显著提高植物体的抗逆性[41]。本研究中,CAT和APX活性均随着盐胁迫时间的增加表现出先增强后下降的趋势。这是由于在盐胁迫初期,植物体内产生了较多的H2O2,诱导高羊茅CAT和APX活性增强,但随着盐胁迫时间的增加,当盐胁迫超过了植物所能忍受的“阈值”后,这两种酶活均显著降低。叶面喷施GB和AsA均显著提升了CAT和APX酶活性,这个结果在紫花苜蓿(Medicago sativa)、油菜(Brassica napus)种子中得到了证实[13,42],说明GB和AsA可以增强盐胁迫下高羊茅的抗氧化酶活性,进而提升高羊茅的耐盐性,且喷施GB效果更佳。然而叶面喷施K2SO4的研究结果与郑延海等[12]对小麦的研究结果不符,究其原因可能是K2SO4对盐胁迫的缓解并非通过抗氧化途径实现,而是通过提高K+浓度达到离子平衡实现的。
4 结论
综合高羊茅在试验过程中的生理生态指标发现,外源喷施GB可以提升高羊茅在盐胁迫下的草坪质量、叶片相对含水量,降低电解质渗漏率,并通过提高渗透调节能力和抗氧化酶活性在一定程度上缓解盐胁迫的伤害,效果优于喷施K2SO4和AsA。
