肥厚型梗阻性心肌病中二尖瓣前叶收缩期前向运动的机制与处理策略△
2022-04-26郭惠明
谭 桐,郭惠明
[1.广东省心血管病研究所心脏外科广东省人民医院(广东省医学科学院),广州 510100;2.汕头大学医学院,广东汕头 515063]
提 要:二尖瓣前叶收缩期前向运动(systolic anterior motion,SAM)常出现于肥厚型心肌病中,但其机制十分复杂。室间隔肥厚、瓣叶冗长、异常乳头肌、腱索松弛、二尖瓣对合点至室间隔距离短以及高流速均被认为是肥厚型梗阻性心肌病中SAM 的独立影响因素。目前国内外不同肥厚型心肌病治疗中心对SAM 的处理策略各有千秋,包括对肥厚心肌、二尖瓣瓣下结构与瓣叶的处理。基于对SAM 机制的研究,本文综合肥厚型梗阻性心肌病处理策略的相关文献,阐释不同手术方式消除SAM 的原理。
肥厚型心肌病是一种以左心室壁不对称性肥厚为解剖特征的遗传性心脏病,通过2D 超声心动图或心血管磁共振在最大舒张末期发现任意一个左心室室壁节段厚度≥15 mm,且肥厚不能由其他原因所解释即可临床诊断[1-2]。它影响着0.2%以上的成年人群,是临床上导致青少年和运动员心源性猝死的最常见疾病之一[3]。若存在左心室流出道梗阻(left ventricular outflow tract obstruction,LVOTO),即称为肥厚型梗阻性心肌病(hypertrophic obstruc⁃tive cardiomyopathy,HOCM)。其中,二尖瓣前叶收缩期前向运动(systolic anterior motion,SAM)是HOCM 产生LVOTO 和导致患者出现不同程度的二尖瓣反流(mitral regurgitation,MR)及胸痛、呼吸困难、晕厥等临床症状的原因之一。本文就HOCM 中SAM 的机制研究和处理策略进行综述,阐述两者的关系,为个体化治疗策略的制定提供参考。
1 二尖瓣前叶收缩期前向运动在肥厚型梗阻性心肌病中的发生机制
人们一开始使用文丘里效应(Venturi effect)解释SAM,即左心室流出道中高流速血流产生的负压使二尖瓣前叶向左心室流出道移位[4]。但是该理论并不能解释所有SAM 现象,如室间隔心肌切除术后流速降低仍残余SAM[5]。Sherrid 等[6]的超声心电图研究指出,在SAM 发生起始阶段,流出道血流流速低,此时血流推力(即拖曳力,drag force)才是产生SAM 的主要动力。
二尖瓣呈D 形瓣环结构,包括前、后两瓣叶,瓣下结构由腱索、乳头肌组成。正常情况下,二尖瓣前叶受到乳头肌的牵拉和血流流束冲击,使得瓣叶保持靠后的位置;而在HOCM 中,血流必须绕过腔内隆起的肥厚室间隔,形成曲线流束,撞击二尖瓣前叶向流出道方向运动。另外,瓣叶冗长和乳头肌前移导致二尖瓣松弛,促进SAM 形成(图1)[7]。SAM导致二尖瓣前叶与室间隔接触,加重LVOTO,而LVOTO产生的高流速又可诱发SAM。总而言之,SAM 的诱因可归纳为三大类:结构异常,几何因素,动力因素,且三者相互影响[8]。结合HOCM 的病理学特征,加重SAM 的结构异常主要包括室间隔肥厚,瓣叶冗长,异常乳头肌(肥大、前移、跨越瓣叶、副乳头肌),腱索松弛;几何因素为二尖瓣对合点至室间隔距离短;动力因素为高流速[8-11]。
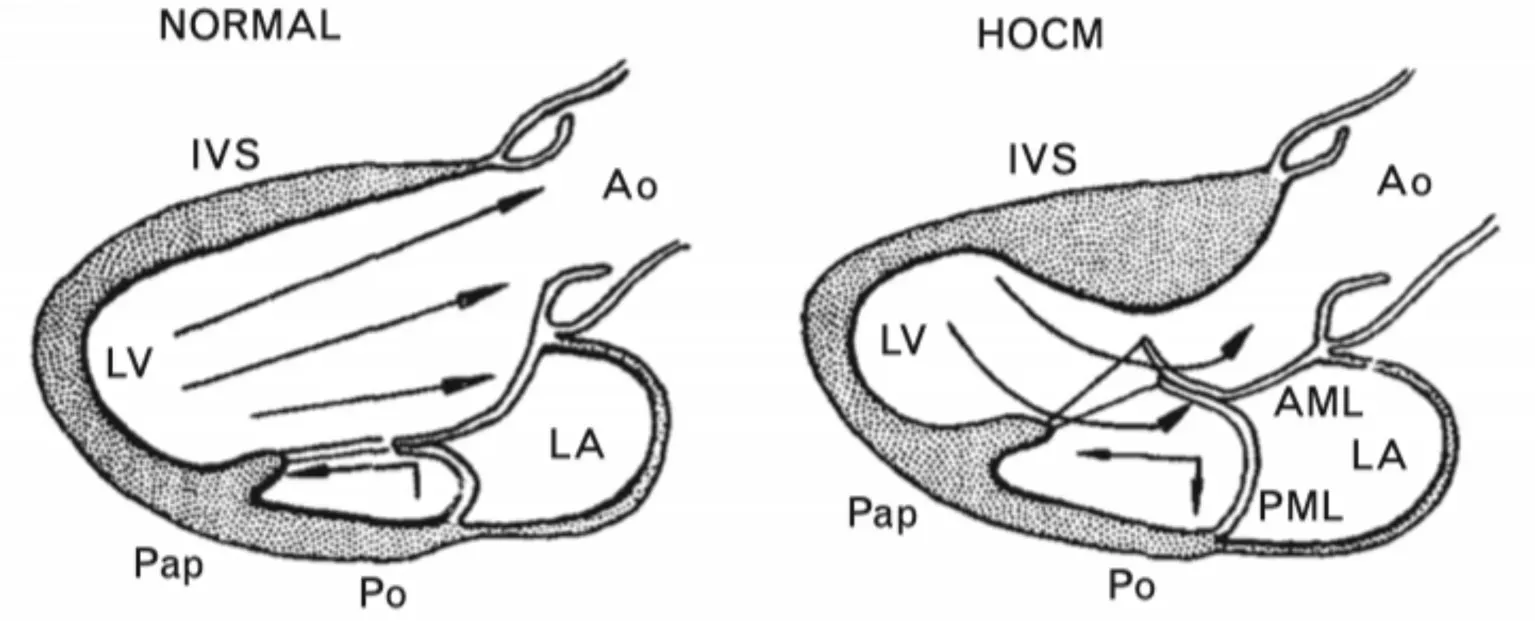
图1 正常个体与HOCM 患者心腔内血流和室间隔、二尖瓣相互关系的对比图[7]
2 二尖瓣前叶收缩期前向运动在肥厚型梗阻性心肌病中的处理策略
2020 年美国心脏协会的指南建议采用逐步法治疗HOCM(1 级推荐)——对于有症状的患者,首先进行药物治疗;根据药物耐药程度选择β 受体阻断药、非二氢吡啶类钙通道阻滞剂或丙吡胺;对于药物耐受和严重症状持续的患者,应考虑酒精消融或手术治疗[1]。消除或减轻SAM 是外科治疗HOCM 目的之一,经典的术式采用改良扩大Morrow 术,而随着对SAM 机制的深入认识以及超声影像技术的进步,外科技术也有了重大发展,如越来越多的外科医生进行心肌切除的同时对瓣下结构与瓣叶进行干预[12]。由此,针对SAM 的诱因将外科策略分为对肥厚心肌、瓣下和瓣叶结构的处理(图2)。
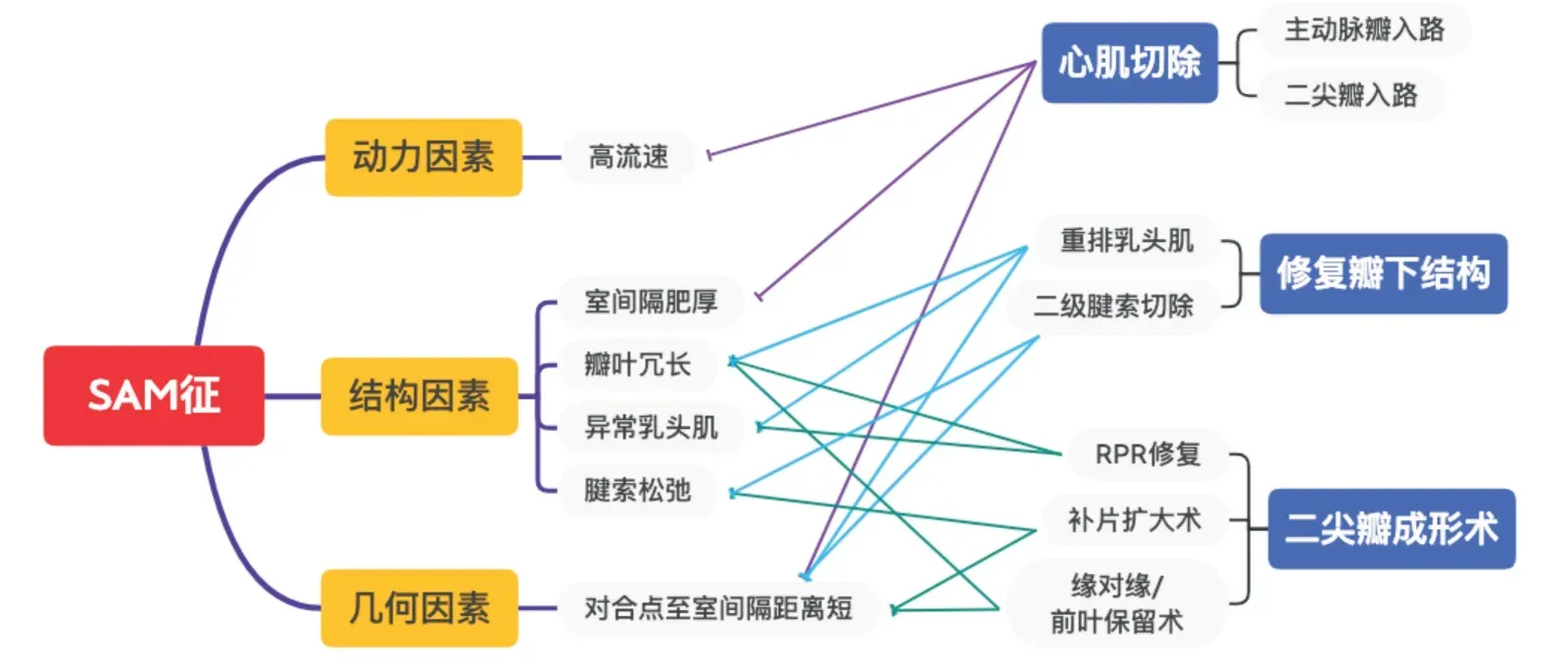
图2 外科治疗消除SAM 的原理图
2.1 肥厚心肌切除
在HOCM 患者中,室间隔肥厚是引起SAM 和LVOTO最常见的结构因素,因此,切除肥厚心肌是消除SAM 的基础。梅奥诊所主张对非器质性二尖瓣异常的HOCM 患者,无论反流程度轻重,均首选室间隔扩大切除术;理由是只要确保足够的心肌切除便可消除大部分患者的SAM 和MR,不需要冒着增加并发症的风险干预二尖瓣[13-14]。
常规的室间隔切除术通常经主动脉瓣入路进行,该手术入路存在一定的局限性:如瓣环口径小难以显露室间隔全貌,向室间隔中部或更深位置的扩大切除受限,无法到达二尖瓣。Lillehei[15]在1963 年首次提出开胸经二尖瓣入路进行室间隔切除术。然而,传统正中开胸心肌切除术仍然存在着学习曲线长、手术创伤大、切口不美观、不易教学等缺点。随着微创与胸腔镜技术的发展,经二尖瓣入路心肌切除术已可以在胸腔镜或机器人辅助下完成[16-17]。在胸腔镜的二尖瓣入路直视下,广阔的角度和视野将主动脉瓣下方至室间隔中部、前后乳头肌完全暴露,因此,心肌扩大切除范围可达心尖部,复位瓣下结构和处理复杂梗阻部位的操作也更直接和安全[18-20]。另外,3D重建和打印技术已成为微创手术的辅助技术,术者在术前即可确定肥大心肌的切除范围,术中结合胸腔镜放大视图功能与视野优势,实现精准切除[21]。二尖瓣入路的另一个优势是治疗合并心房颤动、卵圆孔未闭,或需继续干预二尖瓣的HOCM 患者时,后续操作在同一入路和切口中即可完成,避免了主动脉切开和主动脉瓣的创伤。国内、外使用胸腔镜经二尖瓣入路治疗HOCM 的中心早期结果发现,该术式可安全有效解除LVOTO 及SAM,血流动力学满意[22-23]。因此,对部分高危高龄患者不能耐受传统手术时,微创腔镜术式是一种可以考虑和选择的方案。
经心尖入路切除肥厚心肌适用于心室中部梗阻(mid⁃ventricular obstruction,MVO)、梗阻长度大于60 mm、合并心尖室壁瘤的肥厚型心肌病患者[24-25],但并非处理SAM的常用术式。MVO 是肥厚型心肌病特殊的表型之一,由肥厚的室间隔中部与前乳头肌构成;而SAM 主要构成主动脉瓣下梗阻,与中部梗阻相互独立存在。对于MVO 合并SAM 的患者,可采取经心尖联合经主动脉瓣双入路疏通左心室流出道,避免残余梗阻和临床症状复发。
2.2 联合二尖瓣瓣下结构的处理
二尖瓣瓣下解剖结构异常也可引起HOCM 患者二尖瓣关闭不全,忽略这些结构异常对LVOTO 和SAM 的病理生理影响会导致不完全的外科治疗。克利夫兰诊所选择422 例室间隔轻微增厚[(18±3.8)mm]的HOCM 患者同期进行了二尖瓣或瓣下结构的干预,包括缩短二尖瓣叶,拴扎、切除异常腱索,乳头肌切除,使用补片将肥大或前移的乳头肌头部与后乳头肌头部捆绑重排至同一平面。重排乳头肌限制了前乳头肌的活动,改善瓣叶松弛,对合点远离流出道。另外,该研究发现,室间隔肥厚程度越低,对二尖瓣的干预越有利于纠正SAM,甚至可以不进行心肌切除仅单独处理二尖瓣[26]。这些患者的特征及手术结果说明瓣叶和瓣下结构异常是独立于室间隔肥厚诱发SAM 的因素,为肥厚心肌切除术同期干预二尖瓣提供了理论支持。
Ferrazzi 等[27]则提倡将类似患者的乳头肌与二尖瓣前叶间的二级腱索和增生纤维组织一并切除。正常个体的二级腱索有助于心脏射血期内保持心室的形态与功能,但HOCM 患者的腱索已纤维化增厚,异常束缚着二尖瓣前叶,部分一级腱索及前叶反而松弛,在拖曳力作用下触发SAM。因此,即使心肌切除的体积不及改良扩大Morrow术,瓣下结构的干预使二尖瓣前后叶对合点远离流出道,二尖瓣幕状区面积减少,同样疏通左心室流出道。
2.3 联合二尖瓣瓣叶的处理
目前是否同期干预二尖瓣仍没有定论,以梅奥诊所为代表的单纯切除心肌观点和以克利夫兰为代表的可积极干预二尖瓣观点两者虽看似矛盾,但本质上都是为了消除SAM 的危险因素,且两诊所均支持对合并腱索断裂、瓣叶脱垂等固有病变的患者同期行二尖瓣干预[13,28]。管理SAM 的二尖瓣成形术众多。Sandhya 等[29-30]认为,在室间隔增厚及左心室射血彩流束的影响下,二尖瓣瓣叶松弛、冗长(>30 mm 或>17 mm/m2)是导致SAM 出现的常见原因,建议使用切除-折叠-松解修复术(resection-plicationrelease repair,RPR)对二尖瓣进行成形。该技术消除SAM的原理除了基本的心肌切除,还将增大、冗长的二尖瓣前叶在水平方向上折叠2~5 mm,瓣叶因此缩短、硬化;同时将与流出道前壁异常连接的前乳头肌切除,二尖瓣对合点随即向后位移。
二尖瓣前叶扩大术是另一种处理SAM 和MR 的成形术,但其适应症并未明确,目前认为二尖瓣前叶面积是决策的关键因素,主要适合两类患者:一些高龄和有酒精消融史的HOCM 患者,伴随二尖瓣长期地碰撞室间隔,导致前叶纤维化和面积缩小[31];以及二尖瓣前叶面积>12 cm2的患者[32]。该技术将一片自体心包补片缝合至二尖瓣前叶中央切口中。对于前叶面积缩小的患者,补片扩大纠正了面积不足和前后叶长度比例低的问题;而对于前叶面积较大的患者,补片扩大沿水平方向增大二尖瓣面积,二级腱索因此随之外移伸展。同时,补片将二尖瓣上的曲折点硬化,增强瓣叶的对合,加之流出道空间已扩大,足以抵消SAM。Dulguerov 等[33]甚至采用主动脉瓣-二尖瓣双入路进行心肌切除,然后缝合一片尽可能大的补片将二尖瓣前叶与瓣环连接,距离瓣环5 mm 沿瓣膜方向将后叶切除,剩余的后叶则与瓣环缝合,使得前后瓣叶对合点后移,远离室间隔。这些技术揭示了二尖瓣结构对HOCM 病理特征的影响力,说明“尽可能地成形”或许和“尽可能地切除”一样有效。
一些二尖瓣成形术通过直接限制前叶的运动达到简单快速抵消SAM 的效果,如缘对缘成形术、二尖瓣前叶保留术[34-35]。两种术式都利用前后瓣叶固定的对合点,限制冗长瓣叶向左心室流出道运动的距离,二尖瓣因此得到“功能性”修复[36]。该技术最大程度地保留了二尖瓣的正常解剖结构,避免了二尖瓣置换术,适合二尖瓣脱垂和中度以下的室间隔梗阻HOCM 患者。
最后,二尖瓣置换在SAM 的管理仅发挥很小的作用。尽管早在1970 年Cooley 等[37]提出单纯使用二尖瓣置换同时解决LVOTO 及MR,技术简单且有效消除症状,对于经验有限的中心可能是首选策略。但从长远来看,单纯二尖瓣置换增加了与器械、心脏相关并发症发生率与总体病死率,不适合作为一线治疗方案[38]。相比二尖瓣成形术,二尖瓣置换更容易发生术后血栓、出血事件,远期生存率较低[31,39]。因此,二尖瓣置换仅作为针对特殊人群的辅助手段,如伴感染性心内膜炎、重度风湿性心脏病、复杂先天性二尖瓣异常、二尖瓣成形术难以进行或失败的HOCM 患者[38]。
3 总结
对于药物耐受的HOCM 患者,外科手术仍是治疗的“金标准”,旨在修复异常解剖结构,解除SAM 的危险因素。绝大部份HOCM 患者同时合并SAM 和MR,对此外科治疗是否同期处理二尖瓣、如何处理仍存在争议。尽管各中心采取了不同的二尖瓣处理策略,却一致地获得消除LVOTO、SAM 和MR 的良好结果(表1)。这说明了在HOCM 中,LVOTO、SAM 与MR 构成复杂的病理生理机制,互相影响。综合本文,手术策略的制定应取决于个体中诱发SAM 的危险因素,以及LVOTO-SAM-MR 三者的关系。例如,在HOCM 没有合并明显的二尖瓣病变情况下,室间隔肥厚是引起LVOTO 与SAM 的始动因素,MR 的严重程度与左心室流出道压差直接相关,应避免额外的二尖瓣干预。反之,二尖瓣存在器质性病变时,其导致的MR 与SAM 是独立相关的;或当室间隔的厚度相对有限,却伴有不成比例的重度MR 时,又或者流出道的梗阻解除后仍有残余SAM 时,选择处理二尖瓣作为“尽可能切除”的辅助措施,才能达到手术治疗的预期效果。同期进行二尖瓣成形术优于置换术。
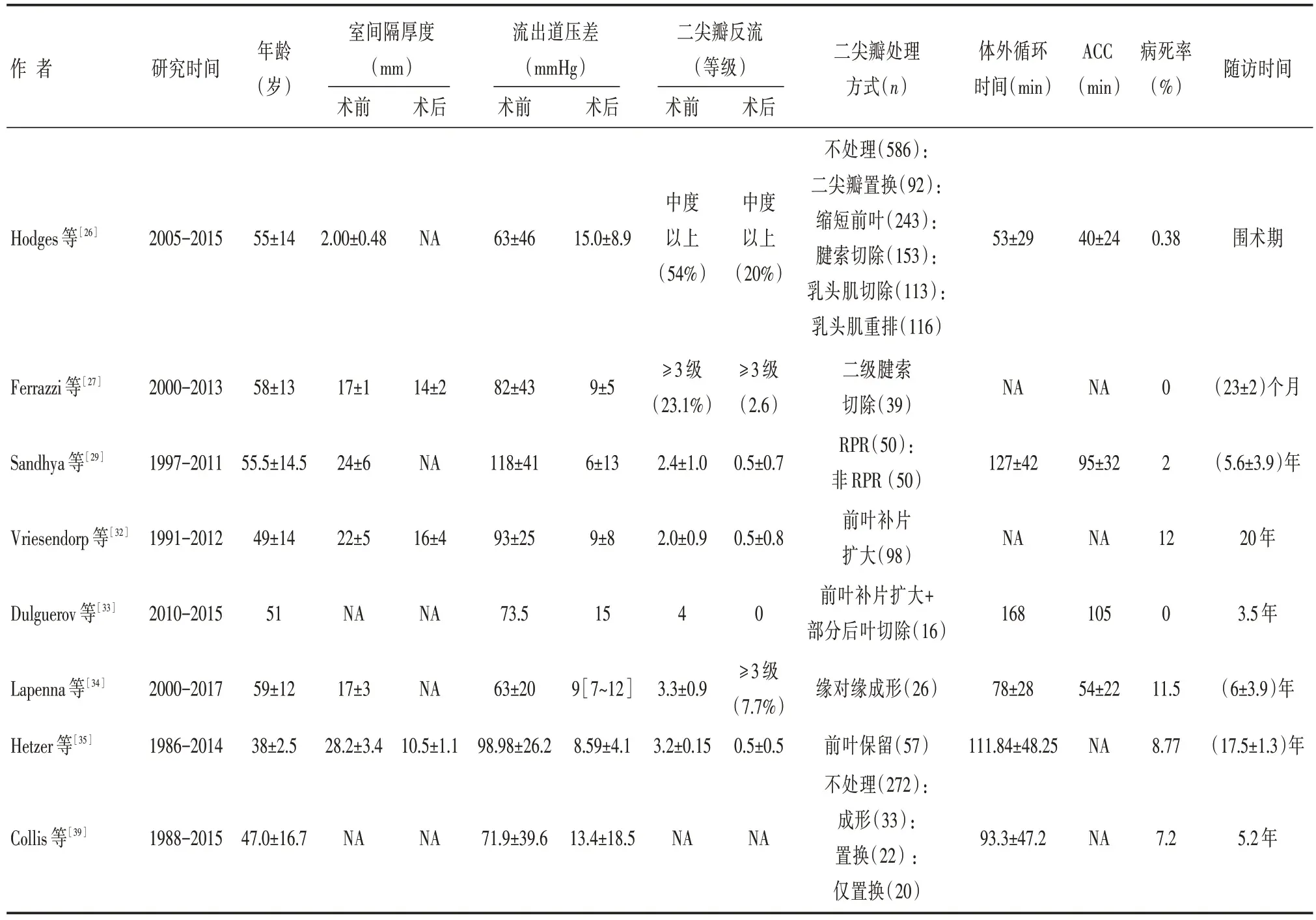
表1 HOCM 中二尖瓣处理策略摘要表
SAM 的发生机制涉及多方面因素,未来需要更多的研究明确各因素在HOCM 病理生理机制中所发挥的作用。理解各术式如何消除SAM 是制定具体干预策略的前提,其次必须依靠术前经胸、经食道心脏超声等详细的影像学检查和术中直视下观察来明确SAM 与MR 的原因。本文所述手术方法皆被证明安全有效,但仍遗留许多临床问题,如补片在长期的血流冲刷下是否会退化与撕裂、如何减少并发症等,需要更多大样本、长期的研究进一步明确。
利益冲突:无。