晚期糖基化终产物受体阻断剂FPS-ZM1减缓ApoE-/-小鼠动脉粥样硬化进展的作用△
2022-04-26吴岳恒林吉进
谢 妃,吴岳恒,林吉进,1
[1.华南理工大学医学院,广州 510006;2.广东省心血管病研究所心内科广东省人民医院(广东省医学科学院),广州 510080]
动脉粥样硬化(atherosclerosis,AS)是一种以血管壁纤维增生、慢性炎症、脂质积聚和免疫功能紊乱为特征的病理疾病[1]。随着粥样斑块的不断进展,不稳定斑块容易破裂,导致急性心血管事件,而斑块发生破裂则与局部的炎症反应、血栓形成以及蛋白降解有密切关系[2]。虽然低密度脂蛋白(low-density lipoprotein,LDL)仍然是AS 最重要的危险因素,但近年来,AS 的免疫和炎症机制引起了人们极大的兴趣,目前针对炎症反应这一靶点来干预AS 发展的方法尚不成熟[1,3-4]。晚期糖基化终末产物受体(receptor for advanced glycation end products,RAGE)是一类属于免疫球蛋白家族的多配体受体,能与晚期糖基化终末产物(ad⁃vanced glycation end products,AGEs)、S100/钙粒蛋白家族、高迁移率族蛋白1(high mobility group box,HMGB1)等配体结合发挥促炎作用[5],并在AS 中起重要作用,在AS 患者中血浆AGEs、S100/钙粒蛋白家族、HMGB1、RAGE 浓度均升高[6-8],同时伴随各炎症因子升高,其与炎症反应关系密切,深入探究RAGE 在AS 中的炎症机制可为AS 治疗提供新思路。
1 材料和方法
1.1 主要药品与试剂
FPS-ZM1 粉末(selleck,s8185),用DMSO 配备10 mg/mL 的FPS-ZM1 储备液,临用前用磷酸盐缓冲液(phosphate buffer solution,PBS)配置成工作液腹腔注射给药;高脂饲料及纯化对照饲料(江苏协同医药生物工程有限责任公司,XT108C);饱和油红O染液(上海索莱宝生物科技有限公司,G1015);苏木素-伊红(hematoxylin-eosin,HE)染色试剂盒(上海爱必信生物科技有限公司,abs9217);RAGE抗体(Abcam,ab37647);小鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(CUSABIO,CSB-E04741m);小鼠纤溶酶原激活物抑制物-1(plasminogen activator inhibitor-1,PAI-1)ELISA 试剂盒(CSB-E07947m)。
1.2 主要仪器
XTL250 型体式显微镜,全自动血生化分析仪(日本日立);病理切片机(赛默飞世尔科技);正置显微镜(奥林巴斯有限公司);成像系统(日本滨松);全波长酶标仪Multiskan GO(Thermo Scien⁃tific)。
1.3 动物分组及给药
6 周龄雄性无特定病原体(specific pathogen free,SPF)级ApoE-/-小鼠购自广东药康生物科技有限公司,体质量20~25 g,在华南理工大学实验动物中心SPF 级动物房中饲养,检疫1 周,适应性喂养1 周后,ApoE-/-小鼠随机分成对照组(CTRL组,纯化对照饲料喂养),AS 模型组(AS 组,高脂饲料喂养),FPS-ZM1 干预组(FZM1 组,高脂喂养加FPS-ZM1 腹腔注射),每组8 只。ApoE-/-小鼠高脂喂养8 周后,开始腹腔注射给药,连续4 周,FPS-ZM1 干预组给予1 mg·kg-1·d-1的FPS-ZM1[9],其余组给予PBS 作为对照。每周根据小鼠体质量变化调整给药。
1.4 小鼠血脂浓度测定
摘除小鼠眼球取血,收集于乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)采血管,分离血浆,分装后-80 ℃保存直至使用。采用全自动生化仪测定血浆三酰甘油(triacylglycerol,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein-cho⁃lesterol,HDL-C)浓度。
1.5 小鼠主动脉取材
眼球取血后采用颈椎脱臼法将ApoE-/-小鼠处死,开胸开腹后剪除右心耳,用预冷的PBS 从左心室开始灌流,直至肝脏发白,分离心脏,以主动脉根部为起点,沿脊柱旁仔细快速分离主动脉至髂总动脉分叉处为止,后转移至体式显微镜下,于装有预冷的PBS 的皿中操作,仔细剥离主动脉周围组织,自主动脉根部上1 cm 处左右垂直分离主动脉,近端主动脉根部置于4%多聚甲醛溶液固定,用于包埋切片。远端主动脉置于液氮速冻后保存于-80 ℃用于蛋白质免疫印迹实验。
1.6 小鼠主动脉切片油红O、苏木素伊红染色
将4%多聚甲醛固定的小鼠主动脉根部置于蔗糖溶液脱水后,使用OCT 包埋,切片厚6 μm,每隔10 张收取3 张,每只小鼠取15 张,5 张用于油红O 染色,5 张用于HE 染色,5 张用于免疫组化检测RAGE表达[10]。用于油红O染色的切片于60%异丙醇中漂洗20 s,取油红O 贮备液6 mL,加蒸馏水4 mL,混合后静置10 min,过滤后用于染色。油红O 染色时间为5 min;60%异丙醇稍洗去多余染液,蒸馏水洗;Mayer 苏木素浅染核1 min,1%盐酸酒精稍分化,水漂洗10 min,用滤纸将切片周围水分抹干,封片。HE染色按HE试剂盒说明书操作。采用Image pro plus 6.0软件测量主动脉斑块面积比(%)。
1.7 切片免疫组织化学染色
测定小鼠主动脉组织RAGE 表达:各组主动脉组织常规包埋、固定、切片,将切片脱蜡复水后,采用热修复法进行抗原修复,采用试剂盒进行免疫组化染色,在光学正置显微镜非重叠视野下分别观察组织着色情况。采用Image pro plus 6.0 软件对主动脉组织RAGE 表达情况进行半定量。
1.8 Western blot 检测
将小鼠主动脉组织剪碎,加入组织裂解液抽提蛋白,用二辛可酸(bicinchoninic acid,BCA)蛋白定量试剂盒(碧云天)测定总蛋白浓度,加入一定比例的蛋白上样缓冲液,95℃金属浴10 min,取20 μg 蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转移至聚偏二氟乙烯膜(PVDF)上,5%脱脂牛奶封闭1 h,进行一抗(RAGE,1∶1 000)孵育,4℃过夜,洗膜3 次,每次5 min,进行HRP 标记的二抗(1∶1 000)孵育,4 ℃1 h,洗膜,最后化学发光试剂(ECL)显色进行扫描拍照,采用Imge J 计算灰度值来表示RAGE 的相对表达量。
1.9 酶联免疫吸附试验测定
将保存于-80 ℃的血浆逐级解冻,按照ELISA试剂盒说明测定血浆样本中TNF-α以及PAI-1的浓度。
1.10 统计学分析
采用GraphPad Prism 8.0.2 统计软件处理数据。计量资料以()表示,单因素多样本组间均数比较采用one-way ANOVA 分析,多因素多组间均数比较采用two-way ANOVA 分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 3 组小鼠血脂浓度比较
与对照组(CTRL)比较,AS模型组ApoE-/-小鼠血浆TC、LDL-C浓度均显著增高(P<0.05),但TG 浓度下降(P<0.05),HDL-C 浓度无明显变化;FPSZM1 干预组(FZM1)血脂各指标与对照组及AS 模型组比较,差异无统计学意义(P>0.05),见图1。
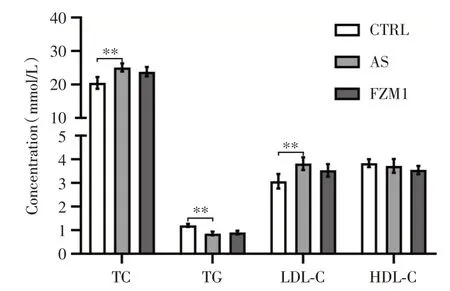
图1 3 组小鼠血浆TG、TC、LDL-C 和HDL-C 浓度比较柱状图(n=8)
2.2 3 组小鼠主动脉根部切片油红O 染色、苏木素伊红染色比较
油红O 染色镜下观察正常对照组(CTRL)小鼠主动脉内膜下油红O 染色红色着色区少,AS 模型组小鼠主动脉内膜下红色着色区显著增加(P<0.01),FPS-ZM1 干预组(FZM1)小鼠主动脉内膜下着色区域较AS 模型组减少(P<0.01),见图2A和2C。HE 染色镜下观察正常对照组小鼠主动脉内膜光滑完整,AS 模型组小鼠主动脉局部内膜明显增厚,斑块突向管腔,内膜下有大量泡沫细胞聚集和脂质沉积,中层弹力纤维破坏、排列紊乱,并有炎症细胞浸润,且斑块面积比例较AS 模型组显著增加(P<0.01),而FPS-ZM1 干预组小鼠主动脉只有少量泡沫细胞,斑块面积较AS 模型组明显减低(P<0.01),见图2B 和2D。
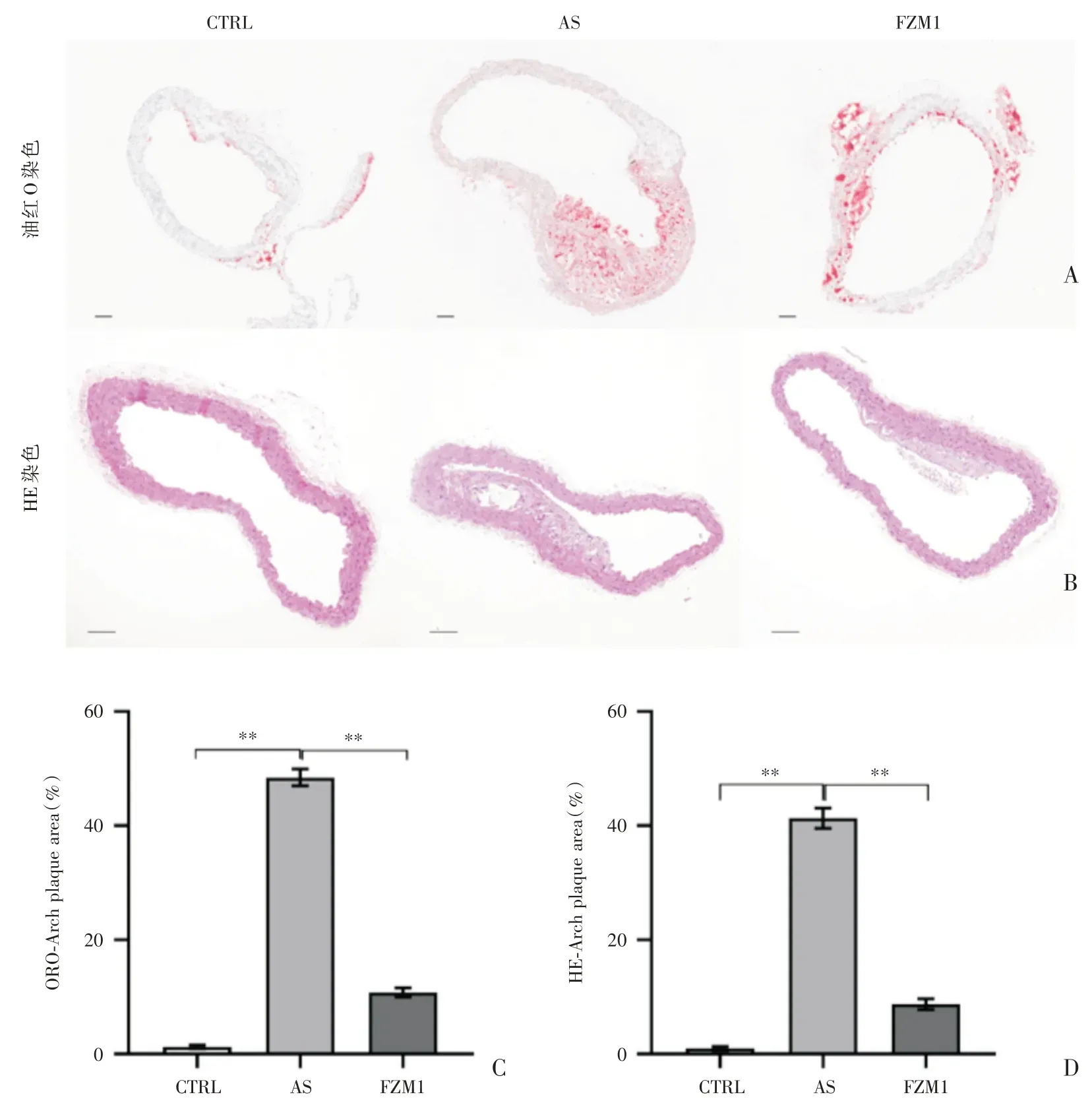
图2 3 组小鼠主动脉根部切片油红O 染色、HE 染色结果比较(比例尺=100 μm;n=8;A 图为3 组小鼠主动脉根部切片油红O 染色镜下图像比较;B 图为3 组小鼠主动脉根部切片HE 染色镜下图像比较;C 图和D 图分别为3 组小鼠主动脉根部切片油红O 染色、HE 染色结果比较柱状图)
2.3 3组小鼠主动脉Western blot、主动脉切片RAGE免疫组化染色比较
与对照组(CTRL)比较,AS 模型组ApoE-/-小鼠主动脉Western blot 结果显示RAGE 表达显著增高(P<0.01),FPS-ZM1 干预组(FZM1)小鼠RAGE蛋白表达量较AS 模型组降低(P<0.05),见图3A和3C。主动脉切片免疫组化染色结果与蛋白免疫印迹实验一致,AS 模型组小鼠主动脉较对照组平均光密度值(AOD)显著增加(P<0.01),而FPSZM1 干预组(FZM1)小鼠主动脉免疫组化染色较AS 模型组有所减低(P<0.05),见图3B 和3D。
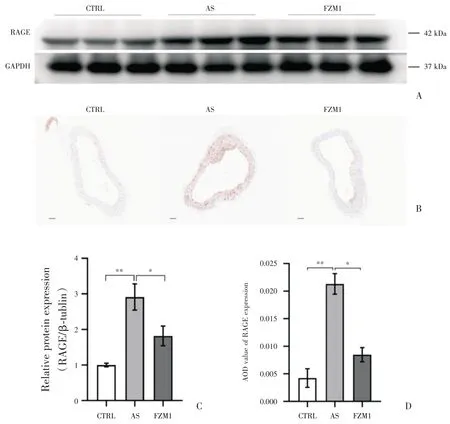
图3 3 组小鼠主动脉Western blot、主动脉切片RAGE 免疫组化染色比较(比例尺=100 μm;n=8;A 图为3 组小鼠主动脉RAGE 的Western blot 结果比较;B 图为3 组小鼠3 组小鼠主动脉切片RAGE 免疫组化染色镜下图像比较;C 图为3 组小鼠主动脉Western blot、主动脉切片RAGE 免疫组化染色比较柱状图)
2.4 3组小鼠血浆酶联免疫吸附试验测定结果比较
与对照组(CTRL)比较,AS 模型组的ApoE-/-小鼠血浆中TNF-α、PAI-1 浓度均显著升高(P<0.01);与AS 模型组比较,FPS-ZM1 干预后(FZM1)ApoE-/-小鼠血浆TNF-α、PAI-1 浓度下降(P<0.05),见图4。
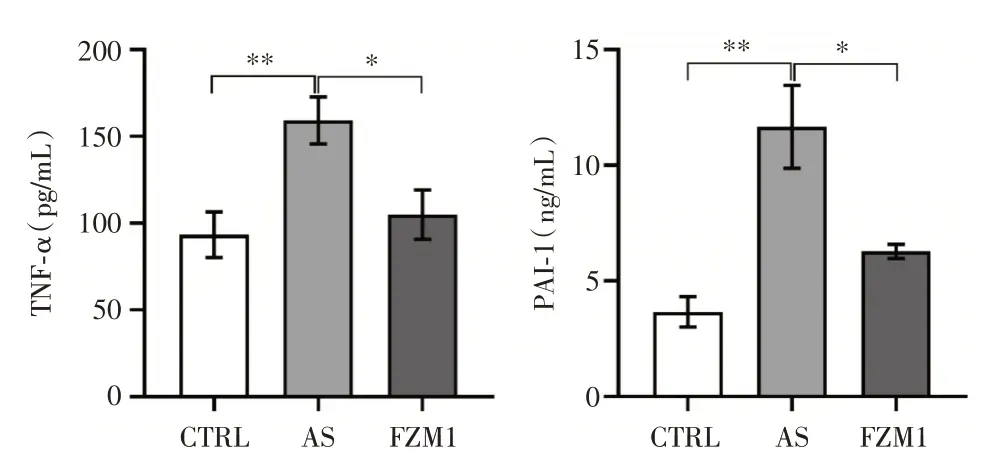
图4 3 组ApoE-/-小鼠血浆TNF-α 和PAI-1 的ELISA测定结果比较(n=8)
3 讨论
AS 是导致心血管疾病最常见的病理基础,心血管疾病是以粥样硬化斑块形成为特点的大、中动脉疾病,斑块内包括坏死组织、钙化结晶、修饰的脂质聚集、炎症平滑肌细胞(SMCs)、内皮细胞(ECs)、白细胞和泡沫细胞。AS 斑块的这些特征表明,AS 是一种复杂的疾病,血管、代谢和免疫系统的许多成分参与了这一过程。近年来,AS 的免疫和炎症机制引起了人们极大的兴趣,炎症因子与炎症细胞在AS 中起重要作用[3]。
AS 是大动脉内皮下脂质驱动的慢性炎症过程,ApoE-/-小鼠高脂喂养可以最大限度地模拟人类各个阶段的AS 病变。本研究采用主动脉切片油红O 染色、HE 染色观察小鼠主动脉AS 病理形态学改变进行AS 指标定量检测,结果均表明12 周高脂饮食可诱发ApoE-/-小鼠出现严重的高脂血症和明显的主动脉病变。血脂检测结果还发现RAGE 拮抗剂FPS-ZM1 对ApoE 小鼠的高血脂各指标均无影响,表明抑制RAGE 对AS 病变的影响与调控血脂无关,这与Mitchell 等[11]的研究结果一致,RAGE 的敲除对循环中脂质无影响。
RAGE 是一种1 型跨膜糖蛋白,由于其胞外区域中存在多个Ig 样结构域,因而认为是受体Ig 超家族的成员。细胞外区域包含三个Ig 结构域,包括V 型结构域,C1 型结构域和C2 型结构域。配体的结合主要发生在V 型结构域中。细胞外区域后面是单个跨膜区域和一个短的,带高电荷的胞内段结构域(ctRAGE),其与胞内衔接蛋白结合对下游信号传导至关重要[5,12]。RAGE 因能与AGE 结合而得名,后研究发现RAGE 基于电荷和多聚体状态可结合许多内源性非AGE 配体,比如S100/钙粒蛋白家族、HMGB1 等等。S100/钙粒蛋白家族、HMGB1、AGEs 均与炎症反应有密切关系,且在AS时表达有所增加[6,13-14]。这些配体与RAGE 结合可刺激活性氧(reactive oxygen species,ROS)、促炎性细胞因子、细胞黏附分子的产生和促血栓形成,活化核因子κB(nuclear factor Kappa-B,NF-κB)能进一步上调RAGE 表达,使得炎症级联反应持续发生,这些都与心血管疾病的病理生理有关[15]。FPS-ZM1 可通过竞争性结合RAGE V 型结构域,阻碍RAGE 与其他配体结合,从而抑制RAGE 下游信号传导[16],从而减弱其生物效应。由于RAGE胞浆结构域缺乏内源性激酶活性,其发出信号并影响转录程序和细胞功能的方式一直不明确,直到发现哺乳动物透明蛋白1(forin diaphanous-1,DIAPH-1)才得以阐明。RAGE 的胞质结构域主要是氨基酸R366/Q367,通过与DIAPH-1 的福尔曼同源1(FH1)结构域结合来传导信号;当这些氨基酸突变为丙氨酸或将DIAPH-1 敲除后会导致RAGE 与DIAPH-1无法结合[17],FPS-ZM1在RAGE 胞质结构域与DIAPH-1相互作用中的影响有待探索。
本实验中,在ApoE-/-小鼠中应用FPS-ZM1抑制RAGE 信号后发现AS 斑块有所减轻,且抑制促炎因子TNF-α 的释放,减轻AS 的炎症。组织纤溶酶原激活剂(t-PA)和PAI-1 是纤溶系统的一对重要的调节因子,主要由血管内皮细胞产生和分泌。当内皮细胞组织纤溶酶原激活剂/PAI-1 的动态平衡被打破时,血栓形成的风险增加。RAGE抑制剂在AS 模型小鼠中的使用可减少PAI-1 的释放,从而降低心肌梗死并发症的可能性。
综上所述,本研究在高脂诱发的ApoE-/-小鼠AS 模型中,通过RAGE 阻断剂FPS-ZM1 的干预减缓了AS 的进展,且AS 斑块的减少与血脂调控无关,同时FPS-ZM1 抑制了促炎因子TNF-α 和促血栓因子PAI-1 的释放。本研究结果将为开发以RAGE 为靶点的预防AS 药物提供理论基础。
