土壤高耐砷促生菌株的筛选及其对砷去除性能的研究
2022-04-26刘映彤薛林贵何园园寇嘉宾张怡洋许雅洁
刘映彤,薛林贵*,何园园,寇嘉宾,王 欢,张怡洋,许雅洁
(1. 兰州交通大学 生物与制药工程学院,兰州 730070;2. 甘肃省极端环境微生物资源与工程重点实验室,兰州 730000)
工业发展通常伴随着频繁的金属矿业的开采、冶炼活动,导致大量的工业废水及废气被不当排放,部分矿区周边的农田和土壤重金属含量因此严重超标,土壤植被覆盖率下降、微生物多样性降低[1-3].环境中的重金属经由食物链传播被人体摄取后,会对人体健康造成巨大危害[4].迄今为止,针对重金属污染土壤修复的方法主要由生物法、化学法和物理法构成[5].其中生物法因其经济、环保、操作简便,对环境无二次污染等优点,受到学界广泛关注.在生物法修复中,微生物-植物联合修复作为最有效的一种原位修复方式,具有广阔的应用前景[6].
在砷污染尾矿土壤中,砷主要以砷酸盐和金属硫化物的形式存在.在自然条件下,As3+和As5+是砷的主要存在形态,相较于有机砷,无机形式的砷具有更强的毒性和流动性[7].抗砷微生物一般由于其对砷具有一定吸附或转化能力,因而对砷具有耐受性.目前已发现多种植物及微生物具有富集或转化砷的能力,但多数针对抗砷菌的研究所筛选出的菌株仅对单一价态的砷具有耐性,且耐受性均不是很高[8-11].张凤凤等[12]从湖南省娄底市双峰县的铅锌尾矿区筛选分离出可耐受500 mg·L-1As3+的砷氧化菌;郭盾等[13]筛选自云南省砷污染土壤的库克菌(Kocuriacarniphila)最高可耐受1 000 mg·L-1的As3+.Fan等[14]从山阴县高砷沉积物中鉴定得到亚砷酸盐氧化细菌、砷酸盐还原细菌和亚砷酸盐氧化酶基因,主要为变形菌(Proteobacteria).穆遥等[15]自江汉平原仙桃市沙湖镇夹湖村的高砷沉积物中分离出抗砷菌,分别可耐受48 mmol·L-1As5+和10 mmol·L-1As3+的菌株,为假氨基杆菌属(Pseudaminobacter).陈倩等[16]从湖南石门和郴州的土壤中筛选得到多株可耐受20 mmol·L-1Na2As3O4的砷还原菌,多为放线菌.目前针对土壤中分离得到的菌株砷耐受浓度均不高,多数仅进行单一价态砷的耐受分离.因此在后续研究中有价值分离筛选出高耐受多种价态砷的抗砷菌株,并发掘更多不同种属的抗砷菌株,有助于进一步探明各菌属的抗砷机制.
甘肃省临泽县部分铁矿,因其长期从事开采活动,导致大量尾矿堆积.通过对尾矿土壤采样分析,发现包括砷、铅、镉、锰在内的多种重金属含量严重超标,且实验室已从该土壤中分离鉴定出多株对重金属耐受的菌株.此外,由于矿区土壤贫瘠,且存在多种重金属污染,不同重金属在土壤中又有多种赋存形态,因此对植物存在毒害作用,从而抑制植物的正常生长.一方面,促生菌株本身所产生的活性物质可改善土壤理化性质及微生物群落结构,从而促进植物生长;另一方面,抗砷菌株可通过转化砷元素形态,协同植物富集吸收砷.本研究拟筛选出对As3+和As5+均有高耐受性,且兼具促生作用的菌株,并对供试菌株的除砷性能进行初步探究,以期为后续开展植物-微生物联合修复砷污染土壤实验提供理论依据和菌种资源.
1 材料与方法
1.1 实验材料
1.1.1 供试菌株
本研究从实验室保藏菌株中选取10株菌进行抗砷菌株筛选,编号分别为LSP1(MW485635.1)、LSP2(MW485636.1)、LSP3(MW485637.1)、LSP4(MW485638.1)、LSP11(MW485644.1)、LSM1(MW485107.1)、LSM2(MW485108.1)、LSM3(MW485109.1)、LSM10(MW485112.1)、LSM12(MW485113.1).另从尾矿土壤中筛选出一株高抗砷菌株,编号为LYT1.实验供试菌株分离源土壤均采自甘肃省张掖市临泽县境内中北部一处铁尾矿,包括砷、铅在内的多种重金属含量均超标.采样地尾矿面积大约25 000 m2,海拔1 300~1 400 m,土壤原始pH为7.57~8.59.当地为大陆荒漠草原气候,年均降水量和蒸发量分别为118.4 mm和1 830.4 mm,年平均气温为7.7 ℃.
1.1.2 主要仪器试剂及培养基
主要仪器:紫外-可见分光光度仪,4802 US/VIS型(美国Unico公司);PCR扩增仪和 DNA 电泳仪,JY-600C型(广州市深华生物技术有限公司).
砷溶液的配制:亚砷酸钠(NaAsO2),称取亚砷酸钠(分析纯)0.7 g,溶于200 mL蒸馏水,得到2 000 mg·L-1的As3+母液;砷酸钠(Na3AsO4),称取砷酸钠(分析纯)6.65 g,溶于200 mL蒸馏水,得到12 000 mg·L-1的As5+母液,使用时过滤除菌.
CAS染液:0.1 mmol·L-1FeCl3,1 mmol/LCAS(铬天青), 0.1 mol·L-1磷酸盐缓冲液(Na2HPO4·12H2O 2.427 g,KH2PO40.075 g,NaH2PO4·2H2O 0.590 5 g,NaCl 0.125 g,NH4Cl 0.250 g,pH为6.8,使用前10倍稀释),4 mmol·L-1HDTMA.
Salkowski比色液:2 mL0.5 mol·L-1FeCl3·6H2O,98 mL30%高氯酸.
本文菌株分离及筛选所用培养基如表1所列.
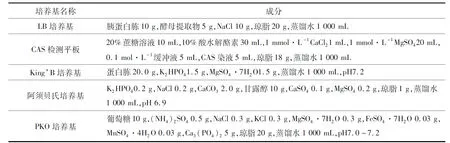
表1 实验所用培养基
1.2 研究方法
1.2.1 As耐受菌株的筛选
取5.0 g土样置于灭菌后的95 mLLB培养基,加入过滤除菌后的亚砷酸钠溶液,使As3+浓度为50 mg·L-1.富集培养24 h后,以2%接种量转接至As3+浓度为100 mg·L-1的培养基中,以相同条件培养,并逐步提高As3+浓度,转接5次后进行稀释涂布,分离并保存长势较好的菌株.同时将实验室低温保藏的菌株分别活化至OD600 nm=0.8~1.0,涂布至LB固体培养基,将分离出的单菌落传代3次.向50 mLLB培养基中添加过滤除菌后的亚砷酸钠溶液,以上述相同条件进行培养,并不断提高As3+浓度,以此筛选获得As3+高耐受菌株.
对初筛获得的As3+高耐受菌株进行As5+耐受性分析.将活化后的菌株接种至As5+浓度为50 mg·L-1的50 mLLB培养基中,培养条件与方法均与初筛时相同,最终得到对于As3+与As5+均高耐受的菌株,并确定菌株的最大耐受浓度.
1.2.2 菌株16SrRNA基因鉴定
将筛选出的供试菌株梯度稀释涂布至平板,观察菌落及革兰氏染色后的形态.由细菌DNA提取试剂盒对菌株LYT1进行DNA提取,并以细菌通用引物27F(5’-AGTTTGATCMTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)进行PCR.PCR反应体系如表2所列.扩增产物送至上海生工生物工程股份有限公司进行测序.在NCBI数据库提交测序结果并进行BLAST序列比对,并通过MEGA7.0,以邻接法构建系统发育树.
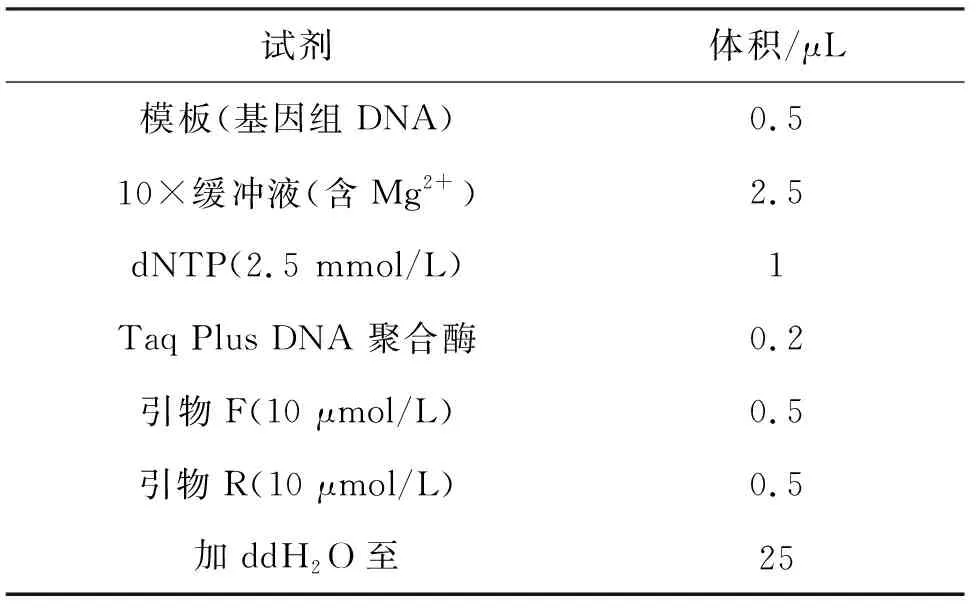
表2 PCR反应体系
1.2.3 菌株促生作用研究
探究供试菌株是否具有促生作用,为后续重金属污染土壤的植物生长及生物修复提供菌种资源.
1) 解磷能力测定
配制PKO固体培养基,将活化培养至OD600 nm=0.8~1.0的菌液稀释涂布至平板培养基,在28 ℃下培养3 d,具有解磷作用的菌株,会在菌落周围形成透明的溶磷圈.
2) 固氮能力测定
将活化的菌液梯度稀释涂布至阿须贝氏固氮培养基,28 ℃恒温培养3 d,观察平板上有无菌落形成,将单个菌落连续转接3次,能稳定生长的菌株即为固氮菌.
3) 产铁载体能力测定
将分离纯化后的菌株以分区点接种法接种于CAS检测平板上,30 ℃培养3 d,观察菌落,若菌落周围存在明显的橙黄色晕圈,则证明菌株具有产铁载体能力.
4) 产吲哚乙酸(IAA)能力测定
将供试菌株接种于50 mL的King’B培养基中,恒温培养3 d后,将菌悬液8 000 r·min-1离心6 min,分别取500 μL的上清液和500 μL的Salkowski比色液加入1.5 mL的离心管,于暗处静置30 min,等待显色.此外,分别以等量未接菌的空白培养基和50 mg·L-1的IAA替换菌液,作为阴性和阳性对照.可通过颜色变化初步判断菌株是否有产IAA能力,颜色越深则代表菌株产IAA的分泌量越多.
1.2.4 菌株生长条件研究
1) pH对菌株生长的影响
配制50 mLLB培养基,调节培养基pH分别为5、6、7、8、9,分别在培养4 h、8 h、12 h、24 h、28 h、32 h、36 h、48 h时测定生物量(OD600 nm).
2) 温度对菌株生长的影响
将菌株接种于50 mLLB培养基,分别在温度为20 ℃、25 ℃、30 ℃、35 ℃、40 ℃,最适pH条件下培养,在上述相同时间点测定生物量(OD600 nm).
3) As5+对菌株生长的影响
在50 mLLB培养基中添加砷酸钠溶液,使培养基中As5+浓度分别为50 mg·L-1、100 mg·L-1、200 mg·L-1、400 mg·L-1、800 mg·L-1,在最适pH及温度条件下培养,在上述相同时间点测定生物量(OD600 nm).
观察各菌株在以上不同条件下的生长情况,每组处理设置3个平行,并用Origin8.0绘制生长曲线.
1.2.5 复合菌株对水体中砷的去除能力研究
在构建复合菌剂前首先对高耐砷菌株进行拮抗试验.具体方法参考琼脂扩散法[17].将菌株LSM1和LYT1分别培养至对数期,取40 μLLSM1菌悬液加入灭菌后冷却至50 ℃的200 mL的LB固体培养基中,摇匀后倒平板,待其凝固后,用直径为3 mm的打孔器打孔,并在孔中加入40 μL的LYT1菌悬液,30 ℃下培养3 d,若打孔洞周围有透明的抑菌圈形成,则两菌之间存在抑制作用.
将菌株LSM1、LYT1分别在最适生长条件下培养至对数期后,各取1 mL菌液加入50 mL灭菌的LB培养基中,30 ℃,150 r·min-1下培养12 h后获得复合菌剂.分别配制As5+浓度为50 mg·L-1和100 mg·L-1的LB培养基,之后分别接种菌株M1、LYT1及复合菌剂,以相同条件培养,分别在对数期(24 h)和稳定期(48 h)取样,将菌液8 000 r·min-1离心6 min.以ICP-MS测定上清液中As5+的浓度,主要工作条件为:功率1 550 W,辅助气流及载气流量1 L/min,样品提升量1 mL·min-1.分别以不加As5+和不加菌的培养基作为阴性和阳性对照,利用公式(1)计算水体中的砷去除率.
(1)
式中:n表示As去除率;Co表示培养基中原始砷浓度(mg·L-1);Ce表示处理后液体中剩余砷浓度(mg·L-1).
1.2.6 数据处理与分析
菌株测序后的序列提交至NCBI数据库进行BLAST,利用MEGA7.0软件构建系统发育树.所有数据储存至Microsoft Excel 2019,并通过SPSS 26和Origin 2019绘制图形.
2 结果与分析
2.1 高抗砷菌株的筛选
在经过As3+的初筛后,各菌株的生长状况如图1所示.如图1可知,在As3+浓度达到300 mg·L-1前,11株菌均可生长.各菌株的生长随着As3+浓度不断升高而逐渐被抑制.其中菌株LSM1、LSM3和LYT1对As3+表现出较高的耐受性,在As3+浓度为3 000 mg·L-1的培养基中均可生长,两株菌最大耐受浓度为3 200 mg·L-1.因此表明,以上三种菌株为高耐As3+的优势菌株.
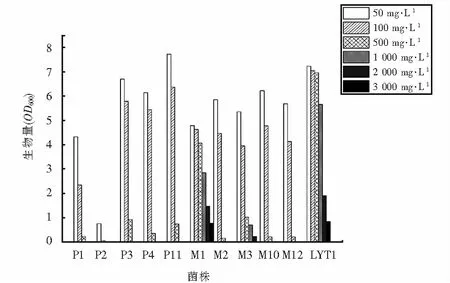
图1 菌株在不同As3+浓度下的生长情况Fig.1 Growth of strains under different As3+ concentration
对初筛得到的LSM1、LSM3、LYT1进行As5+耐受复筛,最终获得两株兼具对As3+和As5+高耐受性的菌株,分别是LSM1和LYT1,两者对As5+的最大耐受浓度分别可达5 500 mg·L-1和6 000 mg·L-1,最终被选择作为后续研究的供试菌株.
2.2 菌株的鉴定
菌株LSM1和LYT1的菌落形态及革兰氏染色结果,如图2所示.LSM1的菌落较大,呈米白色圆形,为革兰氏阳性菌.LYT1为白色菌落,表面干燥并凸起,边缘规则,革兰氏染色呈阴性.
将PCR扩增后的产物以1%琼脂糖凝胶电泳检验,结果如图3所示.扩增产物送测,拼接得到的16SrRNA基因序列在NCBI中进行BLAST比对后,由MEGA7.0构建了菌株LSM1及LYT1的系统发育树,结果如图4所示.菌株LYT1序列长度为1431bp,在GeneBank中的登录号为OK560662,该菌株与鲍曼不动杆菌(Acinetobacterbaumannii)的相似度最高(99%),因此被鉴定为不动杆菌属.菌株LSM1为芽孢杆菌属,在数据库中的登录号为MW485107.1.
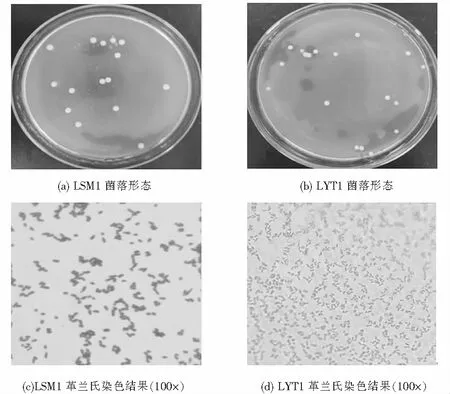
图2 菌株LSM1、LYT1的菌落形态及革兰氏染色结果Fig.2 Colony morphology and gram straining results of strains LSM1 and LYT1

图3 菌株LYT1的琼脂糖凝胶电泳图Fig.3 Agarose gel electrophoresis of strain LYT1
2.3 菌株促生性能定性测定
对菌株LSM1和LYT1进行促生性能定性测定,包括解磷、固氮、产铁载体及产IAA能力.各菌株促生作用测定结果如表3所列.其中LYT1在PKO无机磷培养基生长时,菌落周围出现透明的溶磷圈,如图5所示,可初步判断LYT1具有解磷性能.将菌株在阿须贝氏固氮培养基中培养3 d后,未见LSM1生长,而LYT1可生长,表明只有LYT1具有固氮能力.在产铁载体测定中(见图6),两株菌均未在培养基表面产生橙黄色晕圈,表明其均无产铁载体活性.如图6可知,在产IAA活性测试中LSM1和LYT1都具备一定产IAA的能力,其中LSM1在显色反应中颜色更深,表示其产IAA能力更强.
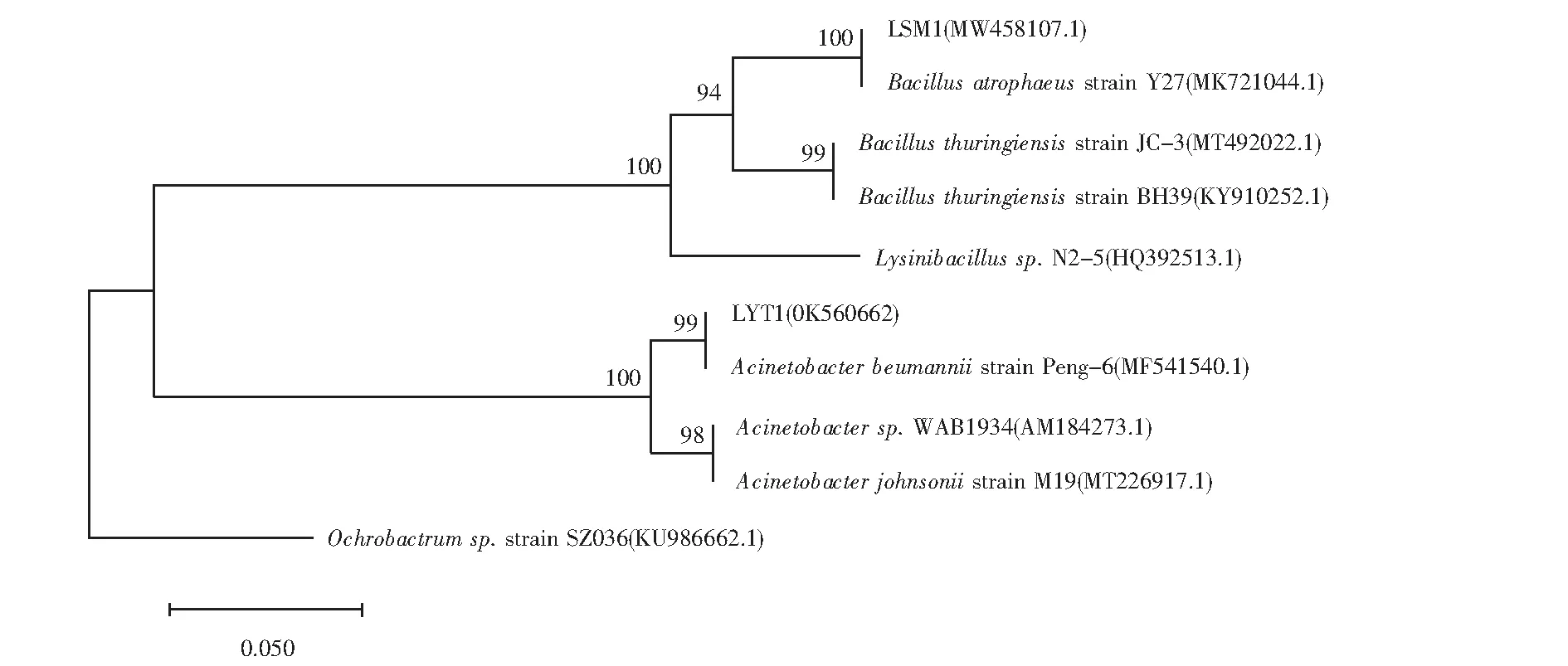
图4 菌株16SrRNA基因系统发育树Fig.4 Phylogenetic tree of strain based on 16SrRNA sequence

表3 菌株促生能力定性测定

图5 菌株的解磷能力Fig.5 Phosphorolysis capacity of the strains
2.4 菌株最佳生长条件的研究
2.4.1 pH对菌株生长的影响
菌株LSM1和LYT1在不同pH条件下的生长曲线如图7所示,两株菌在pH为5~9的范围内均可生长,说明菌株对环境中的pH变化有较强的适应能力.但与碱性条件(pH=9)相比,在酸性条件下(pH=5)两株菌生长受到的抑制更明显,这与菌株分离源土壤pH值呈碱性相符.由图7可知,LSM1与LYT1的最适生长pH均为7,pH升高或降低,对于两株菌的生长均有不同程度的抑制.
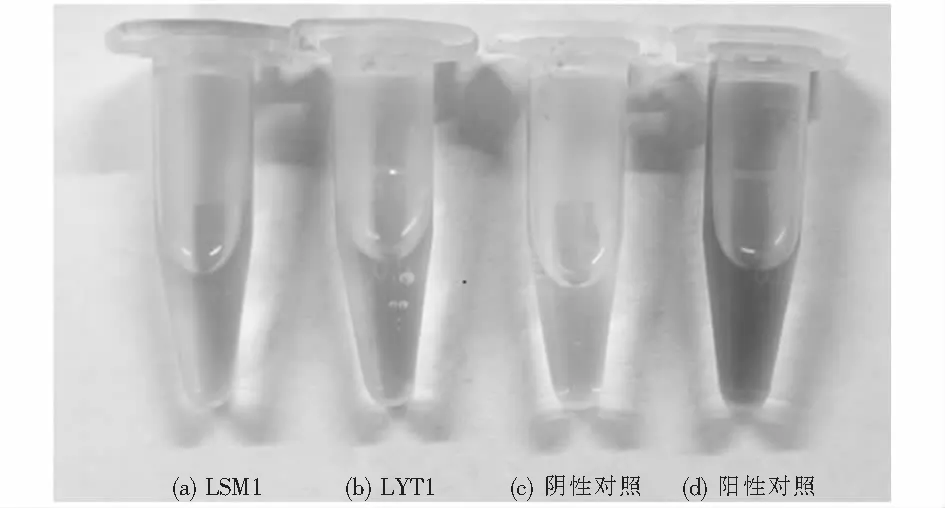
图6 菌株的产IAA能力Fig.6 IAA production capacity of the strains
2.4.2 温度对菌株生长的影响
不同温度对菌株LSM1和LYT1生长的影响,如图8所示,结果显示,相较于pH,温度对两者的生长影响更为显著,在高温和低温环境对于两株菌的生长均有较大程度的抑制.其中LSM1对高温更敏感,在40 ℃条件下,其生长受到的抑制最明显;低温环境对于LYT1影响更大,在20 ℃条件下,其生长最为缓慢,对数期延后.两株菌的最适生长温度均为30 ℃,属于中温菌.
2.4.3 As5+对菌株生长的影响
在菌株最佳生长条件下,为探明As5+浓度对高耐砷菌株生长的影响,分别设定As5+浓度分别为50 mg·L-1、100 mg·L-1、200 mg·L-1、400 mg·L-1、800 mg·L-1五个浓度梯度,菌株生长情况如图7所示.随着As5+浓度不断升高,菌株LSM1的生长逐渐受到抑制,浓度越高则抑制作用越显著,在浓度为50 mg·L-1和100 mg·L-1时,菌株稳定期缩短,在浓度为200 mg·L-1、400 mg·L-1、800 mg·L-1时,对数期明显延迟,表明As5+对菌株生长活动有较大影响,其最适生长浓度为50 mg·L-1.而菌株LYT1则在浓度为50 mg·L-1~800 mg·L-1的范围内均能良好生长,其受As5+的影响并不明显,最适生长浓度为100 mg·L-1,在初筛及复筛时对As3+和As5+也均表现出高耐受,可作为后续研究的目标菌种.
图7 不同pH下菌株的生长情况Fig.7 Growth of strains at different pH
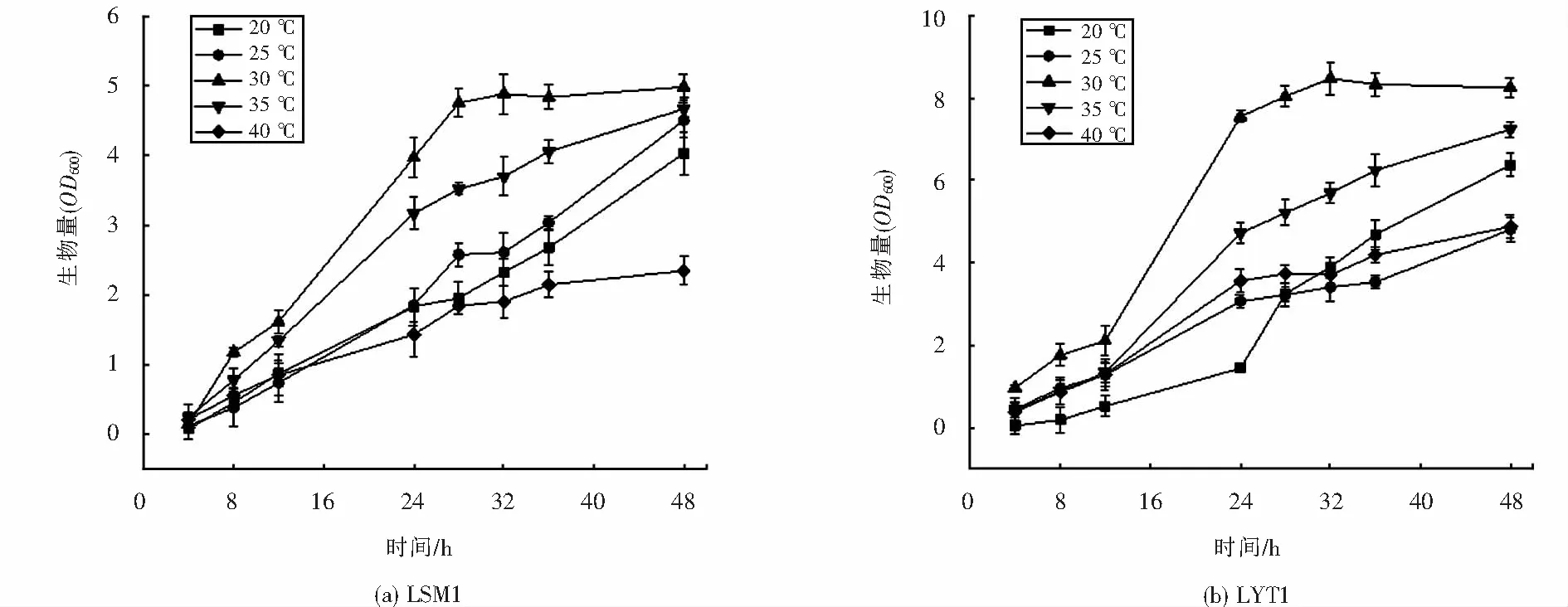
图8 不同温度下菌株的生长情况Fig.8 Growth of strains at different temperatures
2.5 复合菌剂对水体中砷的去除能力
构建复合菌剂前,首先对菌株LSM1和LYT1进行了拮抗实验,结果如图8所示.平板中未形成透明的抑菌圈,表明两种菌株间不存在拮抗作用,不会抑制彼此生长,因此可用于构建复合菌剂.
在最佳生长条件下,对LSM1、LYT1及复合菌剂分别进行了As5+去除能力的测定,结果如图9所示.菌株作用48 h时对砷的去除率均比24 h时的高,其中菌株LSM1在100 mg·L-1的As5+浓度下,去除率由24 h时的27.67%提升为46.88%.50 mg·L-1浓度下的As5+去除率均比100 mg·L-1浓度下的高,说明较高浓度的As5+可能对菌株的生长代谢产生影响,进而使去除率降低.在相同时间和浓度条件下,LYT1的去除率高于LSM1.此外,复合菌剂的去除率与单一菌株的去除率之间存在显著差异.在48 h,50 mg·L-1As5+浓度下,复合菌剂的As5+去除率可达67.40%,均大于LYT1的53.67%和LSM1的47.89%.综上所述,当菌株生长至稳定期(48 h),As5+为50 mg·L-1时,菌株对砷的去除效果最好,复合菌剂的去除率均高于单菌(LYT1、LSM1).

图9 不同As5+浓度下菌株的生长情况Fig.9 Growth of strains under different As5+ concentration

图10 菌株拮抗实验Fig.10 Strains antagonism experiment
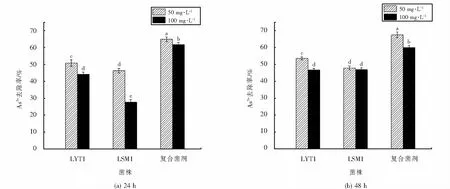
图11 不同时间下菌株对As5+的去除率Fig.11 Removal rate of As5+ by strain at different time
3 讨论
本研究从分离自铁尾矿土壤的菌株中筛选出两株高耐砷的菌株.其中LYT1(Acinetobacterbaumannii)可耐受高达3 200 mg·L-1的As3+和6 000 mg·L-1的As5+.Blum等[18]从加利福尼亚州莫诺湖的缺氧污泥中分离到两株革兰氏阳性厌氧细菌(E1H和MLS10),均为芽孢杆菌.Suhadolnik等[19]研究了长期受砷污染的热带沉积物中细菌多样性,其中兼具AsV和AsⅢ抗性的菌群包括:拟衣藻属(Dechloromonas),速生食酸菌属(Acidovoraxfacilis),德氏食酸菌属(A.delafieldii).Cavalca等[20]本文利用荧光原位杂交技术对砷污染根际土壤微生物进行了研究,结果表明,抗砷菌株分属于13个属,其中以芽孢杆菌属(Bacillus),无色杆菌属(Achromobacter),短波单胞菌属(Brevundimonas),微杆菌属(Microbacterium)和苍白杆菌属(Ochrobactrum)含量最高,大多数细菌可在高浓度砷(超过100 mmol·L-1的砷酸盐和10 mmol·L-1的亚砷酸盐)下生长.然而目前关于不动杆菌属的抗砷菌还鲜有报道,日后值得对该菌属抗砷相关机制进一步进行研究,在土壤砷污染土壤修复方面具有潜在的应用价值.
目前已从多种重金属污染土壤中分离出不同促生菌株.Cavalca等[20]从砷污染根际土壤中筛选得到的部分细菌具有产铁载体、吲哚乙酸和1-氨基-环丙烷-1-羧酸脱氨酶的功能.曾东等[21]将从石门雄黄矿区筛得的两株菌接种至蜈蚣草根际,蜈蚣草的增长效率、根系长度及地上部分含砷量均有明显增长,且菌株降低了蜈蚣草地下部分的丙二醛和脯氨酸含量,以此减轻砷对蜈蚣草的胁迫.AGELY等[22]在不同砷水平下对蜈蚣草进行了温室实验,在最高砷施用率下真菌群落增加了叶子的干质量,并在一定范围的磷水平上促进了砷吸收.以上研究表明,微生物可以通过多种机制促进超积累植物的生长以及对污染土壤中重金属的富集[23-26].施加促生菌株可通过改善土壤理化性质及微生物群落结构,以此促进植物生长.此外,微生物一方面可以将高毒性砷转化为低毒性砷;另一方面,植物对磷和五价砷的吸收都通过磷酸盐转运蛋白实现,因此五价砷会对植物吸收利用磷元素造成竞争和拮抗,而微生物可将五价砷还原为三价砷,不受磷的竞争拮抗,不影响植物摄取所需磷元素,以此促进植物对砷的富集.本研究得到的高耐砷菌株同时具有解磷、固氮、产IAA活性,有望在后续研究中进一步探究更有效的植物-微生物联合修复策略.
有关微生物应对砷的机制包括细胞外沉淀和细胞内转化.其中细菌对砷的胞外沉淀作用包括两个过程,一是细菌细胞壁及细菌胞外聚合物对砷的吸附,二是细菌本身通过新陈代谢作用,将重金属累积在体内,由此达到去除砷的目的[27].此外,微生物具有通过还原As(V)、As(III)氧化和甲基化来介导砷氧化还原转化的能力[28],因此微生物介导的过程可以增强或降低金属迁移率和生物利用度,从而增加或减少金属的毒性.郭盾[13]在不同pH、初始As3+和接种时间下研究了高耐砷菌株的除砷率,三株供试菌株在不同条件下的除砷率均没有超过40%.李宝花[29]从砷污染土壤中筛选出三株菌,并对三株菌的除砷效果进行了比较,其中菌3(假单胞菌属)在砷浓度为100 μg·L-1的浓度下,吸附去除率为39.7%.本研究筛选获得的菌株,构建的复合菌剂去除率最大可达67.4%,高于前人报道的去除率.综上所述,本研究筛选获得的菌株对砷的耐受和去除均有较强的能力,并对高砷土壤环境中的植物生长具有潜在的促生作用,在砷污染土壤的微生物-植物联合修复研究领域具有一定的应用前景.
4 结论
本研究从实验室保存及分离自甘肃省临泽县铁尾矿土壤的11株菌株中,筛选驯化出两株高耐砷菌株.其中菌株LSM1分别可耐受3 000 mg·L-1的As3+和5 500 mg·L-1的As5+,菌株LYT1分别可耐受3 200 mg·L-1的As3+和6 000 mg·L-1的As5+.菌株LSM1为萎缩芽孢杆菌(Bacillusatrophaeus),具有产IAA活性;经16SrRNA基因鉴定,菌株LYT1为鲍曼不动杆菌(Acinetobacterbaumannii),具有解磷、固氮、产IAA的促生作用.LSM1的最佳生长条件为pH=7、30 ℃、As5+50 mg·L-1,LYT1的最佳生长条件为pH=7、30 ℃、As5+100 mg·L-1.在最适生长条件下,复合菌剂的去除率均大于单一菌株的去除率,在50 mg·L-1的As5+浓度下培养48 h时砷去除率达到最大,为67.40%.在同一浓度不同时间下,48 h的砷去除率均高于24 h时的去除率;在同一时间不同浓度下,As5+为50 mg·L-1时的砷去除率均高于100 mg·L-1时的去除率.在同一时间和浓度下,LYT1的As5+去除率高于LSM1,两者在48 h、50 mg·L-1As5+浓度下的去除率分别为53.67%和47.89%.以上研究结果可为后续高耐砷菌株联合植物修复砷污染土壤提供优质的菌种资源,可为后续研究耐砷菌株的抗砷机制奠定理论基础.
