基于RNA-seq筛选NSUN2调控的A549细胞差异表达基因
2022-04-25雷静静唐铖铖路宏朝
雷静静, 冯 光, 唐铖铖, 路宏朝
(陕西理工大学 生物科学与工程学院, 陕西 汉中 723000)
NSUN2(NOP2/Sun RNA methyltransferase family member)属于NOL1/NOP2/sun家族蛋白,其编码的蛋白是一种m5c RNA甲基转移酶,主要负责tRNA和mRNA的甲基化修饰[1]。NSUN2可以对多种RNA的各种甲基化位点进行甲基化,以产生多种细胞生理调控功能。研究证实,m5C的甲基化水平与血管发育畸形、血管瘤发生存在相关性。如多种m5C甲基化在内皮细胞发育、血管钙化、腹主动脉瘤发生过程中扮演重要角色[2]。NSUN2已被证明可使原癌基因SHC在转录水平甲基化,并在氧化或高葡萄糖应激条件下使SHC翻译水平增强,加速人血管内皮细胞的衰老[3]。NSUN2对细胞间黏附分子1(ICAM-1)的mRNA进行甲基化修饰,促进该黏附分子的翻译水平升高,并导致白细胞对内皮细胞的黏附性增加,从而加大白血病的发病风险[4]。此外,NSUN2的异常表达与大量肿瘤疾病发生发展相关[5]。Yuan等发现NSUN2参与蛋白酶激活受体2(Grb2)介导的结肠癌细胞迁移过程。Grb2相关结合蛋白作为miR-125b的靶向调控基因是一种典型的促肿瘤细胞迁移蛋白,在结直肠癌中NSUN2的高表达抑制miR-125b从而促进Grb2相关结合蛋白的表达,引起癌细胞的迁移速率增强[5-7]。在乳腺癌细胞中DNA的低甲基化水平与NSUN2过表达也相关,NSUN2过表达促进癌细胞增殖、迁移和侵袭,而NSUN2敲除则抑制该过程[8]。NSUN2基因的敲除导致RNA生物合成过程一定程度受阻,且影响生物体正常的转录后修饰途径。分析发现,NSUN2与大多数脑细胞的发育及能量代谢的维持有关,该基因的敲除将导致新生个体脑组织发育不全或智力受损[9]。NSUN2还具有可以直接甲基化CDK1(cyclin-dependent kinase 1)的mRNA调控其蛋白表达,影响细胞周期,进而对肿瘤细胞的增殖具有促进作用[10]。Wang等[11]研究发现在体内和体外水平,NSUN2可甲基化修饰P27基因mRNA的5’UTR,从而抑制P27基因的翻译;但是对mRNA的3’UTR的甲基化则会起到促进P27基因的翻译过程。因此,深入探究NSUN2生物学功能,以及在不同肿瘤疾病的作用机制可为寻找新的肿瘤治疗靶点提供有力依据。
本研究通过构建慢病毒干扰的NSUN2载体,转染到非小细胞肺癌A549细胞,筛选获得NSUN2敲低的细胞株,采用转录组测序技术和生物信息学的方法对干扰细胞株基因表达谱进行分析,筛选差异表达基因。对差异表达基因的功能和参与的相关信号通路进行富集分析,筛选出可能受NSUN2调控的潜在关键基因,探究NSUN2对非小细胞肺癌发生发展的潜在分子机制。
1 材料与方法
1.1 细胞培养
人非小细胞肺癌细胞系A549购自赛百慷公司。50 mL A549细胞培养基:含45 mL胎牛血清和5 mL双抗的RPMI-1640培养基(美国Gibco公司),将其放入37 ℃,5% CO2细胞培养箱中进行培养。
1.2 主要试剂
胎牛血清(GEMINI)、Opti-MEM(Gibco)、Lipofectamine 2000转染试剂(Invitrogen)、嘌呤霉素(TaKaRa)、青霉素和链霉素双抗(Invitrogen)、RIPA裂解液(新赛美)、ECL(DIYIBio)、PVDF膜(Millipore)、BCA蛋白定量试剂盒(上海碧云天生物技术公司)、5×蛋白上样缓冲液(上海碧云天生物技术公司)、三色预染蛋白Marker(Thermo Fisher Scientific)、羊抗兔IgG(Abcam)、NSUN2单克隆抗体(proteintech)、HRP-抗GAPDH鼠单克隆抗体(proteintech)。
1.3 NSUN2慢病毒干扰和对照细胞系的构建
将NSUN2干扰载体/无关序列载体(实验室保存)、辅助质粒和脂质体2000混匀,制备DNA/脂质体的混合悬液,室温静置20 min。将DNA/脂质体复合物转染293T细胞。分别于转染48 h、72 h后收取细胞上清,经离心后收集病毒,侵染A549细胞,侵染24 h更换新鲜培养基。然后用2 μg/mL嘌呤霉素(Puro)对细胞连续筛选7 d,获得稳定干扰的细胞株,将对照组细胞命名为NC,干扰组为sh-NSUN2。
1.4 Western Blot检测NSUN2蛋白表达水平
收集NC组和sh-NSUN2组的细胞,采用RIPA裂解液(武汉博士德公司)对两组细胞进行裂解,制备蛋白样品。采用BCA法测定蛋白质浓度,加入蛋白上样缓冲液(5×),水浴煮沸5~10 min。制备体积分数10% SDS-PAGE凝胶,将制备的蛋白质样品上样,电泳后,通过转膜把凝胶中的蛋白质转移到PVDF膜上。脱脂奶粉封闭,一抗4 ℃孵育过夜,根据NSUN2和GAPDH的属性选择相应的二抗孵育,室温2 h。TBST清洗3次,加入ECL显色液反应、曝光、记录结果。
1.5 转录组测序和差异基因表达
收集NC组和sh-NSUN2组细胞各收集三大皿,用PBS清洗两遍,分别加入1 mL Trizol裂解液裂解3 min,放入1.5 mL离心管编号后置于干冰中,送往深圳华大基因有限公司完成转录组测序。具体操作:采用Trizol提取NC组细胞和sh-NSUN2组细胞的总RNA,测定浓度,RNA经质量鉴定合格后进行建库,利用Illumina测序平台进行高通量转录组测序。使用DEGseq在线软件以|log2(Fold change)|≥1且P≤0.05为标准进一步筛选差异表达基因(differentially expressed genes,DEGs)。
1.6 测序数据质量控制
测序产出大量原始数据(raw data),为保证测序分析的质量,对原始数据进行筛选,去掉接头和低质量的reads之后,获得高质量数据(clean data)。
1.7 DEGs的RT-qRCR验证
用Trizol法提取细胞总RNA,按照EvoM-MLV RT Kit with gDNA Clean试剂盒说明书将其反转录为。选取差异表达基因3个,以人源GAPDH为内参基因,用Primer5设计所用引物,引物名称及序列见表1。反应体系配制及条件按SYBR Green Premix Pro Taq HS qPCR Kit试剂盒说明书进行,每个样本重复3次,用2-ΔΔCt法计算目的基因的表达量。

表1 定量引物序列
1.8 转录组测序数据GO、KEGG以及GSEA分析
登录华大基因组学系统https://biosys.bgi.com,对差异表达基因进行GO注释、KEGG通路分析和GSEA分析。
1.9 数据处理与统计
采用SPSS 13.0软件进行统计学分析,Origin 2017软件绘图。所有实验独立重复3次,采用单因素方差分析对多组间均数进行比较,结果以平均值±标准差(Mean±SD)表示,以P<0.05或P<0.01表示差异具有统计学意义。
2 结果
2.1 干扰NSUN2基因蛋白表达量分析
待细胞生长密度达到80%时,用携带shRNA-NC、shRNA-NSUN2序列的慢病毒侵染A549细胞,细胞生长状态良好,加入嘌呤霉素(puro)进行筛选。获得稳定干扰shRNA-NSUN2的A549细胞株。Western blot结果表明NSUN2蛋白表达量明显降低(见图1(a)),经灰度分析,发现干扰效率是79.2%,差异极显著(见图1(b))。说明本研究成功获得了稳定干扰NSUN2基因的A549细胞株。
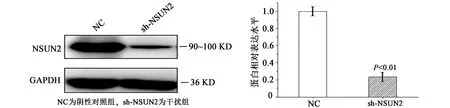
(a)Western blot检测NSUN2蛋白表达量 (b)NSUN2蛋白灰度分析 图1 NSUN2蛋白表达水平
2.2 转录组测序质量评估、差异表达基因的筛选及聚类
测序错误率受仪器系统误差、人为操作误差等多方面影响。为了使分析结果更加可靠,对原始数据进行了整理和筛选,将NC-shRNA组与NSUN2-shRNA组细胞样各3个重复样品数据基本情况整理见表2,其中NC-shRNA1/2/3过滤后的Reads占比均大于99%,NSUN2-shRNA1/2/3过滤后的Reads占比均大于98%。所有样品Q20均大于98%,Q30均大于94%。综上,本次NC-shRNA组与NSUN2-shRNA组细胞样样品测序生成的数据均符合转录组分析相关要求。

表2 过滤后Reads质量统计
为探究敲低NSUN2的表达对A549细胞的影响,首先对shRNA-NC细胞和shRNA-NSUN2细胞的转录组数据进行分析,筛选A549细胞中NSUN2敲低表达后的差异表达基因。结果发现,与对照组相比,在敲低NSUN2的A549细胞中共有8117个DEGs,其中上调基因4089个,下调基因4028个,如图2所示。以|log2(Fold change)|≥1且P≤0.05为标准进一步筛选DEGs,敲低组中共鉴定出1236种DEGs,其中957个基因上调,279个基因下调,差异基因的具体分布情况如图2(a)所示。对筛选获得的差异表达显著的基因进行聚类分析,如图2(b)所示,重复组的DEGs基本一致,对照组和实验组之间也存在明显的差异,说明本研究使用的样品分组合理,测序结果准确可靠。

(a)差异基因火山图 (b)差异基因表达量聚类热图图2 差异基因表达数量统计分析

图3 GO富集分析结果
2.3 差异基因GO功能富集
进一步对DEGs进行GO分析,探究其生物学功能。将差异基因按照细胞组分(CC)、生物学过程(BP)和分子功能(MF)进行分类,选择每个GO分类中富集最显著的前20个term,如图3所示。与对照组相比,NSUN2敲低组的差异表达基因参与多种生物学过程,在细胞组分范畴内,主要富集在质膜部分、细胞外基质、内膜系统、细胞质、细胞连接、分泌泡囊等方面(见图3(a));在生物学过程中,包括外部刺激反应、生物学过程调节、细胞粘着、信号传递等(见图3(b));在分子功能类别上,主要富集离子通道、蛋白质结合、RNA聚合酶II调控区等(见图3(c))。说明在A549细胞中敲低NSUN2将影响多种细胞组件的基因表达。
2.4 基因富集分析
为进一步明确NSUN2通过哪些信号通路影响A549细胞的生物学功能,对数据集首先进行基因集富集分析(Gene Set Enrichment Analysis,GSEA)。按照富集分数(NES)排序NSUN2敲低组富集的前10个信号通路如图4(a)所示。其中,排在第一位和第二位的分别是整合素β1信号通路(见图4(b))和整合素α9β1信号通路(见图4(c))。进一步利用KEGG通路综合分析在差异基因表达中的基因所可能参与的主要生化功能代谢机制过程形成途径和主要信号传递通路,结果表明,差异基因表达中的基因在325条主要信号传递通路中,显著富集(P<0.05)的通路有87个,按P值由小到大选择前15个通路,以散点图的形式展示(见图4(d))。结果发现富集的通路主要集中在免疫系统、癌症、信号转导、脂质代谢、信号分子相互作用等方面。其中,信号转导通路中主要包括PI3K-Akt信号通路和Jak-STAT信号通路;信号分子相互作用中包括细胞黏附分子(CAMs),细胞外基质受体相互作用,细胞因子-细胞因子受体相互作用3条信号途径。结合GSEA和KEGG通路富集分析发现,在A549细胞中NSUN2敲低表达后,差异基因主要富集在整合素介导的信号通路。研究发现,整合素是跨膜糖蛋白受体,通过与配体的相互作用直接或者结合作用来控制介导人类细胞与人体蛋白、细胞与其他蛋白质以及其他人体细胞外生物基质之间相互粘连和互相黏附,及双向消息信号的相互传导等生理过程,从而有效地控制细胞的正常生长、增殖、分化和功能转移[12]。进一步推测NSUN2可能通过整合素信号通路影响非小细胞肺癌的发生发展过程。

(a)GSEA排名前10的信号通路富集分析结果
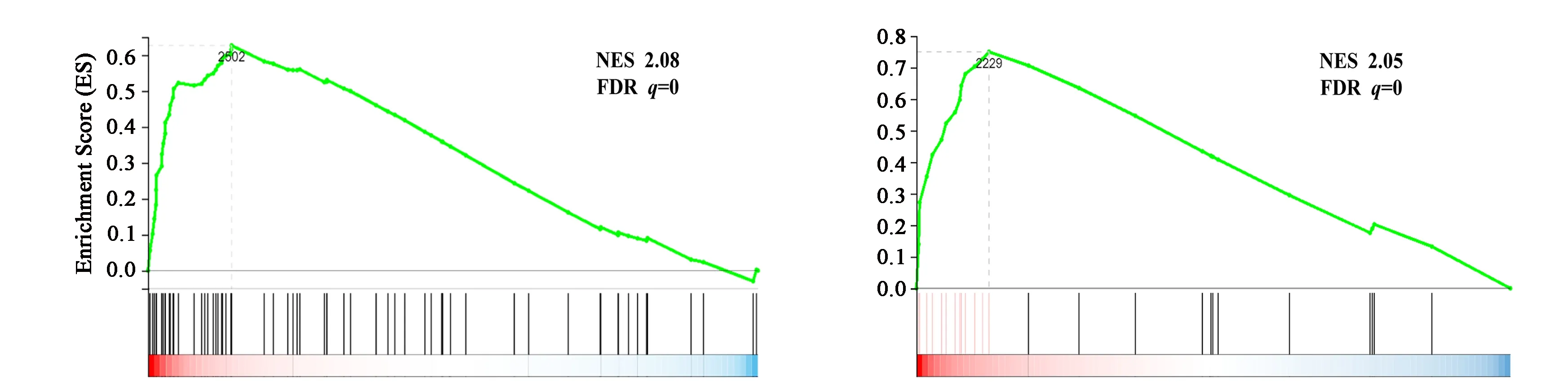
(b)整合素β1信号通路 (c)整合素α9β1信号通路
2.5 RT-qRCR验证分析
基于GSEA和KEGG富集分析结果,进一步筛选整合素介导信号通路中的3个差异基因(ITGβ1、ITGα5、ITGα9)进行表达水平检测。RT-qPCR结果显示,NSUN2干扰表达后,ITGβ1、ITGα5的表达水平显著下调,然而ITGα9的表达水平没有显著变化(见图5)。结果显示与转录组测序结果(表3)基本一致,说明转录组测序结果较为准确,同时在A549细胞中NSUN2敲低表达后,影响整合素信号通路相关基因的表达。
3 结论与讨论
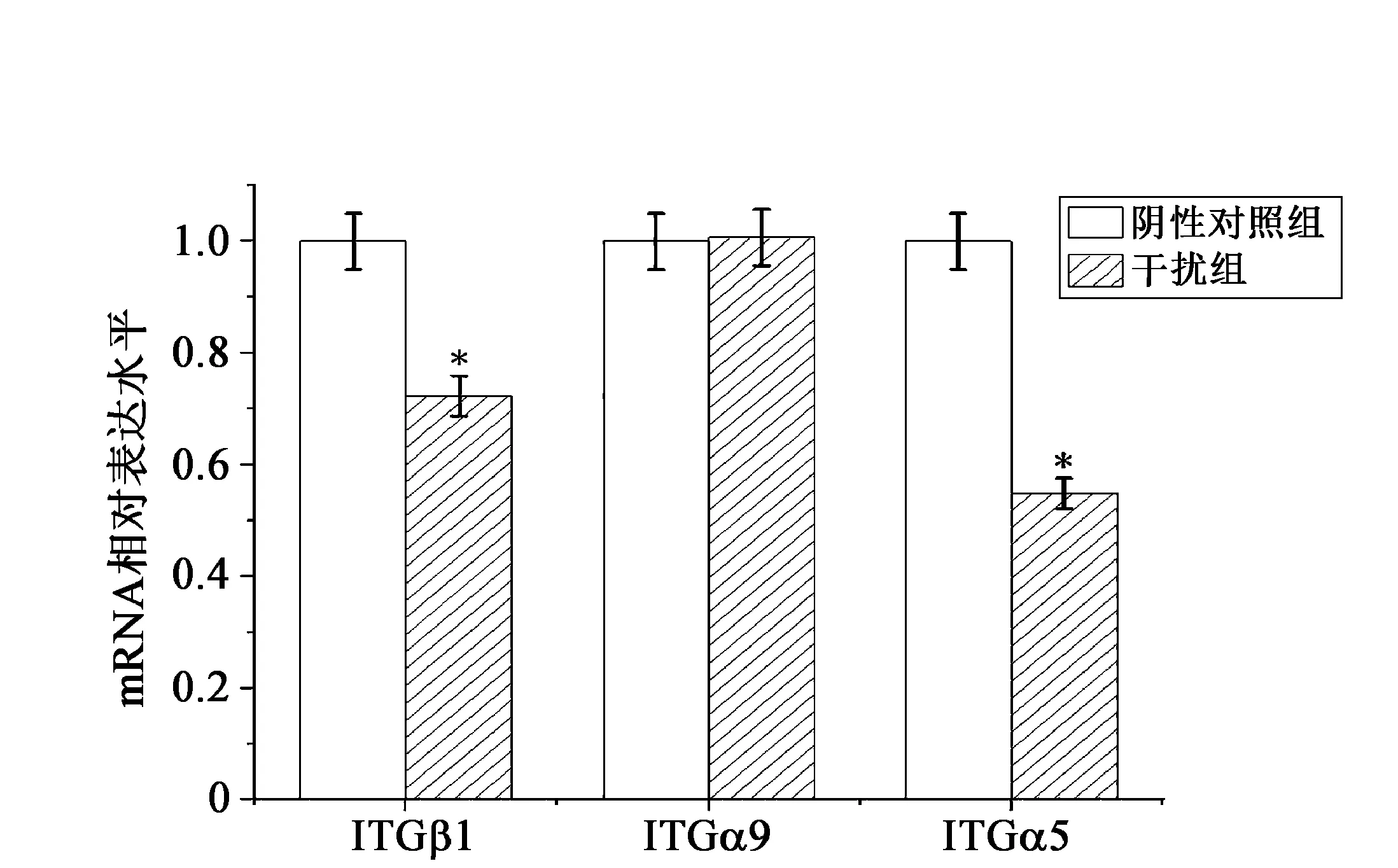
图5 转录组筛选的差异基因RT-qPCR验证
在过去几年里,RNA修饰技术被研究人员发现对许多肿瘤的形成和发展都有重要作用。其中,RNA的甲基化是最常见的,NSUN2是一种RNA的m5c甲基转移酶。NSUN2是MYC诱导的肿瘤细胞增殖的介质[13],是一种在细胞增殖中快速正确组装纺锤体及其完整性的稳定剂[14]。NSUN2还可以通过多种途径促进人体中癌细胞的增殖和生长[13],并且可以在肿瘤细胞抵抗氧化压力时起到重要的应激调控功能[15]。然而,在肺癌细胞的生长过程中,NSUN2如何调控细胞的生物学功能尚不明确。本研究通过转录组测序分析,比较了对照组细胞和敲低NSUN2的A549细胞中基因表达的情况,筛选出1236个表达显著的差异基因,其中上调有957个,下调有279个,推测NSUN2可能通过调控这些差异基因的表达介导非小细胞肺癌细胞的发生发展。

表3 整合素信号通路差异基因
GSEA和KEGG pathway富集分析发现在A549细胞中NSUN2敲低表达后,差异基因主要富集在整合素介导的信号通路中。目前的临床研究结果表明,在恶性肿瘤中,整合素具有双向信号传递的功能,直接或者间接地影响恶性肿瘤的细胞形成、迁移、浸润和细胞变异等多个环节[16]。整合素在大多数恶性肿瘤中的表达影响肿瘤细胞与细胞外基质的相互作用,促进肿瘤细胞迁移,并有助于其存活[17]。本研究筛选出与整合素信号途径相关的差异基因,发现ITGβ1、ITGα5的表达水平与转录组测序结果相一致。研究发现整合素β1(ITGβ1)在乳腺癌、前列腺癌、胰腺癌等多种恶性肿瘤中均高表达,ITGβ1促进非小细胞肺癌细胞的存活、迁移和侵袭[18]。此外,ITGβ1的高表达和p53的低表达是非小细胞肺癌的不良预后因素[18]。整合素α9(ITGα9)在多种肿瘤中表达发生改变,它高表达于肺癌,特别是小细胞肺癌,可能是预后不良的指标[19]。在结肠癌细胞中,整合素α9β1通过非受体酪氨酸激酶(Src)活化诱导型-氧化氮合成酶(inducible nitric oxide synthase,iNOS)促进细胞迁移,且机制中不涉及FAK、Erk和Racl的活化[20]。整合素α9胞质结构域对整合素α9β1诱导的Src活化以及后续的信号传导和细胞迁移至关重要[21]。此外,整合素α9β1可以通过有效加强肿瘤上皮-间质的细胞转化功能来促进恶性肿瘤的生长发育和细胞转移。氧化二甲基查尔酮c可以有效阻止A375细胞的恶性增殖、迁移和细胞入侵,可能与抑制整合素β1的磷酸化、阻断ERK通路相关[22]。另外,在恶性肿瘤的生长、侵袭和转移中血管生成发挥着重要的作用,而整合素参与调节着血管的生成。例如血管内皮细胞生长因子(VEGF)被确定为肿瘤血管生长中的核心因子,当整合素分子和配体相结合后,可通过介导血管内皮细胞的迁移和黏附,促进新生血管成熟和稳定[23]。整合素α5β1在转移的前列腺癌细胞中高度表达,且与动脉血管内皮生长因子和动脉血管内皮生长因子受体呈负相关,说明整合素α5β1与动脉血管生成及转移密切有关[24]。
综上所述,本研究通过转录组测序联合生物信息学的方法发现了NSUN2在肺癌细胞中调控的DECs,并且进一步分析了鉴定的DEGs在肺癌细胞中可能参与的生物学过程及相关通路。其中整合素β1信号通路和整合素α9β1信号通路富集较为显著,因此,我们将在下一步的研究中着重关注整合素信号通路影响非小细胞肺癌的发生发展过程,为揭示NSUN2在肺癌发生发展中的生物学作用和相关分子机制奠定基础。
