天山北麓典型水库细菌多样性分析
2022-04-25常娜娜阿木提喀日马木提地丽胡玛阿吉马正海
常娜娜,张 政,阿木提喀日·马木提,杜 菲,地丽胡玛.阿吉,马正海
新疆大学生命与科学技术学院,新疆生物资源基因工程重点实验室, 乌鲁木齐 830046
天山北麓为冰雪消融及降雨汇集的山溪河流在天山北坡形成的淤积平原,具独特的山地-绿洲-荒漠生态系统。解放后人们利用该区域内天然形成的湖泊或洼地为库址修建了大量的平原水库和渠道,形成了规模巨大的水库湿地群,促使农垦事业迅速发展,该区域已成为新疆最大的绿洲农耕区,是国家粮、棉、糖、轻纺工业、能源等产业的重要基地和新疆重点发展地区。其中天山北麓中段位于准噶尔盆地南缘,东起乌鲁木齐市,西至乌苏市,南起前山带,北至库尔班通古特沙漠边缘,地形总体由南东向北西倾斜,冰雪消融和降水补给形成乌鲁木齐河、玛纳斯河等河流,横越其间的兰新铁路和连霍高速公路西段是亚欧大陆桥的重要区段和新疆“东联西出”的重要通道,天山北麓中段也是新疆工农业最发达和人口最集中的地区[1—3]。
天山北麓是干旱区山地生态系统和荒漠生态系统的交界地带,是自然环境的敏感区域,其中尤以平原生态系统中水库等湿地最为明显,其稳定性和抗干扰性极差[4],生物多样性受自然条件和人类活动双重影响而变的极为复杂。本研究选取天山北麓中段东端位于乌鲁木齐市和五家渠市附近的八一水库(BYW)、西端位于奎屯市附近的奎屯/车排子水库(KCW)以及中部位于石河子市附近的蘑菇湖水库(MGW)和位于新安镇附近的安集海水库(AJW)为典型样点(图1),以宏基因组学方法分析水库细菌群落的组成特征及其功能,探讨环境因素和人类活动对水库细菌多样性的影响,以期为该区域水库湿地的生态保护和合理化利用提供参考依据。
图1 采样水库的地理分布
1 材料与方法
1.1 研究样点概述
MGW(44°29′N、85°57′E)位于石河子市西北18km处,是玛纳斯河流域库容最大的水库,承担灌溉、养殖、调洪蓄水和纳污等功能,水库正常蓄水位为392m,库容1.8亿m3[3]。
KCW(44°49′N、85°15′E)由相邻的两个水库组成,奎屯水库位于奎屯市以北约60km,古尔班通古特沙漠西面的一座拦河水库,以灌溉为主,兼有防洪和渔业养殖等功能,水库正常蓄水位为3l6.9m,库容5000万m3;车排子水库在奎屯水库北侧5km处,由奎屯水库西泄水闸的引水渠进水,库容4000万m3[5]。
AJW(44°35′N、85°48′E)位于塔城地区沙湾县安集海镇和新安镇附近,主要引蓄巴音沟河和金沟河冬季闲水,以灌溉为主,兼有防洪功能,水库正常蓄水位为462.8m,库容4800万m3[3]。
BYW (44°17′N、87°53′E)属于乌鲁木齐河流域,南侧及西侧紧靠乌鲁木齐市米东区羊毛工镇,东侧为甘莫公路,北靠新疆生产建设兵团102团团部,距五家渠市24km,主要承担农业灌溉任务,正常蓄水位为462 m,库容3000万m3[6]。
1.2 样品采集
于2017年10月秋季枯水期末期采集BYW、MGW、AJW和KCW表层水样,采水器和容器均经消毒灭菌,每个水库根据水域结构选6个采样点,采样点间隔500m以上,每点采样500mL,之后混合为3L水样,其中奎屯水库和车排子水库各选3个采样点,采样后合并为一份水样。样品于-20℃便携式冰箱保存,于当天运回实验室,储存于-80℃冰箱备用。
1.3 水库水样中细菌的收集
冻存水样于冰水浴中融化后,三层灭菌纱布过滤除去颗粒杂质,300rpm离心10min除去细小颗粒杂质,最后10000×g离心30min,收集的细菌沉淀于-80℃保存。样品送北京诺禾致源科技股份有限公司进行细菌宏基因组高通量测序。
1.4 细菌DNA的提取及PCR扩增
细菌沉淀经CTAB法提取总DNA,琼脂糖凝胶电泳和Qubit2.0荧光定量仪检测DNA的纯度和浓度,DNA稀释至1ng/μL。以此DNA为模板,使用带Barcode的16SrDNA V3—V4区引物341F(CTAYGGGRBGCASCAG)和805R(GGACTACNNGGGTATCTAAT)进行PCR扩增,琼脂糖凝胶电泳后切胶回收PCR产物。
1.5 文库构建和上机测序
使用Thermofisher 公司的Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit 2.0荧光定量仪定量和文库检测合格后,使用Illumina MiSeq测序平台测序。
1.6 宏基因组数据分析
使用Uparser软件(Uparse v7.0.1001,http://drive5.com/uparse/)进行操作分类单元(operational taxonomic units,OTUs)聚类,按照97%的序列相似性得到 OTUs 代表序列,筛选每个OTU的代表序列进行不同分类水平上的物种注释。利用 Muthur软件进行α多样性指数(Shannon,Simpson,Chao1,Ace)计算及聚类分析,绘制稀释曲线以评价测序所获水样菌群种类的覆盖度以及细菌的多样性。使用 Unweighted Unifrac算法计算样本间距离,获得的距离矩阵用于β多样性分析,以探讨4个水库水样菌群组成的相关性。为了探究天山北麓中段4个水库菌群的代谢功能,利用PICRUSt(Phylogenetic Investigation of Communities by Reconstruction of Unobserved States)软件和KEGG数据库预测宏基因组测序数据的功能基因组成。用R语言工具和Excel软件绘制相关图表。
2 结果与分析
2.1 水库细菌OTU及α多样性分析
测序数据经过质量控制后,共计得到316686条有效序列,以97%的序列一致性将序列共聚类成431个OTUs。由稀释性曲线可知,随测序数量增加OTU数量趋于平缓(图2),表明测序深度能够覆盖水样中所有菌群并满足分析要求,且AJW的细菌种类较为丰富。4个水库比较而言,AJW获得的OTUs数量(337个)以及Shannon和Chao1指数(5.23和325.7)均明显高于另3个水库,且KCW、BYW和MGW的OTU数量和α多样性指数均接近。以上结果表明,AJW细菌群落的丰度和多样性均高于另3个水库(表1)。
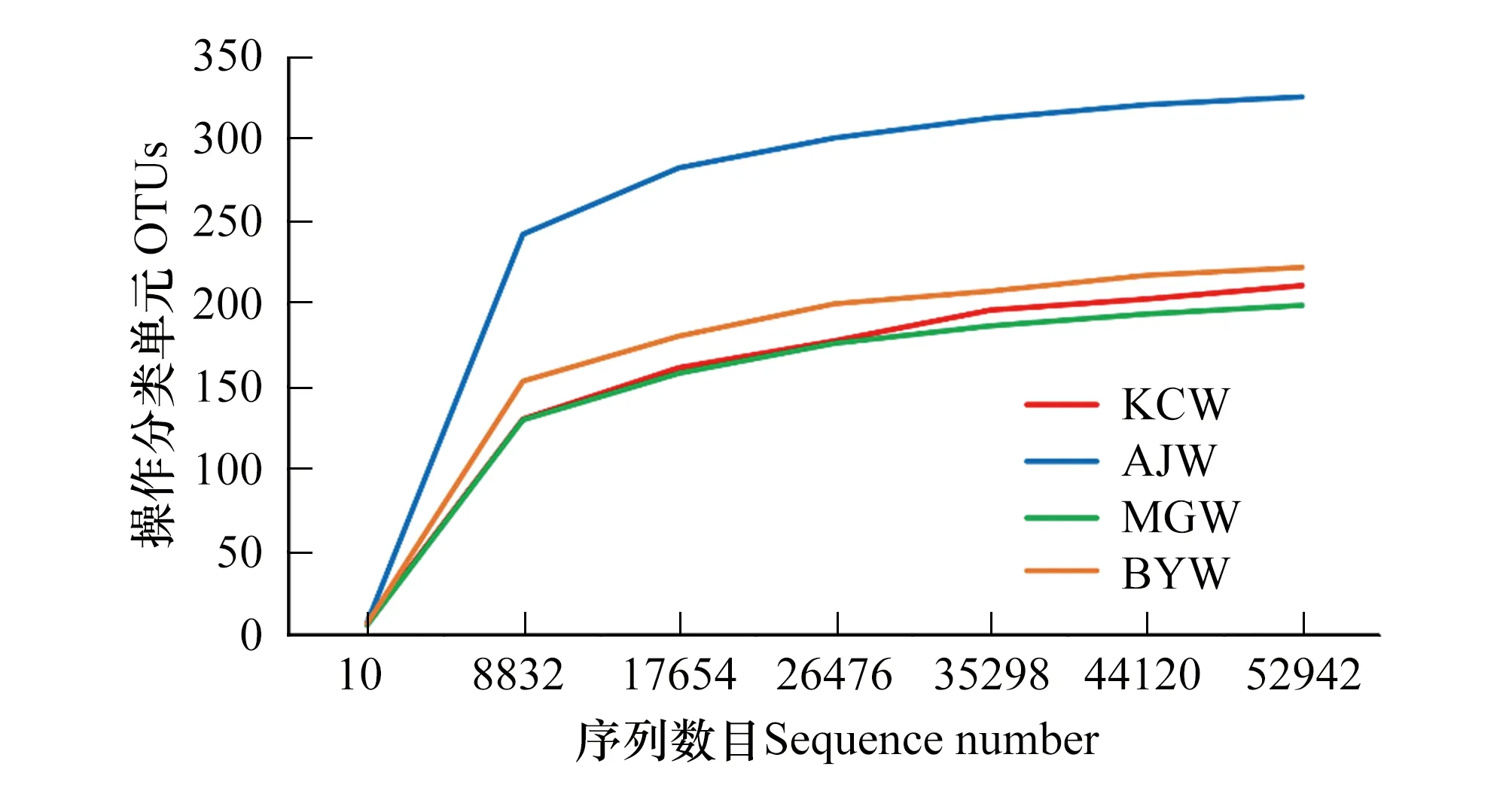
图2 稀释曲线
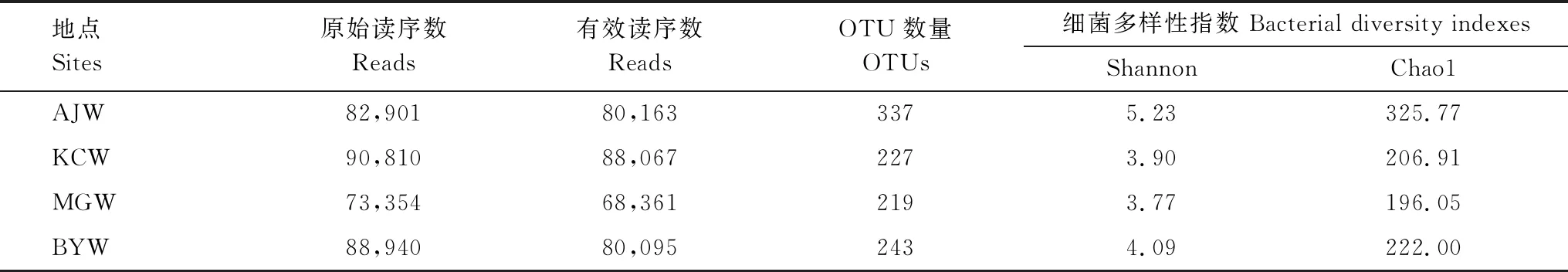
表1 水库水样菌群α多样性指数
2.2 水库细菌β多样性分析
以Unweighted Unifrac距离矩阵分析样品间的相异系数,结果表明,AJW与BYW、MGW以及KCW的相异系数分别为0.520、0.589和0.502,而另3个水库之间的相异系数在0.363—0.386之间,说明在菌群组成方面,KCW、BYW和MGW间相似,而AJW和其他水库间的差异较大(图3)。
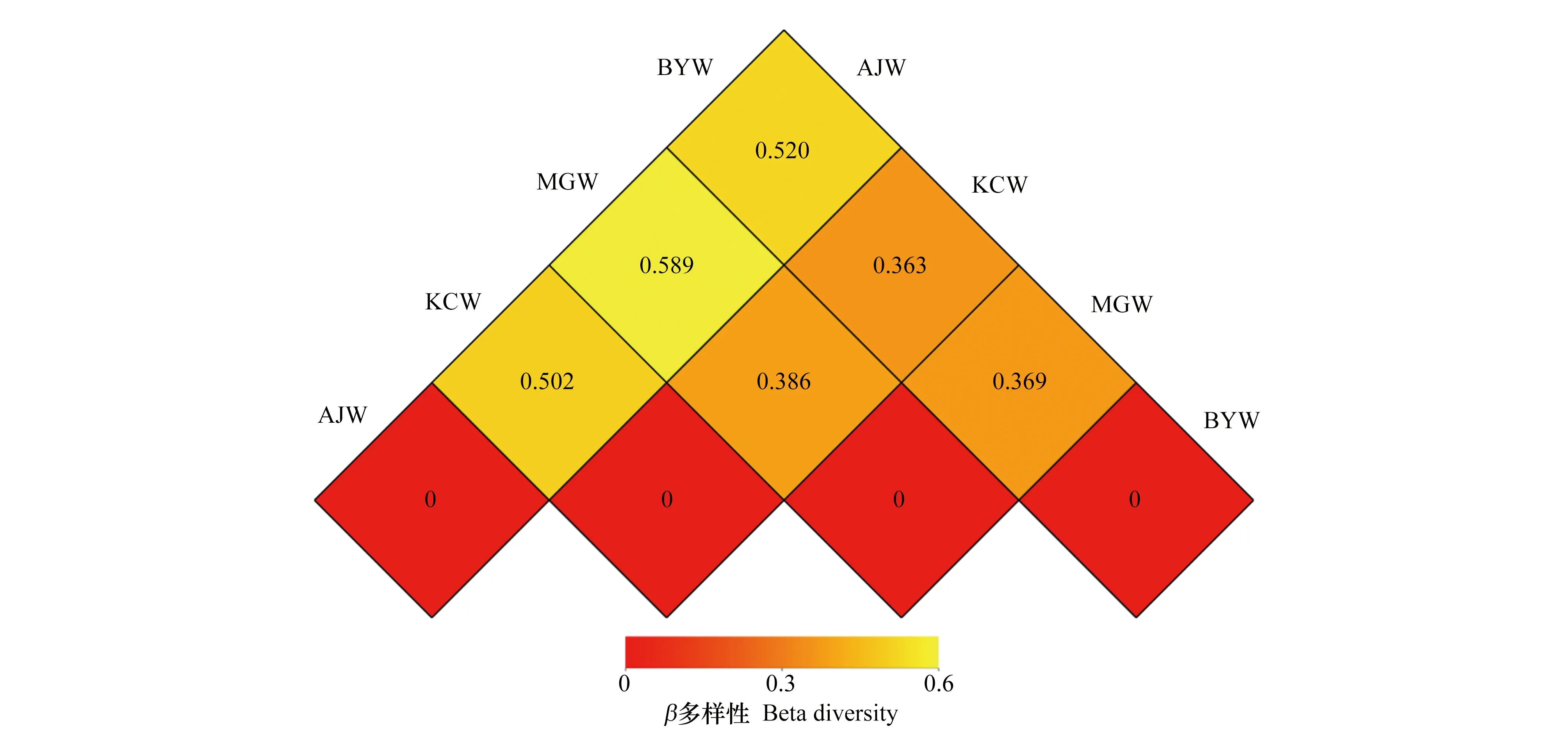
图3 水库水样菌群距离矩阵热图
2.3 水库菌群组成分析
4个水库在细菌门分类水平上共鉴定出18个菌门(图4),其相对丰度在不同水库间存在差异。变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)在4个水库中的丰度均为最高,变形杆菌的相对丰度在21.29%—43.79%之间,拟杆菌门的相对丰度在28.28%—77.63%之间。另外,厚壁菌门在AJW和MGW的相对丰度分别达到24.46%和27.61%,放线菌门(Actinobacteria)在AJW中的相对丰度为11.36%。鉴定出的菌门还包括蓝藻细菌门(Cyanobacteria)、疣微菌门(Verrucomicrobia)、装甲菌门(Armatimonadetes)、浮霉菌门(Planctomycetes)、梭杆菌门(Fusobacteria)、绿弯菌门(Chloroflexi)等。
在细菌纲分类水平上,4个水库共鉴定出38个菌纲,相对丰度前10的菌纲如图4所示,大多隶属拟杆菌门、变形菌门和厚壁菌门,其中拟杆菌门中的黄杆菌纲(Flavobacteriia)在4个水库均为优势菌,相对丰度在32.16%—77.34%之间。变形菌门下属菌纲在不同水库中的相对丰度差异较大,γ-变形菌纲(Gammaproteobacteria)的相对丰度在MGW和BYW中较高,分别达到41.68%和25.94%,α-变形菌纲(Alphaproteobacteria)和β-变形菌纲(Betaproteobacteria)分别于AJW和KCW中具有较高丰度,分别为15.32%和15.24%。芽孢杆菌纲(Bacilli)在AJW和MGW中具有较高丰度,分别达到24.46%和27.61%。相对丰度前10的菌纲还包括酸微杆菌纲(Acidimicrobiia)、纤维粘网菌(Cytophagia)、叶绿体纲(Chloroplast)以及未鉴定的放线菌(Actinobacteria)和蓝细菌(Cyanobacteria),其主要存在于AJW。
在细菌属分类水平上,4个水库共鉴定出181个菌属,其中AJW的细菌种类(146个菌属)明显多于另3个水库。图4显示了相对丰度前10的菌属,黄杆菌属(Flavobacterium)在4个水库均为优势菌,相对丰度在27.66%—77.32%之间。除黄杆菌属外,各水库的菌群组成存在较大差异,相对丰度较高的包括AJW的动性杆菌属(Planomicrobium)、KCW的马赛菌属(Massilia)、MGW的不动杆菌属(Acinetobacter)和动性杆菌属以及BYW的假单胞菌属(Pseudomonas)和嗜冷杆菌属(Psychrobacter)。相对丰度前10的菌属还包括主要存在于AJW的CL500- 29_marine_group、根瘤菌属(Rhizobium)和微小杆菌属(Exiguobacterium)以及主要存在于BYW的类芽孢八叠球菌属(Paenisporosarcina)。
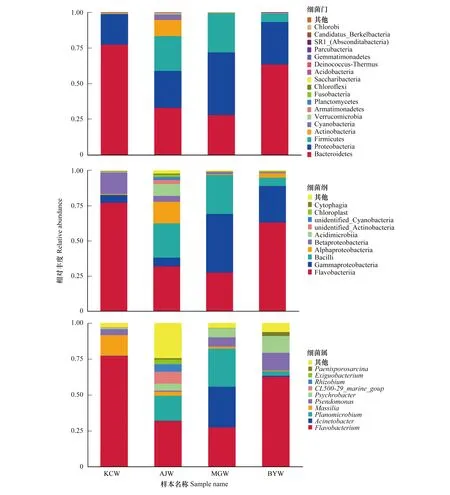
图4 水库水样菌群组成
2.4 预测功能的多样性
利用PICRUSt软件和KEGG数据库注释水库菌群的功能。功能基因通路分析表明(图5),4个水库菌群代谢功能相关基因的相对丰富最高,均达到50%左右,另外遗传信息处理、信号传递和细胞生长相关的功能基因亦较丰富,说明水库菌群生长旺盛。次生代谢功能基因分析表明(图5),4个水库菌群氨基酸代谢(21.28%—22.47%)、碳水化合物代谢(17.82%—19.92%)和能量代谢(10.75%—11.66%)相关基因的相对丰富较高,其次为辅酶因子与维生素代谢(8.16%—8.65%)、脂质代谢(7.42%—8.46%)和核苷酸代谢(6.61%—7.05%)相关基因,同样说明水库菌群生长旺盛。另外,4个水库菌群中环境异生物降解代谢(xenobiotic biodegradation and metabolism)相关基因的相对丰度在6.09%—7.86%之间,环境异生物降解功能基因的细分注释和分析表明(图5),4个水库菌群苯甲酸(15.6%—18.12%)、氨基苯甲酸酯(10.98%—12.54%)、氯烷烃和氯烯烃(8.29%—9.36%)、萘(7.78%—8.18%)降解相关基因的相对丰度均较高,此外,还含有硝基甲苯、二恶英、乙苯、二甲苯、莠去津、苯乙烯、多环芳烃、对氟苯甲酸乙酯等降解相关的基因(图5)。

图5 基于KEGG分析的功能基因分类及丰度
3 讨论
水体中微生物群落结构特征会随着富营养程度和污染水平等多种环境因素的变化而变化,同时,水环境中微生物群落组成和多样性亦能反映水质状况,可作为水环境生态质量的评价指标[7—8].本文基于宏基因组学方法分析天山北麓4个水库细菌的多样性,选取的4个水库均受到农牧渔业以及工业等人类活动干扰,且干扰因素和干扰程度存在一定差异,其中AJW位于安集海镇附近,主要功能是灌溉和调洪蓄水;BYW临近乌鲁木齐市城郊,周边交通网密集,零散有工业区,并接纳了部分污水;MGW位于石河子市附近,承担灌溉、养殖和调洪蓄水功能之外还接纳了石河子地区的工业和生活污水;KCW位于奎屯市附近,灌溉和调洪蓄水的同时还大力发展渔业,且紧邻大面积的棉田。研究结果表明4个水库菌群结构存在差异,其中AJW菌群的多样性和丰度高于另3个水库,以上差异主要是由于水库周边环境和人类活动干扰等因素的差异所致。
在门分类阶元上,变形杆菌和拟杆菌门在4个水库的丰度最高,这两个菌门均广泛栖息于土壤和水环境中,前期亦有报道其在多种水环境中含量较高,具有富集酸性氨基酸、水解纤维素和有机化合物矿化等功能[9—10]。同时,研究也发现各菌门在4个水库中的相对丰度存在差异,拟杆菌门在KCW和BYW中的相对丰度较高,变形杆菌在MGW的相对丰度较高,厚壁菌门在AJW和MGW中的相对丰度较高,放线菌门在AJW的丰度较高,以上差异可能与各水库水质、纤维素等碳水化合物含量以及受周边农牧业、工业和居住人群影响等因素有关,如高丰度的变形杆菌和拟杆菌与水环境中蛋白质等有机质含量呈正相关,渔业和排污均可导致水库中有机质含量的增加,同时,变形杆菌和拟杆菌亦可降解和转化水环境中的有机质,从而维持和改善水质。
从纲分类阶元,拟杆菌门中的黄杆菌纲在4个水库均为优势菌,据报道该菌是多种水环境中的优势菌群[11—13]。变形菌门中的β-变形菌纲类群是河流、湖泊和水库等淡水环境的重要组成部分[14]。本研究中变形菌门下属菌纲在不同水库中的相对丰度差异较大,β-变形菌纲在KCW中的相对丰度较高,为15.24%,而在其余3个水库中的相对丰度很低,仅为0.69%—4.13%;α-变形杆菌纲在AJW中的相对丰度较高,为15.32%;γ-变形菌纲的相对丰度在MGW和BYW分别达到41.68%和25.94%,远高于另两个水库。γ-变形菌在污染的水和土壤中相对含量较高[16—18],并包括一些重要的病原菌属,根据Zwart等人的研究,γ-变形菌纲是水环境浮游细菌的短暂成员,由周围环境带来,常常是最适应污染环境的菌株[19]。以上变形菌纲的含量差异说明各水库水质和受污染程度的不同,其中MGW和BYW水质较差。另外,变形菌纲菌群数量与水环境的温度相关[20—21],本研究于10月中下旬秋末采样,水温较低也会导致α和β变形菌纲菌群丰度下降。另外,酸微杆菌纲、叶绿体纲、放线菌纲和蓝细菌在安集海水库中的相对丰度都明显高于另3个水库,说明AJW细菌多样性更为丰富,同时,放线菌纲、酸微杆菌纲和叶绿体纲细菌还具有重要的生态功能[22—23],在维持水体的水质状况中发挥重要作用。
在属分类阶元上,黄杆菌属在4个水库均为优势菌,该菌属在自然界各类环境中的分布极为广泛,在水环境中具有重要的功能[13,15,24]。从图4C所示的菌属丰度来看,高丰度菌属在4个水库中的含量同样差异较大,不动杆菌和假单胞菌同属γ-变形菌纲,其在富营养水体中的含量较高[19],本研究中两者分别于MGW和BYW中具有较高的丰度;而属于β变形菌纲的马赛菌属在KCW的丰度较高,据报道马赛菌的含量在氮、磷浓度较高的环境中会增加[25],KCW发展渔业以及紧邻大面积棉田都可能增加水体中的氮、磷浓度,并导致马赛菌属含量增加。动性杆菌属在AJW和MGW中的相对丰度较高,据报道该菌具嗜盐性,在稀土-重金属复合污染土壤中的丰度明显增高。嗜冷杆菌在BYW、MGW和AJW的相对丰度分别为11.59%、6.24%和4.76%,该菌多于低温环境中生长,曾从南极和北极海冰等寒冷环境中分离到[26—28],推测水库中较高丰度的嗜冷杆菌可能源于天山冰雪中的细菌,并随冰雪融化注入水库,另外,本研究于秋末采样,低水温也将促使该菌相对丰度的增加。CL500- 29_marine_group和微小杆菌属在AJW的相对丰度较高,据报道CL500- 29_marine_group与溶解氧等水质指标呈正相关[29—30],微小杆菌属存在于多种极端环境,并参与环境污染的生物修复[31—32],两者均有利于水质和菌群多样性的维持。
功能基因通路分析和次生代谢功能基因分析的结果显示,与细菌生长相关的各类代谢以及遗传信息处理、信号传递和细胞生长等功能基因丰度均较高,说明水库中细菌生长旺盛。环境异生物降解功能基因分析的结果显示,苯甲酸、氨基苯甲酸酯、氯烷烃和氯烯烃、萘降解代谢相关功能基因在4个水库菌群中的相对丰度均较高,另外还含有多种芳香族化合物降解代谢的相关功能基因,各水库菌群降解环境异生物的种类亦有差异,芳香族化合物(包括苯甲酸、萘、乙苯、对氟苯甲酸乙酯)降解相关功能基因在MGW的相对丰度较高,有机氯化合物(包括氯代烷烃和氯代烯烃、环氯己烷及氯苯)降解相关功能基因在KCW的相对丰度较高。由于细菌对环境异生物具有趋化性,即细菌感应、趋向(或趋离)并降解环境污染物的特性[33—34],故环境污染物含量和菌群降解污染物功能基因的含量呈正相关,就本研究而言,水库菌群含有芳香族和有机氯等化合物降解相关基因,说明水库可能存在相应污染。据文献报道,假单胞菌属、放线菌、分枝杆菌属、微球菌属、棒状杆菌属、弧菌属、黄杆菌属、芽孢杆菌属、不动杆菌属等细菌均能降解污染有机物[35—37],本研究显示假单胞菌属、黄杆菌属和不动杆菌属以及芽孢杆菌纲为水库的优势菌或丰度较高的菌群,这些菌群具有趋向和降解污染物的功能,可能在水库污染物的生物修复中发挥作用。
4 结论
天山北麓中段4个水库菌群组成有一定的共性,在门分类阶元上优势菌为变形菌门和拟杆菌门,在纲分类阶元上优势菌为黄杆菌纲,在属分类阶元上优势菌为黄杆菌属。同时,各水库菌群组成存在较大差异,在变形菌门中,γ-变形菌纲的相对丰度在MGW和BYW较高,α-变形菌纲和β-变形菌纲分别于AJW和KCW具有较高丰度;芽孢杆菌纲在AJW和MGW具有较高丰度,AJW含有利于维持水质和菌群多样性的放线菌纲、酸微杆菌纲和叶绿体纲以及微小杆菌属和CL500- 29_marine_group。以上菌群的结构特征与水库水源、周边环境和人类活动等因素相关。菌群功能基因分析显示水库菌群含有芳香族和有机氯等化合物降解相关基因,其可能在污染物的降解和生物修复中发挥作用。
