与己醛具有群体感应协同抑制效应的精油成分组合筛选研究
2022-04-25谢云飞杨方威姚卫蓉
刘 宇, 于 航, 谢云飞, 杨方威, 姚卫蓉
(江南大学 食品学院, 江苏 无锡 214122)
蔬菜腐败主要是由腐败细菌定殖造成的,胡萝卜软腐欧氏杆菌(Erwiniacarotovora)是一种典型的革兰氏阴性腐败菌[1],也是引起蔬菜变质的主要细菌之一[2]。胡萝卜软腐欧氏杆菌造成食品腐败变质的主要原因是生物被膜的形成和其他毒力因子的分泌,如胞外多糖、胞外蛋白酶、纤溶酶等[3],这些毒力因子主要受细菌群体感应(quorum sensing,QS)的细胞信号机制调控[4]。QS系统可以调节特定靶点基因的表达,控制多种生理过程,是细菌引起的食品腐败的主要因素。针对细菌的QS调控机制,人们开始寻找有效的QS抑制剂(quorum sensing inhibitors,QSI)[5]。
天然植物精油来源广泛且安全、无毒,随着植物精油提取技术的日渐成熟,越来越多植物精油被用于食品工业作为调味剂[6]和抗菌剂[7]。近年来,将精油成分应用于QSI的相关研究也越来越多,如亚最小抑菌浓度(minimal inhibitory concentration,MIC)的精油成分姜油酮具有显著抑制铜绿假单胞菌QS的作用,在浓度较低的情况下即可有效降低其致病性因子的形成[8-9];亚MIC浓度的精油成分百里酚也被证实能抑制荧光假单胞菌生物被膜的形成,以及细菌胞外多糖(extracellular polysaccharide,EPS)、海藻酸钠等一些毒力因子的释放[10]。与此同时,人们还发现,部分精油成分之间存在协同抑菌效果,如水杨酸与百里酚联用时,对番茄枯萎病菌的生长有显著的抑制作用,联合作用时MIC明显低于单独使用[11]。目前,将具有协同效应的精油成分组合应用于抑制腐败菌QS的研究仍属探索阶段,只有少量研究将精油成分与其他抗菌物质同时作用于QS,如精油成分芳樟醇与脱氧核糖核酸酶I(可水解胞外DNA)联用,能有效提高精油成分抑制副溶血弧菌生物被膜的活性[12]。因此如果能筛选出对腐败菌QS现象具有协同抑制作用的精油成分组合,将意味着能进一步降低单体精油成分的使用量,并在较低的浓度下即可抑制腐败菌的腐败特性,从而达到延长食品贮藏期的目的,这将很大程度提高精油成分作为保鲜剂的安全性和降低精油使用成本。
己醛在食品工业中可作为食品增香剂,在前期的研究中已经证明己醛能显著抑制胡萝卜软腐欧氏杆菌的运动性、EPS的分泌和生物被膜的形成[13-14]。在实际使用时,因为己醛的气味较为浓厚,将其用做保鲜剂可能会对食品风味造成一定干扰,因此本研究拟基于胡萝卜软腐欧氏杆菌的MIC和分级抑菌浓度(fractional inhibitory concentration,FIC)指数,从9种精油成分中筛选出与己醛具有协同抑菌效应的精油成分组合,将其组合应用于抑制胡萝卜软腐欧氏杆菌的QS调控,并将能判别两种物质是否具有协同作用的金(正均)氏公式[15]用于判别群体感应的协同抑制作用,以期科学地筛选出对胡萝卜软腐欧氏杆菌既有协同抑菌作用又有协同抑制QS效应的精油成分组合。本研究旨在为将精油作为食品工业抗菌剂的实际应用中降低复配精油成分使用量提供理论依据。
1 材料与方法
1.1 菌株和材料
纯度均大于95%的精油有效成分(己醛、香芹酮、香芹酚、柠檬醛、香叶醇、水杨酸、肉桂酸、百里酚、丁香酚和肉桂醛),购于上海百灵威化学技术有限公司;营养肉汤培养基、氯化钠、无水乙醇、甘油乙酸、乙酸钠、卡那霉素、结晶紫和Tris- HCl缓冲液,均购于上海国药集团化学试剂有限公司;无菌96孔微量培养板、无菌12孔微量培养板,购于美国Thermo Fisher Scientific公司;C6- HSL、Syto9染料和质量分数为2.5%的戊二醛溶液,购于Sigma Aldrich公司(美国密苏里州圣路易斯)。实验所用化学试剂均为分析纯。细胞爬片购于无锡耐思生物科技有限公司。胡萝卜软腐欧氏杆菌购买于中国普通微生物菌种保藏中心(CGMCC)。紫色杆菌CV026来自渤海大学励建荣教授课题组,菌株在-80 ℃储存在质量分数为30%甘油营养肉汤中。紫色杆菌CV026在含20 μg/mL卡那霉素的LB培养基中生长,胡萝卜软腐欧氏杆菌通常在营养肉汤中生长,两种菌株均在28 ℃培养,培养基的pH值为7.0。
1.2 仪器与设备
PHS- 3C型pH计,上海精密科学仪器有限公司;DHG- 9075A型电热恒温鼓风烘箱,苏州纳美瑞电子科技有限公司;BSA224S型电子分析天平,德国Sartorius仪器公司;Sorvall ST16R型冷冻高速离心机,美国Thermo Fisher Scientific公司;SU8100型扫描电子显微镜,日本株式会社日立高新技术公司;LSM710型激光共聚焦显微镜,德国蔡司公司;UV- 1800型紫外可见光分光光度计,日本岛津公司;BPC- 500F型生化培养箱,上海一恒科学仪器有限公司。GI54DW型立式自动压力蒸汽灭菌器,厦门致微仪器有限公司;M5型酶标仪,美国Molecular Devices公司。
1.3 QS抑制实验
1.3.1MICs的测定
按照参考文献[16],将胡萝卜软腐欧氏杆菌在28 ℃下的琼脂平板上生长过夜,参照0.5号麦氏比浊管将刮落的细菌在质量分数为0.85%的NaCl溶液中稀释至106CFU/mL用于测定。使用96孔微量培养板进行MIC的测试。在每一孔中加入100 μL培养基后,分别取100 μL单体精油成分和复配精油成分加至第一孔中,随后在培养基中进行连续2倍稀释。将100 μL细菌接种物加入所有孔中,并将平板在28 ℃培养24 h后使用酶标仪在OD600检测细菌活性。每种精油成分做3个平行实验,在同一块板上做一组阴性对照实验(以体积分数为50%的乙醇为阴性对照)。最后的结果以FIC指数作为联合抗菌试验的判定依据。FIC的计算公式见式(1)。
(1)
当FIC≤0.5,表示协同作用;0.5
1.3.2紫色杆菌素抑制率的测定
紫色杆菌素抑制实验参照文献[17]的方法。将菌株CV026过夜活化两次后,按1%的体积分数接种于含有质量浓度为20 μg/mL的卡那霉素的新鲜LB肉汤中,振荡培养24 h后取1 mL菌液与100 mL含有20 μg/mL C6- HSL(信号分子)的LB营养琼脂培养基混合,倒平板,待凝固后使用无菌软木塞钻孔器在琼脂中钻孔(直径4 mm)。将100 μL不同浓度的单体精油成分和复配精油成分分别加到琼脂孔中,其中复配精油成分浓度为0.5 MIC,单体精油成分浓度为各复配体系中单体精油成分的浓度。以质量浓度为50 μg/mL的呋喃酮C30[18](一种已知的QSI)为阳性对照,使用体积分数为50%的乙醇作为阴性对照。
根据参考文献[19],将菌株CV026过夜活化后,按体积分数为1%接种于含有不同精油成分(0.5 MIC)的LB培养基中,并加入20 μg/mL C6- HSL,160 r/min、28 ℃振荡培养24 h。以50 μg/mL的呋喃酮C30为阳性对照,使用体积分数为50%的乙醇作为阴性对照。将来自每孔的1 mL培养物以13 000 r/min离心5 min沉淀紫色菌素。通过旋涡振荡器使沉淀的紫色菌素完全溶解在0.5 mL的DMSO中。将混合物再次离心以除去细菌细胞,使用酶标仪在OD585定量。菌株的紫色菌素抑制率计算公式见式(2)。

(2)
1.3.3游泳和群集运动抑制率的测定
游泳和群集运动实验参照文献[20]的方法。将各菌株复配精油成分与冷却至40 ℃的游泳运动琼脂培养基(琼脂质量分数为0.3%)和群集运动的琼脂培养基(琼脂质量分数为0.5%)混匀,倒平板,使平板中复配精油成分的浓度为目的终剂量(0.5 MIC)。冷却后,向平板中央接种5 μL过夜活化两次的胡萝卜软腐欧氏杆菌菌液,28 ℃恒温培养48 h,观察测试菌的迁移情况。以体积分数为50%的乙醇溶液为阴性对照。菌株运动性抑制率计算公式见式(3)。

(3)
1.3.4胞外多糖抑制率的测定
按照参考文献[21]的方法测定细菌产生的胞外多糖(EPS)。将过夜活化后的胡萝卜软腐欧氏杆菌分别与新鲜的LB培养液按1%的体积分数混匀后,取5 mL分装至无菌的6孔板中。在孔板中加入终剂量为0.5 MIC的精油成分,以体积分数为50%的乙醇溶液为阴性对照。培养后,将取3 mL培养液以5 000 r/min离心30 min。将经过滤的上清液(0.22 μm)加入3倍体积的乙醇中,并在4 ℃下孵育过夜沉淀。在4 ℃下以5 000 r/min离心30 min收集沉淀中的EPS,并将沉淀溶解在1 mL去离子水中,并在-20 ℃下储存直至进一步使用。EPS中的总碳水化合物含量通过使用葡萄糖作为标准的苯酚- 硫酸法来量化。
1.3.5生物被膜形成抑制率的测定
按照参考文献[22],将过夜活化后的胡萝卜软腐欧氏杆菌分别与新鲜的LB培养液按1%混匀,取2 mL分装至无菌的12孔板中。在孔板中加入终剂量为0.5 MIC的精油成分,以体积分数为50%的乙醇溶液为阴性对照,28 ℃静置培养24 h,测定其菌液密度后,弃去培养液。用双蒸水仔细冲洗孔以除去松散附着的细胞,无菌风干燥固定30 min,随后加入300 μL 0.2%结晶紫溶液染色壁上黏附的细胞15 min(室温下),用冲洗去除多余的染色剂,最后用1 mL质量分数为33%的冰醋酸溶液洗脱,使用酶标仪(Biotek)在OD595测量强度,以定量生物被膜形成量。生物被膜形成抑制率计算公式见式(4)。

(4)
1.3.6生物被膜观察
按照参考文献[23]的方法,用激光共聚焦显微镜(confocal laser scanning microscop, CLSM)和扫描电子显微镜(scanning electron microscope, SEM)对细菌生物被膜进行观察。将1%的过夜培养物与终浓度为0.5 MIC的精油成分一起加入含有直径18 mm的细胞爬片的新鲜培养基中,28 ℃培养24 h。以体积分数为50%的乙醇溶液为阴性对照。
1) CLSM分析。将细胞爬片上的浮游细胞用PBS漂洗除去后用25 μmol/L的Syto9染色,室温下避光染色15 min,用PBS冲洗后吸干,随后通过CLSM观察染色的生物被膜,并利用COMSTAT 2程序对生物被膜的三维结构(生物量、平均厚度、表面积与体积比)进行量化。
2) SEM分析。将细胞爬片上浮游细胞用PBS漂洗除去,放入经4 ℃预冷过的质量分数为2.5%的戊二醛溶液中浸泡4 h,取出后,用梯度浓度的乙醇脱水,自然干燥后喷金处理,用SEM观察生物被膜。
1.4 精油成分联合效应的计算
通过金式Q值法[15],判别精油成分的联合作用是否具有协同效应,计算方法如式(5)。
(5)
式(5)中,EA、EB为单独作用效果,EA+B为A和B联用联合作用效果,其中A、B单独使用的浓度等于联用时A和B各自的浓度。Q<0.85为拮抗作用,0.85≤Q<1.15为相加作用,Q≥1.15为协同作用。
1.5 数据处理
所有数据以3次平行实验测定数据的平均值±标准偏差(SD)表示。使用SPSS软件进行方差分析,使用Tukey检验进行95%显著性差异分析。
2 结果与分析
2.1 精油成分的最小抑菌浓度分析
表1显示了己醛联合其他9种精油成分(香芹酮、香芹酚、柠檬醛、香叶醇、水杨酸、肉桂醛、百里酚、丁香酚和肉桂酸)对胡萝卜软腐欧氏杆菌的MIC,复配成分中两种精油成分的质量浓度比为1∶1。己醛和百里酚联合作用时的MIC值最小,均只有0.08 mg/mL。根据精油成分单独作用和联合作用的MIC得到了FIC指数,发现己醛分别与丁香酚、香叶醇、百里酚和肉桂酸这4种成分组合对胡萝卜软腐欧氏杆菌的生长存在协同抑制作用(FIC≤0.5),其他的组合则是相加和无关作用。具有协同抑制作用的精油成分的MIC,复配使用时可以明显降低有效浓度(降低4~8倍),如己醛和香叶醇联合作用的MIC对应的己醛浓度只有单独作用时的1/4,而其中香叶醇的使用浓度更是其单体MIC的1/8(表1)。
目前未见研究表明协同抑菌作用与协同抑制群体感应具有相关性,本研究将进一步探索具有协同抑菌作用的复配组合是否具有抑制QS活性。因此选取4组浓度为0.5MIC具有协同抑菌效应的精油成分组合(己醛和香叶醇、己醛和百里酚、己醛和丁香酚、己醛和肉桂酸)用于后续CV026的QS抑制实验,筛选与己醛具有协同抑制群体感应的复配组合。
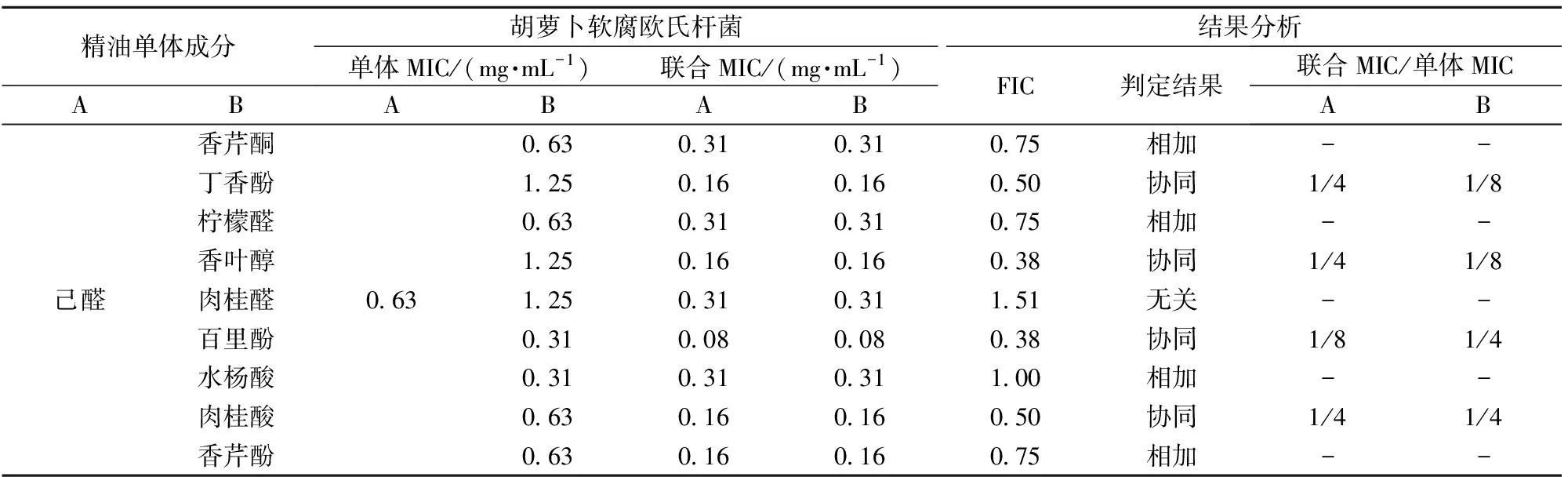
表1 精油成分单独和联合MIC及协同抑菌效应组合的筛选Tab.1 Individual and combined MIC of essential oil components and screening of synergistic antibacterial effect combination
2.2 精油成分对CV026产紫色菌素的群体感应抑制作用
细菌模型紫色杆菌CV026被广泛应用于QSI的筛选中[24]。本研究通过CV026产紫色菌素的抑制率来评价各单体精油成分以及组合精油成分的QSI活性(见图1)。由图1可知,表1中具有协同抑菌效应的4组浓度为0.5MIC的精油成分组合及其单体成分(己醛、香叶醇、百里酚、丁香酚和肉桂酸)均与阳性对照C30一样存在明显的紫色菌素抑制带,而含50%乙醇的阴性对照组周围则没有抑制带,说明这4种精油成分组合都具有QSI活性。紫色菌素的定量实验也进一步验证了4种精油成分组合及其单体成分都可以显著抑制紫色杆菌素的产生(P<0.05)。根据Q值的大小判断(Q>1.15为协同作用),只有己醛和香叶醇对紫色杆菌素的产生具有协同抑制效应,抑制率为52.91%,也要高于其他3组复配精油成分,此时己醛和香叶醇的有效浓度仅为其单体MIC的1/8和1/16。在其他QSI研究中,肉桂醛质量浓度为0.105 mg/mL时,对紫色杆菌素产生的抑制率为51.03%[25],柠檬醛质量浓度为0.25 mg/mL时的抑制率为50%[26],而本研究采用的0.5MIC的己醛和香叶醇的复配精油成分中己醛和香叶醇的实际使用质量浓度仅为0.08 mg/mL。当0.08 mg/mL的己醛和香叶醇单独使用时抑制率分别只有22.13%和27.45%,但是当两者联合使用时就可与这些物质的作用效果接近,这说明己醛联合香叶醇也具有较好的群体感应抑制效果并具有协同效应。
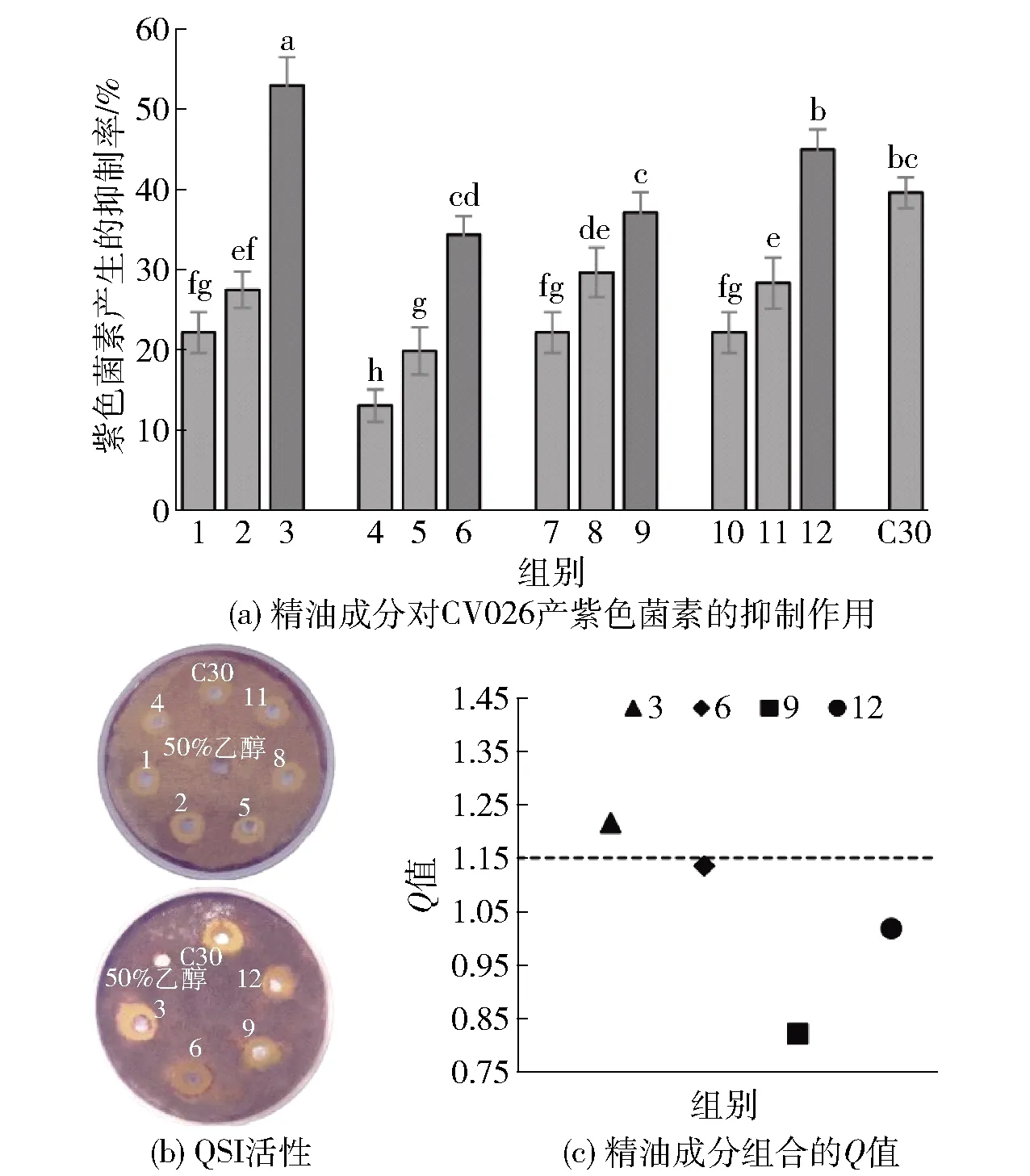
图(a)中1~3分别为0.08 mg/mL的己醛、香叶醇和己醛+香叶醇,4~6分别为0.04 mg/mL的己醛、百里酚和己醛+百里酚,7~9分别为0.08 mg/mL的己醛、丁香酚和己醛+丁香酚,10~12分别为0.08 mg/mL的己醛、肉桂酸和己醛+肉桂酸。图(a)中不同小写字母表明组间具有显著性差异(P<0.05)。图1 精油成分对CV026产紫色菌素的抑制作用和 联合抑制效果Fig.1 Inhibitory effect and combined inhibitory effect of essential oil components on violacein production of CV026
2.3 精油成分对胡萝卜软腐欧氏杆菌游泳和群集运动的抑制作用
细菌的游泳和群集运动是细菌在接触表面迁移的两种形式,也是由胡萝卜软腐欧氏杆菌QS系统介导所展现的一种重要的毒力因子,在细菌定植时附着于接触面表面和形成生物被膜的过程中发挥着重要作用[20]。为了解己醛和香叶醇对生物被膜的破坏作用,先研究了不同组合的精油成分对胡萝卜软腐欧氏杆菌游泳和群集运动能力的影响,实验结果见图2。图2(a)和图2(b)表明,所有0.5MIC浓度的精油成分组合对胡萝卜软腐欧氏杆菌和的游泳、群集都具有显著的抑制作用(P<0.05),其中己醛联合香叶醇对胡萝卜软腐欧氏杆菌游泳和群集运动的抑制率最高,分别为58.19%和51.49%。由图2(c)可见,己醛和其他精油成分的联合使用相比单独使用对胡萝卜软腐欧氏杆菌运动性具有更强的抑制效果,同时相比前期的研究结果[14],己醛单独作用游泳和群集运动的抑制率接近60%时需要0.1 mg/mL的,而0.5 MIC的己醛联合香叶醇中己醛的浓度只有0.078 mg/mL,有效地降低了己醛的使用浓度。如图2(d)所示,根据Q值的大小判断,4组复配精油成分中对胡萝卜软腐欧氏杆菌游泳运动的抑制作用均没有协同效应,而对群集运动的抑制作用则有己醛联合香叶醇呈协同效应,胡萝卜软腐欧氏杆菌可能与枯草芽孢杆菌(Bacillussubtilis)类似,游泳运动和群集运动分别受不同操纵子调控[27]。这些结果表明,通过精油成分的复配可以有效降低精油成分的使用浓度的同时,对胡萝卜软腐欧氏杆菌运动性具有相同或者更好的抑制效果。

1~12各精油成分浓度参照图1。图(a)和图(b)中不同小写字母表明组间具有显著性差异(P<0.05)。图2 精油成分对胡萝卜软腐欧氏杆菌游泳和群集运动的抑制作用和联合抑制效果Fig.2 Inhibitory effect and combined inhibitory effect of essential oil components on swimming and swarming movement of Erwinia carotovora
2.4 精油成分对胡萝卜软腐欧氏杆菌EPS分泌的抑制作用
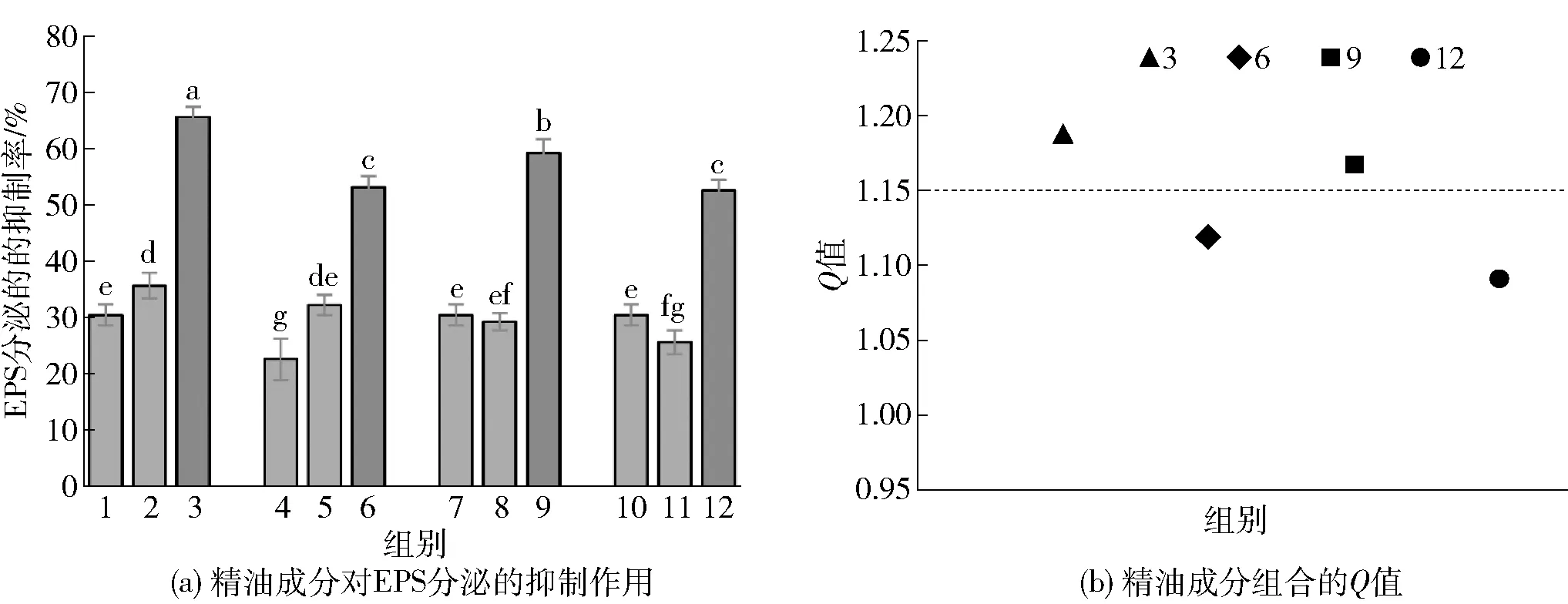
1~12各精油成分浓度参照图1。图(a)中不同小写字母表明组间具有显著性差异(P<0.05)。图3 精油成分对胡萝卜软腐欧氏杆菌EPS分泌的抑制作用和联合抑制效果Fig.3 Inhibitory effect and combined inhibitory effect of essential oil components on extracellular polysaccharide secretion of Erwinia carotovora
胞外多糖(EPS)是生物被膜基质的重要组成成分,在生物被膜形成初期,浮游细菌会分泌具有黏弹性的胞外多糖基质,增强细菌附着在物体表面的能力,从而加快生物被膜的形成[28]。为考察各精油成分对EPS分泌的抑制作用,实验结果如图3。由3(a)可知,在不同精油成分的作用下培养24 h后,胡萝卜软腐欧氏杆菌EPS的分泌受到显著的抑制作用(P<0.05)。己醛联合香叶醇对胡萝卜软腐欧氏杆菌EPS分泌的抑制率高达65.03%时,己醛和香叶醇的浓度均仅为0.08 mg/mL,相比前期的研究[14],0.1 mg/mL的己醛抑制率只有54.52%。除此之外己醛联合百里酚、丁香酚、肉桂酸的抑制效果也较为不错,分别为53.15%、59.19%和52.55%。由图3(b)可知,根据Q值的大小判断,4组复配精油成分中己醛联合香叶醇、丁香酚对胡萝卜软腐欧氏杆菌EPS的分泌具有协同抑制作用,而己醛联合百里酚、肉桂酸则是相加作用,这可能与精油成分作用于QS系统中的各自位点不同而产生不同的效应有关,如精油成分姜油酮作用于AHL 合成酶影响其活性[29],精油成分肉桂醛则作用于LuxR受体蛋白,影响AHLs- LuxR复合物的形成[25]。
2.5 精油成分对胡萝卜软腐欧氏杆菌生物被膜形成的抑制作用
细菌生物被膜是微生物的结合体,其中细胞通过鞭毛和分泌的多糖基质相互黏附并附着在接触表面上(图4)。由图4(a)可知,通过结晶紫实验结果显示不同精油成分的作用下,培养24 h后胡萝卜软腐欧氏杆菌EPS的分泌受到显著的抑制作用(P<0.05)。己醛联合香叶醇(质量浓度均为0.08 mg/mL)对胡萝卜软腐欧氏杆菌生物被膜形成的抑制率高达69.84%时,己醛联合百里酚、丁香酚、肉桂酸也有较好的抑制作用,联合作用的抑制效果均要高于精油成分单独作用的抑制效果,但是只有己醛联合香叶醇、百里酚时才有协同抑制作用[图4(b)],与抑制EPS协同效应类似,这可能和精油成分作用的位点不同而产生不同的效应有关。有研究报道[12],精油成分芳樟醇与DNasesI联用时对副溶血弧菌生物被膜的抑制率为63%,并成功将其应用于海产品的保鲜,与其相比,本研究中的己醛联合香叶醇在质量浓度为0.08 mg/mL时就对胡萝卜软腐欧氏杆菌的生物被膜有较好的抑制效果。
细菌的运动性、胞外多糖的分泌和生物被膜的形成密不可分,浮游细菌通过鞭毛的运动和胞外多糖的黏附性附着在接触物体的表面[30],而本研究中各精油成分组合对胡萝卜软腐欧氏杆菌的运动性分别有不同程度的抑制作用,特别是己醛联合香叶醇对群集运动和EPS均有协同抑制作用,这也在一定程度上促成了对生物被膜的形成也具有的协同抑制作用。生物被膜的形成是受QS调控,成熟的生物被膜形成之后,可有效延缓抗生素的渗透,从而使病原体对抗菌药物产生耐药性[28]。本研究中的精油成分作为天然提取QSI,可有效抑制腐败菌的QS并防止其产生耐药性,特别是经复配后得到协同作用的精油成分具有更安全、高效且低成本的优点,能被开发成新型植物源保鲜剂。

1~12各精油成分浓度参照图1。图(a)中不同小写字母表明组间具有显著性差异(P<0.05)。图4 精油成分对胡萝卜软腐欧氏杆菌生物被膜形成的抑制作用和联合抑制效果Fig.4 Inhibitory effect and combined inhibitory effect of essential oil components on biofilm formation of Erwinia carotovora
2.6 精油成分处理过后的生物被膜结构分析
本研究表明,4种具有协同抑制胡萝卜软腐欧氏杆菌生长的精油成分组合中,只有0.5 MIC的己醛和香叶醇的复配精油成分对胡萝卜软腐欧氏杆菌的生物被膜有较好的抑制作用。通过SEM和CLSM观察己醛和香叶醇的复配精油成分处理过的生物被膜,进一步确认该组合精油成分对生物被膜的协同抑制作用,实验结果见图5。由图5可知,通过SEM观察胡萝卜软腐欧氏杆菌的生物被膜发现,胡萝卜软腐欧氏杆菌不经任何处理能够形成强黏附性的生物被膜,且含有较多的细胞外基质和附着细菌。相比之下,在经过己醛和香叶醇处理后可以清晰地观察到生物被膜的完整性被破坏,表面的附着细菌也随精油成分的作用减少,也明显能看出己醛和香叶醇联合作用时比单独作用破坏效果要更好。CLSM分析可进一步看出,己醛联合香叶醇对生物被膜的破坏作用,未经处理的生物被膜结构保持紧密,而经处理的样品则出现解体。COMSTAT2分析结果见表2。由表2可知,经己醛和香叶醇处理后胡萝卜软腐欧氏杆菌生物被膜生物量、平均厚度、表面积与体积比都逐渐下降,并表现出显著的差异性(P<0.05),且己醛和香叶醇联合使用时生物量、平均厚度、表面积与体积比下降的要更多,这也说明己醛和香叶醇联用时对生物被膜的抑制效果更好。显微镜观察的结果与前期结晶紫分析生物被膜的结果一致。
3 结 论
本研究从精油成分之间协同抑制细菌的群体感应角度出发,在降低精油使用量的同时还能有效抑制致腐菌的腐败特性。先通过MIC和FIC指数的分析,筛选出4种具有协同抑菌的精油成分组合(己醛和香叶醇、己醛和百里酚、己醛和丁香酚、己醛和肉桂酸)。通过紫色杆菌CV026实验证明4种精油组合及其单体均有群体感应抑制作用,同时只有己醛联合香叶醇组合对CV026紫色菌素的产生具有协同抑制作用且是4组精油成分组合中抑制效果最好的。随后将4种精油成分组合应用于腐败菌胡萝卜软腐欧氏杆菌群体感应现象的抑制作用研究,结果表明4个精油成分组合对群体感应均有抑制作用,但只有己醛和香叶醇对细菌的运动性、胞外多糖分泌和生物被膜形成具有协同抑制作用,这也进一步验证了CV026紫色菌素抑制实验的结果。己醛联合香叶醇对胡萝卜软腐欧氏杆菌QS系统的具体协同抑制机理还未明晰,需要进一步研究相应的信号分子合成、相应的受体蛋白以及有关调控基因等。后续也将进一步研究精油成分组合在蔬菜防腐中的应用,同时也会对所应用蔬菜产品进行详述的感官评价。
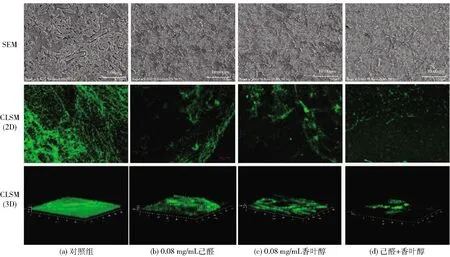
SEM和CLSM的放大倍数均为3 000倍。图5 己醛、香叶醇单独和联合使用对胡萝卜软腐欧氏杆菌生物被膜形成的抑制作用Fig.5 Inhibitory effects of hexanal and geraniol alone or in combination on formation of biofilm of Erwinia carotovora

表2 Comstat 2分析经己醛、香叶醇单独和联合作用后的胡萝卜软腐欧氏杆菌生物被膜
本研究表明,精油成分之间的协同群体感应抑制作用可以有效地解决实际应用中精油等高浓度天然提取物的高成本问题,实现在较低的浓度下就能有效抑制腐败菌的腐败特性,因此可将筛选出来的己醛和香叶醇组合应用于食品保鲜剂,通过抑制生物被膜的形成来延长食品的保藏期。
