固定化米黑根毛霉脂肪酶的制备工艺优化及其酶学性质
2022-04-25彭思敏吴卫国廖卢艳
彭思敏,肖 菁,吴卫国,廖卢艳
(湖南农业大学 食品科学技术学院,长沙 410128)
米黑根毛霉脂肪酶(Rhizomucormieheilipase,RML)是一种sn-1,3位专一性脂肪酶,可特异性地优先水解处于三酰甘油1位和3位的脂肪酸。作为一种重要的工业酶制剂,米黑根毛霉脂肪酶被广泛用于食品、制药、生物新能源和环境治理等行业[1-2]。在油脂行业中,米黑根毛霉脂肪酶具有在油相中催化酯化和酯交换反应的特性,可催化油脂中的游离脂肪酸与酰基受体反应,使游离脂肪酸尽可能多地转化为甘油酯或其他脂肪酸衍生物,从而降低油脂中游离脂肪酸的含量,达到降低成品油酸值和保障成品油品质的目的。在各脂肪酶中,米黑根毛霉脂肪酶的比活力高、热稳定性强、溶剂耐受性好,具有良好的工业化应用前景[3-4],但其在游离态下易受环境影响,难以被重复利用,且价格昂贵。因此,一般采用固定化方法对米黑根毛霉脂肪酶进行处理。
目前,吸附法、共价结合法、包埋法和交联法[5]是常用的脂肪酶固定化方法。包埋法是指将酶蛋白分子包裹在溶胶-凝胶、有机聚合物、微胶囊和膜设备等含有多孔结构的载体中的一种酶固定化方法[6]。包埋法实际操作简单且适用范围广泛,对酶分子的高级结构影响较小,固定化后的酶分子依然保持较高的酶活性。但包埋法弊端在于酶分子难以与大分子反应底物接触,因而被局限于反应底物为小分子的酶催化反应中[7]。交联法是指利用有双功能或多功能的交联剂与酶蛋白分子之间形成共价键,将酶交联聚集在一起的一种酶固定化方法[8]。交联法使用的交联剂(如戊二醛、双偶氮二联苯胺、鞣酸及异氰酸衍生物等)与酶分子单一结合时会导致酶活力损失严重,因而常与包埋法结合起来,不仅可以提高交联法制备的固定化酶的酶活力,同时也可以提高包埋法制备的固定化酶的重复使用性。罗少华等[9]采用包埋-交联法固定化大肠杆菌细胞,用以工业化生产γ-氨基丁酸。王妍等[10]采用包埋-交联法对磷脂酶A1进行固定化,固定化磷脂酶A1的酶活力回收率可达80.2%,同时具有较好的热稳定性,重复使用7次后的酶活力为初始酶活力的65%。徐珊[11]以海藻酸钠为载体,乙二醇缩水甘油醚为交联剂固定化脂肪酶,结果表明,包埋-交联处理后的固定化酶在65℃时仍能保持40%左右的相对酶活力,重复操作4次后酶活力为原来的50.32%,而游离酶只剩下10%左右的相对酶活力,并只能使用1次而无法回收。可见包埋-交联处理后的固定化酶在热稳定性与操作稳定性上均较游离酶得到了极大的提升。
载体是酶固定化的基础,海藻酸钠因其溶胶-凝胶的特性,温和无毒、廉价易得的特点,被广泛应用于农业、食品、医药、工业等各领域[12-14]。近几年关于海藻酸钠复合载体在固定化酶方面的研究逐步增多。陈辉等[15]制备了菠萝皮渣羧甲基纤维素/海藻酸钠复合水凝胶珠用于固定化菠萝蛋白酶,优化后的固定化酶比游离酶更耐热、耐碱性环境,具有较好的重复使用性。张慧霞等[16]以海藻酸钠-微孔淀粉制备固定化酯化酶,通过促进酯化反应来缩短陈酿时间。虞凤慧等[17]优化了包埋法固定化高温碱性脂肪酶的工艺,以海藻酸钠与羧甲基纤维素钠(CMC)为复合载体固定化后的酶活力回收率高达99.05%。目前,关于海藻酸钠复合载体在脂肪酶方面的研究不多,有待进一步探究。
本研究以海藻酸钠与CMC为复合载体,辅以戊二醛为交联剂,优化固定化米黑根毛霉脂肪酶工艺条件,并进行酶学性质研究,以期达到降低成本,提高利用率和可回收率的目的,为米黑根毛霉脂肪酶固定化提供一种新思路,为实现酶法酯化脱酸在油脂工业生产中的自动化提供一定的理论基础。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
米黑根毛霉脂肪酶(Palatase 2000L,酶活力10 075.68 U/mL),丹麦诺维信公司;海藻酸钠、CMC、聚乙烯醇(PVA)、阿拉伯胶、黄原胶、明胶、卡拉胶、橄榄油、无水醋酸铜、异辛烷、戊二醛、无水乙醇、吡啶、磷酸二氢钠、磷酸氢二钠、浓盐酸等,均为分析纯。
1.1.2 仪器与设备
UV-1800紫外分光光度计,上海美谱达仪器有限公司;磁力搅拌器,德国IKA公司;水浴恒温振荡培养箱,天津莱玻特瑞仪器设备有限公司;pH计,上海梅特勒-托利多仪器有限公司;JRJ-300-I型乳化剪切搅拌机,上海标本模型厂。
1.2 试验方法
1.2.1 脂肪酶液的配制
取一定体积的米黑根毛霉脂肪酶,用0.2 mol/L、pH 8.0的磷酸盐缓冲溶液配成浓度分别为400、600、800、1 000、1 200 U/mL的脂肪酶液,置于4℃冰箱中备用。
1.2.2 脂肪酶的固定化
复合载体的制备:按一定质量比分别向海藻酸钠中添加阿拉伯胶、CMC、PVA、黄原胶、明胶和卡拉胶6种胶体,沸水浴加热溶解并在烧杯中搅拌均匀,冷却后用蒸馏水定容至100 mL。
包埋法制备固定化脂肪酶:取5 mL复合载体溶液与2 mL脂肪酶液于烧杯中,搅拌均匀。用注射器将混合液逐滴加入到CaCl2溶液中形成直径约为3 mm的颗粒状物质,并置于4℃冰箱中硬化一定时间(固定化时间)。随后抽滤获得规则、均匀的小颗粒,用去离子水冲去表面残留溶液,得到固定化脂肪酶,保存在4℃冰箱中。
包埋-交联法制备固定化脂肪酶:依据包埋法制备固定化脂肪酶的流程,在CaCl2溶液中加入一定质量分数的戊二醛作为交联剂,其余步骤保持不变,此时的固定化时间为交联固定化时间。
1.2.3 脂肪酶活力及酶活力回收率测定
参照铜皂-分光光度法[18]测定脂肪酶活力。
游离酶活力的测定:按文献[18]的方法制备橄榄油乳化液,取1 mL底物橄榄油乳化液、1.25 mL磷酸盐缓冲溶液置于40℃水浴中预热5 min,加入0.25 mL酶液(使用pH 8.0磷酸盐缓冲溶液稀释),混合摇匀,待反应15 min后迅速加入0.5 mL 6 mol/L 的盐酸溶液和3 mL 95%的乙醇终止反应。随后加入1.5 mL异辛烷,60℃反应10 min后于室温水中冷却。待溶液冷却后,移取0.5 mL上层溶液,依次加入2 mL异辛烷和0.5 mL铜盐显色剂,振荡后静置,取100 μL上层清液在714 nm波长下测定吸光度。再根据脂肪酸浓度-吸光度标准曲线方程(y=0.013 3x+0.002 4,式中:y为吸光度;x为脂肪酸浓度,μmol/L)的脂肪酸浓度。按下式计算酶活力(1 min 内催化底物水解产生 1 μmol 脂肪酸所需的酶量为 1 个酶活单位(U))。
A=CV/(tm)
(1)
式中:A为脂肪酶活力,U/g;C为脂肪酸浓度,μmol/L;V为反应液体积,L;t为反应时间min;m为脂肪酶的加入量,g。
固定化酶活力的测定:将500 mg固定化酶浸入0.25 mL pH 8.0的磷酸盐缓冲溶液中代替上述0.25 mL酶液,其余步骤相同。
相对酶活力是指在同组试验中将酶活力最高者设为100%,其余组的酶活力与之相比。
固定化酶活力回收率(y)按式(2)计算。
y=A1/A0×100%
(2)
式中:A1为固定化酶的总活力;A0为用于固定化的酶的总活力。
2 结果与讨论
2.1 包埋法脂肪酶固定化条件优化单因素试验
2.1.1 复合载体对固定化效果的影响
在脂肪酶液浓度800 U/mL、海藻酸钠质量分数2%、胶体质量分数2.5%、CaCl2质量分数5%、固定化时间30 min条件下,考察复合载体对固定化效果的影响,结果见图1。
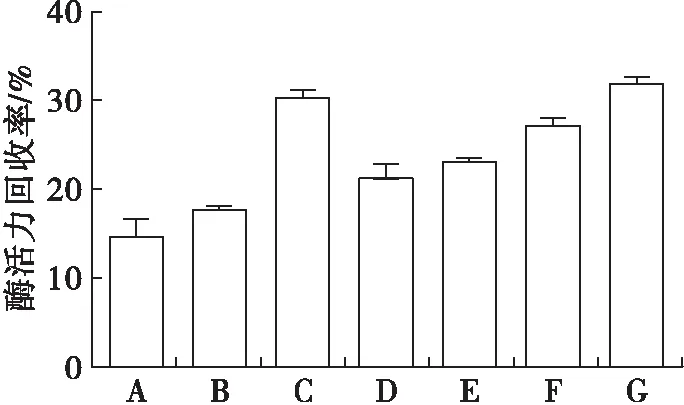
注:A.海藻酸钠;B.海藻酸钠-阿拉伯胶;C.海藻酸钠-PVA;D.海藻酸钠-黄原胶;E.海藻酸钠-明胶;F.海藻酸钠-卡拉胶;G.海藻酸钠-CMC。
从图1可知,6种复合载体的固定化效果均优于海藻酸钠,其中海藻酸钠-PVA、海藻酸钠-CMC复合载体的固定化酶活力回收率较高,分别达30.29%、31.97%。这两种复合载体处理下制得的凝胶颗粒光滑且均匀,达到了试验所需要求。但试验过程中,CMC比PVA易溶解,且无杂质,因此选择海藻酸钠-CMC为最佳复合载体。
2.1.2 脂肪酶液浓度对固定化效果的影响
以海藻酸钠-CMC为复合载体,在海藻酸钠质量分数2%、CMC质量分数0.75%、CaCl2质量分数5%、固定化时间30 min条件下,考察脂肪酶液浓度对固定化效果的影响,结果见图2。
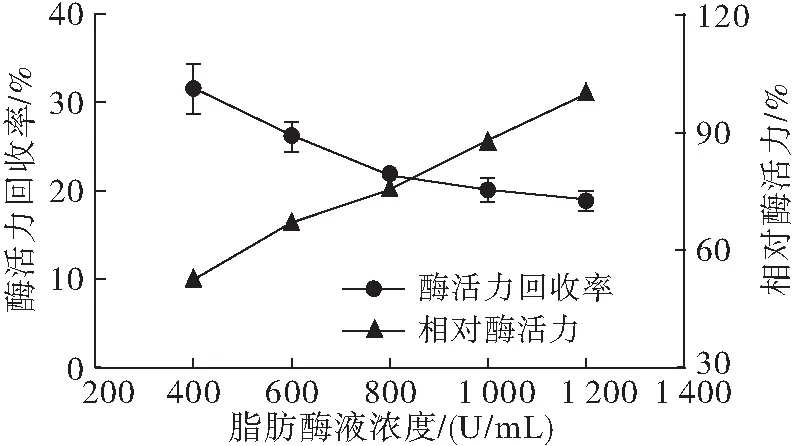
图2 脂肪酶液浓度对固定化效果的影响
从图2可知,随着脂肪酶液浓度的增加,固定化酶的相对酶活力逐渐增大,但固定化酶活力回收率却逐渐降低。造成该现象的原因是当脂肪酶液浓度较低(酶添加量较少)时,脂肪酶液被复合载体尽数包埋,使得固定化效率较高,但酶的总含量有限,酶活力无法继续提高;随着脂肪酶液浓度的增加,复合载体包埋的酶量逐渐达到饱和,脂肪酶液无法被继续包埋,导致固定化效率逐渐降低[19]。因此,综合考虑固定化酶的相对酶活力和酶活力回收率,选择脂肪酶液浓度800 U/mL为最佳。
2.1.3 海藻酸钠质量分数对固定化效果的影响
以海藻酸钠-CMC为复合载体,在脂肪酶液浓度800 U/mL、CMC质量分数0.75%、CaCl2质量分数5%、固定化时间30 min条件下,考察海藻酸钠质量分数对固定化效果的影响,结果见图3。
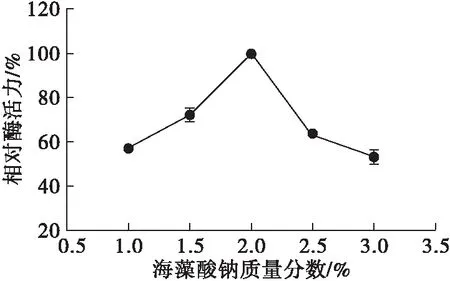
图3 海藻酸钠质量分数对固定化效果的影响
研究表明,海藻酸钠的分子链可与Ca2+发生交联而形成固态凝胶,其质量分数过低或过高均会影响固定化效果[20]。从图3可知,随着海藻酸钠质量分数的提高,固定化酶的相对酶活力先升高后降低。当海藻酸钠质量分数为1%和3%时,固定化酶的相对酶活力仅分别为57.10%和52.91%。这是因为海藻酸钠的质量分数过低时,凝胶颗粒的光滑度和硬度较差,不利于酶在凝胶中的固定;当海藻酸钠质量分数过高时,凝胶溶液因黏度过大难以挤压成球形,同时凝胶孔径过小也使其与酶分子的接触受阻,影响两者的结合,使固定化效果下降[21-22]。因此,选择海藻酸钠质量分数2%为最佳。
2.1.4 CMC质量分数对固定化效果的影响
以海藻酸钠-CMC为复合载体,在脂肪酶液浓度800 U/mL、海藻酸钠质量分数2%、CaCl2质量分数5%、固定化时间30 min条件下,考察CMC质量分数对固定化效果的影响,结果见图4。
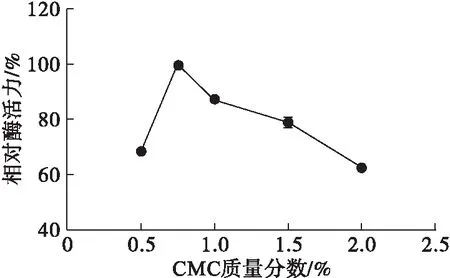
图4 CMC质量分数对固定化效果的影响
从图4可知,随着CMC质量分数的提高,固定化酶的相对酶活力呈现先升高后降低的趋势。当CMC质量分数较低时,CMC上的羧甲基能促使海藻酸钠大分子上的基团相互交联,增加了分子间的作用力,并在CMC质量分数为0.75%时,效果达到最佳。但随着CMC质量分数的继续增加,氢键作用随之增大,使得CMC无法在凝胶中均匀分布,导致固定化效果下降[23]。因此,选择CMC质量分数0.75%为最佳。
2.1.5 CaCl2质量分数对固定化效果的影响
以海藻酸钠-CMC为复合载体,在脂肪酶液浓度800 U/mL、海藻酸钠质量分数2%、CMC质量分数0.75%、固定化时间30 min条件下,考察CaCl2质量分数对固定化效果的影响,结果见图5。
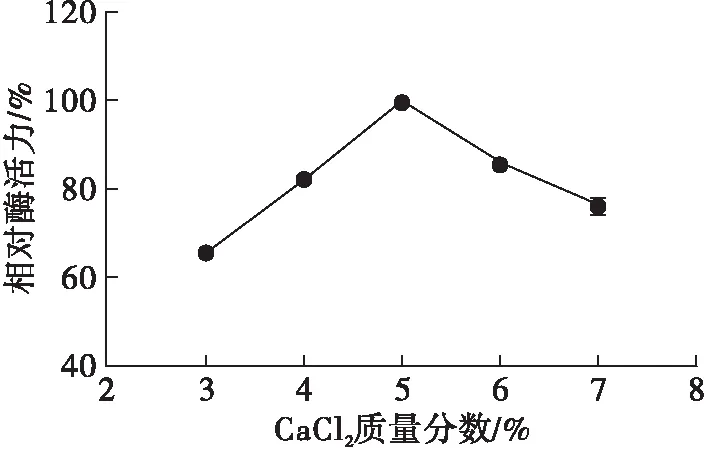
图5 CaCl2质量分数对固定化效果的影响
从图5可知,随着CaCl2质量分数的增加,固定化酶的相对酶活力先增大后减小。这是因为CaCl2质量分数较低(<5%)时,形成的凝胶网络机械强度较差,使得较多酶分子流失在溶液中[24];虽然CaCl2可以作为酶的激活剂,但当Ca2+浓度过高时,凝胶的通透性降低,影响了酶液的进入[25]。因此,选择CaCl2质量分数5%为最佳。
2.1.6 固定化时间对固定化效果的影响
以海藻酸钠-CMC为复合载体,在脂肪酶液浓度800 U/mL、海藻酸钠质量分数2%、CMC质量分数0.75%、CaCl2质量分数5%条件下,考察固定化时间对固定化效果的影响,结果见图6。
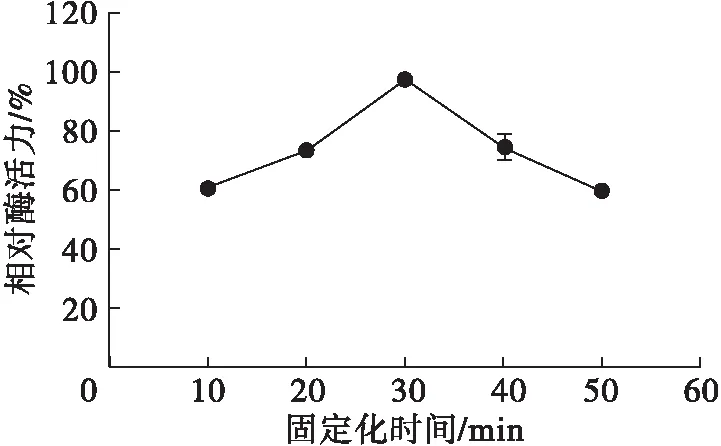
图6 固定化时间对固定化效果的影响
从图6可知,固定化酶的相对酶活力随着固定化时间的延长呈先增大后减小的趋势。在0~30 min时,凝胶得以充分反应而逐步形成稳定的网络结构,能更好地截留并包埋酶分子,使固定化效果增强[26];当固定化时间大于30 min时,过度反应导致凝胶网络结构过于致密[27],孔径过小,阻碍了底物与酶分子接触,使得固定化酶的相对酶活力降低。因此,选择固定化时间30 min为最佳。
2.2 包埋法脂肪酶固定化条件优化正交试验
以海藻酸钠-CMC为复合载体,固定脂肪酶液浓度为800 U/mL,在单因素试验结果的基础上,以固定化酶活力回收率(Y)为指标,采用L9(34)正交试验对海藻酸钠质量分数(A)、CMC质量分数(B)、CaCl2质量分数(C)及固定化时间(D)4个因素进行优化,确定最佳的固定化条件,每组试验重复3次。正交试验因素与水平见表1,正交试验设计与结果见表2。

表1 正交试验因素与水平
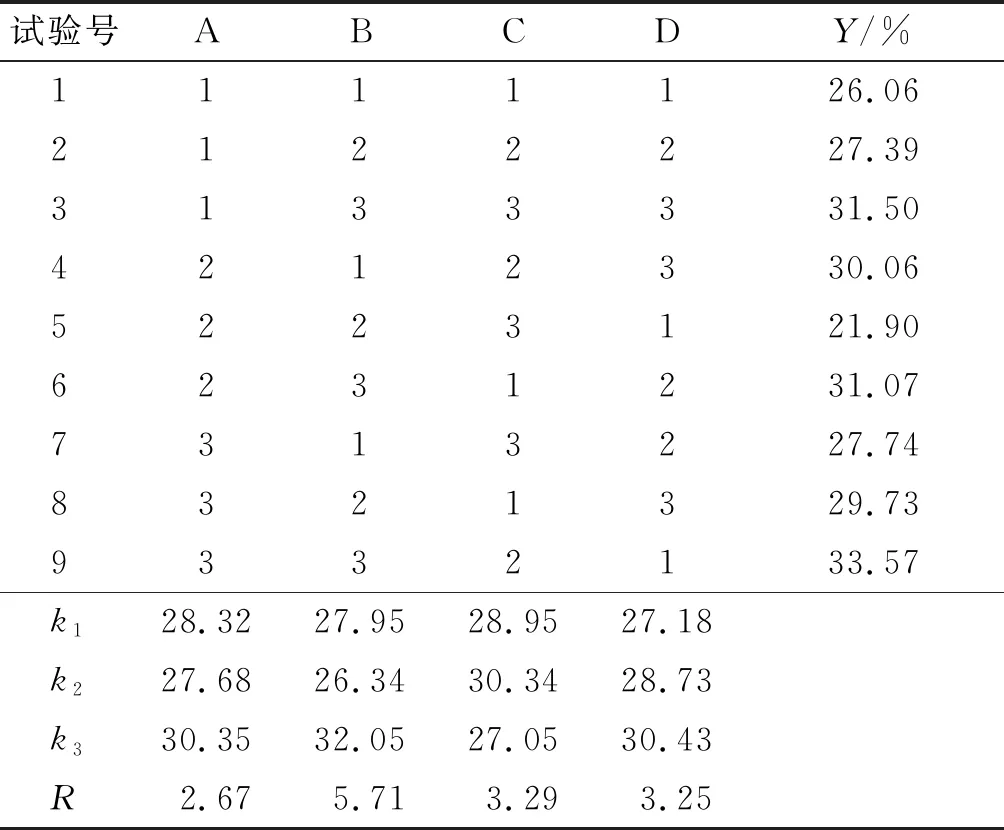
表2 正交试验设计与结果
由表2可知,影响固定化酶活力回收率的因素主次排序为CMC质量分数(B)>CaCl2质量分数(C)>固定化时间(D)>海藻酸钠质量分数(A),最佳组合为A3B3C2D3,即海藻酸钠质量分数2.5%、CMC质量分数1.5%、CaCl2质量分数5%、固定化时间40 min。经验证试验,在最佳条件下固定化酶活力回收率为35.93%。
2.3 包埋-交联法脂肪酶固定化交联条件的确定
2.3.1 戊二醛质量分数的确定
在包埋法脂肪酶固定化正交试验优化结果的基础上,考察戊二醛不同质量分数对固定化效果的影响(以不加交联剂制备的固定化酶的酶活力为100%计),结果见图7。
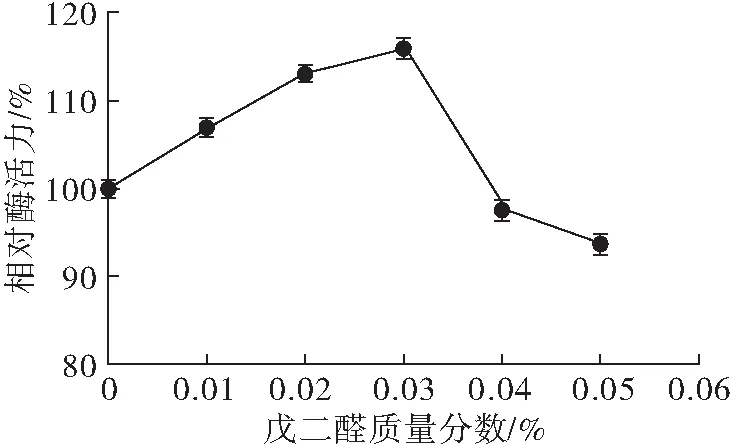
图7 戊二醛质量分数对固定化效果的影响
从图7可知,固定化酶的相对酶活力随戊二醛质量分数的增大先增大后减小。当戊二醛质量分数较低时,许多酶分子未与交联剂反应,仍处于包埋状态,一旦被洗涤即发生脱落,因此在一定范围(0.01%~0.03%)内随着戊二醛质量分数的增加,固定化效果也逐渐增强。值得注意的是,当戊二醛质量分数大于0.03%后,固定化酶的酶活力骤降。这是由于过高含量的戊二醛会对酶分子活力产生影响,同时也会促使凝胶中的羟基充分交联,固定过多的酶分子,造成网络空隙拥堵[11,28]。因此,选择戊二醛质量分数0.03%为最佳。
2.3.2 交联固定化时间的确定
在包埋法脂肪酶固定化正交试验优化结果的基础上,添加质量分数0.03%的戊二醛,考察交联固定化时间对固定化效果的影响,结果见图8。
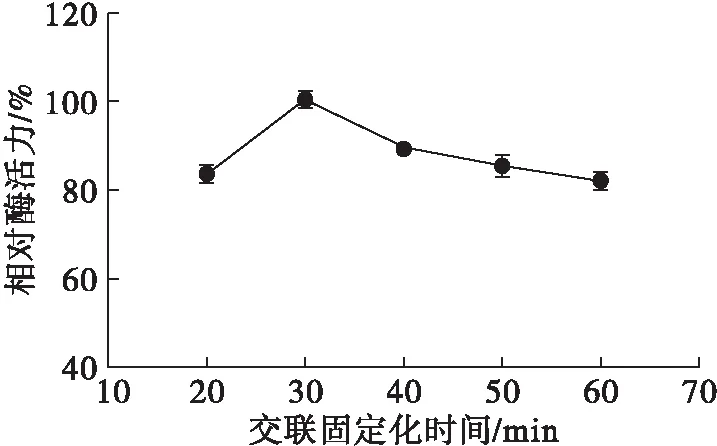
图8 交联固定化时间对固定化效果的影响
从图8可知,固定化酶的相对酶活力随着交联固定化时间的延长先上升后下降。当交联固定化时间短于30 min时,交联剂暂未充分扩散进凝胶内部,与酶分子结合不充分,故固定化效果会随着交联固定化时间的延长而逐步提升,并在30 min时达到最高,此时固定化米黑根毛霉脂肪酶活力为245.58 U/g。随着交联固定化时间的继续延长,酶活力会因网络结构过密而下降[25]。因此,30 min为最佳交联固定化时间,与包埋法相比缩短了10 min。
2.4 包埋法与包埋-交联法脂肪酶固定化效果的比较
将包埋法与包埋-交联法最佳条件下制备的固定化米黑根毛霉脂肪酶,按照1.2.3的方法,在40℃和pH 8.5反应条件下测定酶活力,然后过滤回收固定化酶,并用磷酸盐缓冲溶液洗涤2次,继续重新测定酶活力,共重复操作7次,考察不同方法制备的固定化酶的操作稳定性,结果见图9。
从图9可知,重复使用2次后,经包埋-交联法制备的固定化酶重复利用性更好,其相对酶活力明显高于包埋法制备的固定化酶,且最终残余酶活力可达57.39%。这是因为酶蛋白分子经过交联处理后可形成共价键,其键能比其他作用力的键能高,使酶蛋白分子的稳定性更强[29]。
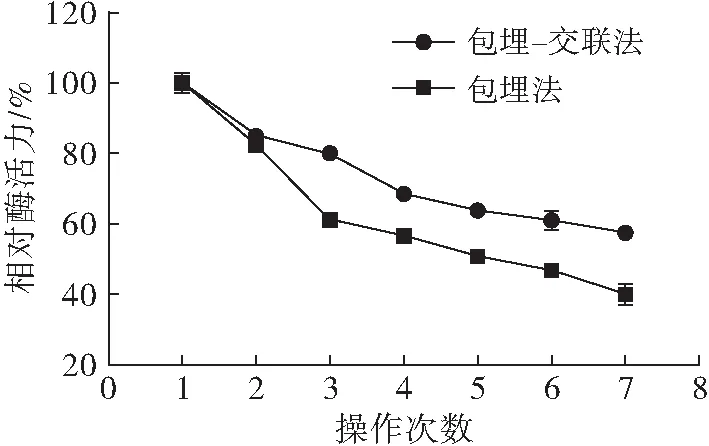
图9 固定化酶的操作稳定性
将包埋法与包埋-交联法最佳条件下制备的固定化米黑根毛霉脂肪酶存储在4℃冰箱中,每隔7 d按照1.2.3的方法,在40℃和pH 8.5反应条件下测定1次酶活力(连续7周),考察不同方法制备的固定化酶的储存稳定性,结果见图10。
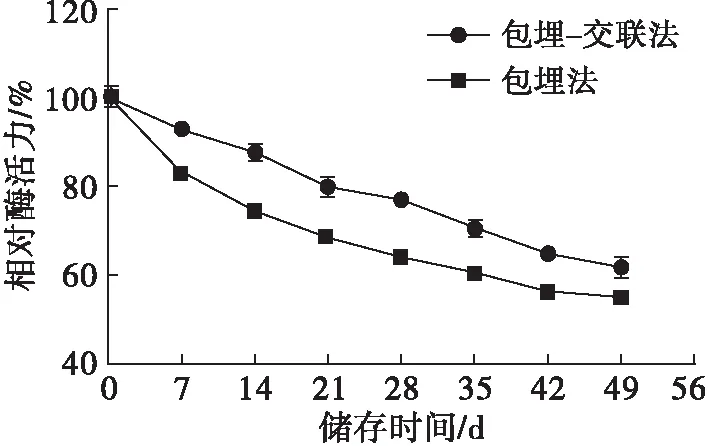
图10 固定化酶的储存稳定性
从图10可知,与包埋法制备的固定化酶相比,包埋-交联法制备的固定化酶的曲线更为平缓,且储存7周后的相对酶活力仍可达61.89%。这说明交联处理后的固定化酶储存稳定性更好,更利于工业化生产。
2.5 固定化酶的酶学性质
2.5.1 最适反应温度及热稳定性
将最佳包埋-交联法固定化条件下制备的固定化酶与游离酶,按照1.2.3的方法,在pH 8.5下于25~60℃范围内每隔5℃测定酶活力,确定了固定化米黑根毛霉脂肪酶和游离米黑根毛霉脂肪酶的最适反应温度为40℃。将固定化酶和游离酶在不同温度(25~60℃)下处理30 min,按1.2.3方法测定酶活力,考察固定化酶和游离酶的热稳定性,结果见图11。由图11可知:在40℃时,固定化酶和游离酶的相对酶活力均最高,当温度低于40℃时,二者的相对酶活力差别不大;但随着温度的继续升高,两者的相对酶活力均呈现降低趋势,但固定化酶下降趋势更平缓,具有更好的热稳定性。这是因为酶蛋白分子与载体之间存在多种作用力,对酶蛋白分子的空间结构具有保护作用[30];同时在热传导过程中,由于载体温度低于外部环境温度,使得酶蛋白分子的催化活性中心得到保护,缓和了温度对其活性的影响,扩大了对温度的适应性[31-32]。当温度在25~55℃时,固定化酶的相对酶活力保持在69.13%以上。
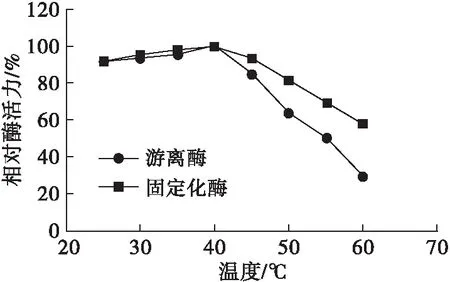
图11 固定化酶和游离酶的热稳定性
2.5.2 最适反应pH及pH稳定性
将最佳包埋-交联法固定化条件下制备的固定化酶与游离酶,按照1.2.3方法,在40℃下于pH 6.0~11.0范围内每隔0.5测定酶活力,确定固定化米黑根毛霉脂肪酶和游离米黑根毛霉脂肪酶的最适pH均为8.5。将固定化酶和游离酶在不同pH(6.0~11.0)下处理30 min,按1.2.3方法测定酶活力,考察固定化酶和游离酶的pH稳定性,结果见图12。
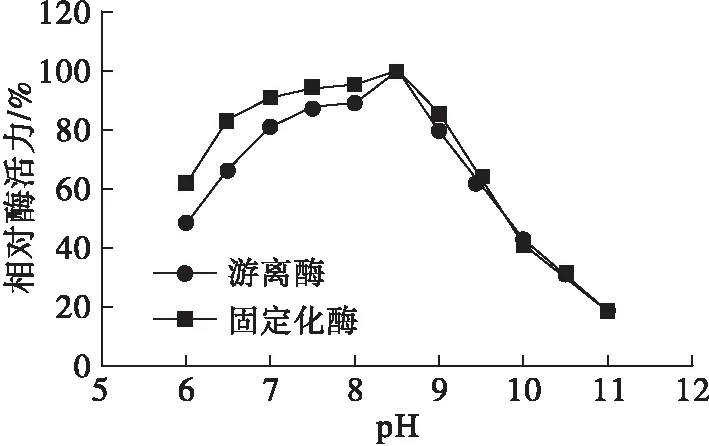
图12 固定化酶和游离酶的pH稳定性
由图12可知:在pH 8.5时,固定化酶和游离酶的相对酶活力均最高;当pH大于8.5时,二者的相对酶活力差别不大;而当pH为6.0~8.5时,两者的相对酶活力均呈现增强的趋势,但固定化酶的相对酶活力均高于游离酶的,呈现更好的pH稳定性。这是因为酶蛋白分子经过固定化处理后,通过共价键(氢键或范德华力)结合到凝胶载体上,酶蛋白分子的柔性降低,刚性增强,使得酶对pH的敏感度降低[33]。在pH 6.5~9.0时,固定化酶的相对酶活力保持在83.37%以上。
3 结 论
以海藻酸钠-CMC为复合载体,戊二醛为交联剂,采用包埋-交联法固定化米黑根毛霉脂肪酶。通过单因素试验和正交试验优化包埋法固定化工艺条件,并在此基础上研究了交联剂质量分数和交联固定化时间对固定化酶活性的影响。所得最佳固定化工艺条件为海藻酸钠质量分数2.5%,CMC质量分数1.5%,脂肪酶液浓度800 U/mL,CaCl2质量分数5%,戊二醛质量分数0.03%,交联固定化时间30 min。在最佳条件下,固定化米黑根毛霉脂肪酶酶活力为245.58 U/g。同时,对比发现戊二醛可作为合适的交联剂来提高米黑根毛霉脂肪酶固定化效果,且重复性好、稳定性强。通过酶学特性分析,固定化米黑根毛霉脂肪酶的最适反应温度为40℃,最适反应pH为8.5,在高温(40~60℃)和低pH(6.0~8.5)环境下的酶活力均高于游离酶的,具有较好的热稳定性和pH稳定性。对于固定化米黑根毛霉脂肪酶,当温度在25~55℃时,其相对酶活力保持在69.13%以上,在pH 6.5~9.0时,其相对酶活力保持在83.37%以上。由此可见,经本试验优化的固定化米黑根毛霉脂肪酶稳定性强,适用范围广,可以实现多次回收再利用,能够更好地满足酶法酯化脱酸在油脂工业生产中的自动化生产需求。
