猪源抗菌肽结构优化的研究进展
2022-04-25师帅兵陈亮亮王晓利廖成水
师帅兵,陈亮亮,王晓利,廖成水
(1.河南科技大学动物科技学院兽医生物制品工程重点实验室,河南 洛阳 471023;2.河南科技大学基础医学院,河南 洛阳 471023)
抗生素的大量使用甚至滥用导致细菌耐药性的产生和药物残留,进而对畜禽和人类健康造成了严重危害[1-2]。解决细菌耐药性和药物残留问题已成为世界各国科学家们的重要课题。我国农业部于2020年全面禁止饲料端抗生素的使用,后抗生素危机已经到来,开展新型抗菌药物的研究已迫在眉睫。抗菌肽具有广谱抗菌活性、快速杀菌效应、独特的抗菌机制及不易产生耐药性等优点,吸引了国内外研究者的广泛关注[3-5]。猪源抗菌肽是从猪体内发现的固有免疫效应因子,其结构多样化,具有广谱、高效的抑菌作用和多种生物学功能,是一类具有广泛应用前景的抗菌肽。目前以优良的猪源抗菌肽为模板经人工改造为新型抗菌药物的研究成为热点。本文重点综述了猪源抗菌肽结构优化策略的研究进展,以期为新型抗菌肽的研发提供参考依据。
1 猪源抗菌肽的分类及其抗菌机制
目前,在猪体内已经发现了几十种不同的抗菌肽(表1),这些抗菌肽分子量均小于10 ku,空间结构不同,且对多种微生物有杀灭作用。根据猪源抗菌肽前体的基因结构和氨基酸序列特征可以将其分为Cathelicidin 家族、防御素家族以及皂苷家族。属于天蚕素(Cecropin)中的一种抗菌肽Cecropin P1 最初是从猪肠道分离出来,后来证实其来源于寄生在猪肠道的蛔虫[6]。猪源Cathelicidin 家族抗菌肽主要从猪白细胞中分离或从骨髓组织的cDNA 序列推断而来,分别是富含脯氨酸的线性抗菌肽PR-39、Prophenin-1(PF-1)、Prophenin-2(PF-2),线性的猪髓源性抗菌肽(Porcine myloid antimicrobial peptides,PMAPs)PMAP-23、PMAP-36、PMAP-37 以及富含半胱氨酸的环形抗菌肽Protegrin-1(PG-1)、Protegrin-2(PG-2)、Protegrin-3(PG-3)、Protegrin-4(PG-4)、Protegrin-5(PG-5)。PR-39 和PFs 分别具有重复的“X-P-P-X”和“FPPPNFPGPR”氨基酸序列,形成了不同于α 螺旋或β 折叠结构的伸展性聚脯氨酸Ⅱ型螺旋结构[7-8]。PR-39 通过穿过细菌细胞膜,进入细胞内破坏细菌DNA 的转录和翻译,以非裂解细菌细胞膜的方式诱导细菌死亡,达到杀灭细菌的目的[9]。PMAP-23、PMAP-36 和PMAP-37 具有典型的两亲性α 螺旋结构,均通过“毯式模型(Carpet model)”的破膜裂解方式发挥抗菌活性,破坏细菌的细胞膜并使其溶解,继而导致细菌死亡[10-12]。研究表明PMAP-36 也可以穿过细菌细胞膜并与细胞内的DNA 相互作用,进而证明破膜裂解方式并不是PMAP-36 致细菌死亡的唯一作用机制[13]。PGs 具有由C1~C4 和C2~C3 形成的2 个二硫键维持的反平行β折叠结构。PG-1 是以“桶-板模型(Barrel-stave model)”破膜裂解的方式杀灭细菌[14]。防御素家族抗菌肽共有几十种,大多数由1 个α 螺旋和3 个β 折叠结构组成[15]。在抗菌肽pBD2 杀灭细菌过程中,其中大部分肽分子作用于细菌细胞膜发挥抗菌活性,而部分肽分子则穿过细菌细胞膜,进入细胞内与DNA 相互作用,因此pBD2 可能同时具有多种杀灭细菌的方式[16-17]。目前仅发现NK-lysin 1 条皂苷家族抗菌肽,其具有5 个两亲性的α 螺旋结构,以“环孔模型(Toroidal pore model)”破膜裂解的方式发挥抗菌作用[18]。因此,猪源抗菌肽主要以破膜裂解方式或非裂解细菌细胞膜的方式杀灭细菌。除此之外,在猪体内还发现了一些其它种类的抗菌肽,如在肝脏中高度表达的Hepcidin 抗菌肽和LEAP-2 抗菌肽,这两种抗菌肽均富含半胱氨酸,Hepcidin 还是一种铁调节激素,既有抗菌活性,又有铁调节活性[19]。还有在骨髓、肠道、肝脏、脾、肾脏等多种组织中均有表达的肽聚糖识别蛋白抗菌肽(PGRPs)等[20]。目前,对这些猪源抗菌肽的研究较少。适量的正电荷和疏水性是猪源抗菌肽发挥抗菌活性的关键,抗菌肽通过其所携带的正电荷与细菌细胞膜表面的负电荷之间的静电引力吸附于细菌细胞膜表面。随后,抗菌肽的疏水性区域插入细菌细胞膜形成跨膜通道造成细菌内容物流失,进而导致细菌死亡。以非裂解细菌细胞膜方式杀灭细菌的抗菌肽则是通过与细菌细胞内特定的分子靶标相互影响而起作用。
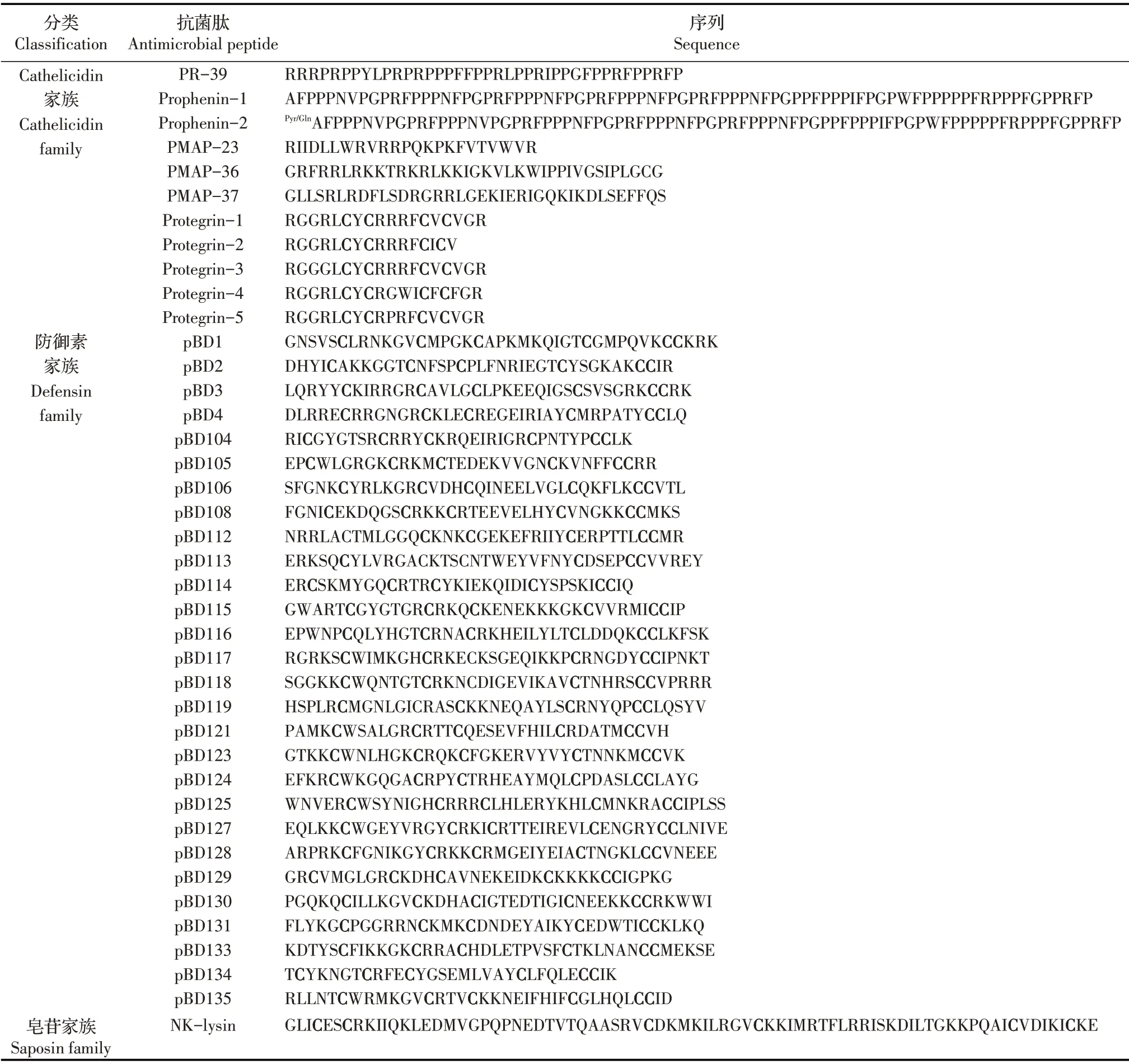
表1 猪源抗菌肽的氨基酸序列
2 猪源抗菌肽的结构优化
猪源抗菌肽因较广的抗菌谱和特有的抗菌机制吸引了国内外研究者的广泛关注。虽然猪源抗菌肽具有替代传统抗生素的潜力,但因其抗菌活性低、代谢稳定性差及体内潜在的毒性阻碍了对其进一步的研究与应用。因此,优化猪源抗菌肽的结构,克服其所存在的缺陷与不足具有重要的现实意义。目前对猪源抗菌肽结构优化的策略主要包括α 螺旋优化、β 折叠优化、正电荷优化、疏水性优化、两亲性优化、杂合肽优化、截短优化和脂肪酸修饰。
2.1 α 螺旋优化大多数α 螺旋型的抗菌肽在水溶液中是无序的,当其与细菌细胞膜相互作用时或在模拟膜环境中才呈现高度有序的螺旋构象,这种形成α 螺旋结构的倾向对抗菌肽发挥抗菌活性至关重要。它们大部分不是严格意义上的α 螺旋型结构,而是通常由几个α 螺旋结构共同组成,其N 端或C端也存在非α 螺旋区域。诱导抗菌肽形成α 螺旋的倾向,有利于增强抗菌肽的抗菌活性,然而,完全的α 螺旋并非最佳,往往会导致其对靶细胞失去选择性[21]。Wang 等通过对PMAP-36 结构和氨基酸序列的分析,将色氨酸(W)或赖氨酸(K)取代PMAP-36 aa25 和aa26 的脯氨酸(P)形成了PMAP-36PW 和PMAP-36PK 2 条抗菌肽,延长了抗菌肽的α 螺旋区域。抗菌活性和稳定性检测发现PMAP-36PW 和PMAP-36PK 较亲本肽的抗菌谱更广,体外抗菌活性和耐酸碱环境的能力更强。此外,将这2 条衍生肽通过腹腔接种于猪霍乱沙门菌C78-1 和单增李斯特菌CICC 21533 感染的小鼠,采用荧光定量PCR 法检测小鼠肺脏和肝脏的载菌量,结果显示,PMAP-36PW 和PMAP-36PK 可以杀灭小鼠体内感染的细菌,并且减轻了小鼠肺脏和肝脏组织的炎症损伤,进而降低了小鼠死亡率,表现出较好的治疗效果[22]。Wang 等对PMAP-36 的截短肽PMAP-GI24 进行序列分析,通过延伸PMAP-GI24 的α 螺旋区域,设计合成了2 条衍生肽PMAP-24KK 和PMAP-24WW。PMAP-24KK 和PMAP-24WW 不仅在体内外的抗菌活性高于PMAP-GI24,而且还表现出更广的抗菌谱[5]。这些研究表明延长抗菌肽的α 螺旋区域是提高抗菌肽抗菌活性的有效策略,为设计其他高效的抗菌肽提供参考依据。
2.2 β 折叠优化大多数β 折叠型的抗菌肽在水溶液或模拟膜的环境中呈现出β 折叠构象[23]。两亲性β 折叠型的抗菌肽通常具有很强的抗菌潜力和细胞选择性[24]。Shan 等通过对PG-1 的序列分析,以PG-1 的β 折叠模板RR(XY)2XDPGX(YX)2RR-NH2(X 代表I、W、V 或F;Y 代表H)为基础,设计产生了HI2、HW2、HV2 和HF2 4 条衍生肽。这些衍生肽在模拟膜环境中形成了更多的β 折叠结构。其中,抗菌肽HV2 对革兰氏阴性菌有较强的抗菌活性,对正常细胞几乎无毒性,表现出较好的疗效[25]。因此,根据β 折叠型抗菌肽的结构特征,设计并研发能够取代抗生素的新型β 折叠结构抗菌肽很有必要。
2.3 正电荷优化抗菌肽所具有的正电荷在抗菌过程中发挥重要作用,大多数阳离子两亲性抗菌肽的净正电荷范围为+2~+9,抗菌肽则通过正负电荷的相互作用吸附于细菌细胞膜表面[26]。此外,抗菌肽中带正电荷的精氨酸与其稳定性也密切相关[27]。Wang 等通过分析抗菌肽PMAP-37 的结构和氨基酸组成,将带正电荷的精氨酸(R)对PMAP-37 aa9 和aa34 非极性的苯丙氨酸(F)替换得到PMAP-37(F9-R)、PMAP-37(F34-R)和PMAP-37(F9/34-R)3 条衍生抗菌肽。与亲本肽相比,PMAP-37 的衍生肽在抗菌活性、热稳定性以及耐酸碱环境的能力均有所提高,其中PMAP-37(F9-R)和PMAP-37(F9/34-R)的抗菌谱更广,但这二者的抗菌活性并无显著差异。在小鼠感染模型中,则是PMAP-37(F34-R)的疗效较好[28]。同时,Wang 等将精氨酸(R)对PMAP-23 aa5 的亮氨酸(L)替换得到了携带更高正电荷的衍生肽PMAP-23R。与亲本肽PMAP-23 相比,PMAP-23R 的抗菌活性和稳定性更高[29]。Huang 等利用精氨酸(R)或赖氨酸(K)取代了pBD2 的8 个氨基酸残基,得到了8 条结构相似,且携带更高正电荷的衍生肽。pBD2 的衍生肽对金黄色葡萄球菌和大肠杆菌表现出不同的抗菌活性,其中I4R 的抗菌活性最强,且所有pBD2 的衍生肽均表现出较低的溶血性[30]。因此,引入带正电荷的氨基酸能够增强猪源抗菌肽的抗菌活性,但其抗菌活性并不与正电荷氨基酸的数量成正相关。
2.4 疏水性优化抗菌肽的疏水性区域在抗菌过程中发挥重要作用,在抗菌肽吸附于细菌细胞表面后,其疏水性区域能够插入细菌细胞膜,破坏细菌细胞膜的正常结构,继而致细菌死亡[31]。Lee 等在不改变PMAP-23 螺旋结构的前提下,对其aa10、aa13和aa14 的氨基酸用色氨酸(W)替换得到了疏水性更高的衍生肽(P1~P6),且所有衍生肽的抗菌活性均有所提高,其中P6 的抗菌活性最高[32]。Wang 等对PMAP-37 aa13 的精氨酸(R)、aa20 和aa27 的赖氨酸(K)用非极性的异亮氨酸(I)替换得到PMAP-37(R13-I)和PMAP-37(K20/27-I)2 条抗菌肽,不仅增强了亲本肽的疏水性,而且PMAP-37 衍生肽的抗菌活性、热稳定性以及耐酸碱环境的能力均增强,其中PMAP-37(K20/27-I)的抗菌谱更广,抗菌活性更高,对感染小鼠的疗效也较好[33]。此外,Wang 等对PMAP-23 aa19 的苏氨酸(T)用异亮氨酸(I)替换得到PMAP-23I,不仅增强了亲本肽的疏水性,且PMAP-23I的抗菌活性和稳定性也更高[29]。因此,在一定范围内抗菌肽的疏水性越高,其抗菌活性越强。
2.5 两亲性优化疏水性和亲水性氨基酸在抗菌肽分子结构上所形成的两亲性对其发挥生物活性至关重要[34]。完美两亲性是指亲水性氨基酸集中分布在抗菌肽螺旋轮结构的一侧,疏水性氨基酸则集中分布在另一侧,但完美两亲性通常会导致抗菌肽的抗菌活性和细胞毒性同时增加[35]。因此,在不改变抗菌肽其它结构的前提下,可以通过氨基酸的取代或截短进行两亲性的优化。PMAP-36“N”端由16 个氨基酸组成的RI16 是1 条完美两亲性的抗菌肽。Shan等根据α 螺旋蛋白的折叠原理,利用色氨酸(W)取代位于RI16 两亲性结构中成对的赖氨酸(K),优化了RI16 的完美两亲性结构,设计出4 条衍生肽PRW3、PRW4、PRW5 和PRW6。结果表明4 条衍生肽比RI16 的抗菌活性更强,而溶血性并未发生变化,保持了较好的生物安全性[36]。因此,通过适度优化抗菌肽的两亲性对抗菌制剂的开发具有较高的参考价值。
2.6 杂合肽优化杂合肽优化是通过基因重组技术将不同抗菌肽的功能片段进行拼接,构建具有更高抗菌活性抗菌肽的优化技术[37]。Park 等利用基因重组技术将来源于噬菌体P22 的溶菌酶与PMAP-36 的“N”端连接获得了杂合肽PMAP36-P22。PMAP36-P22 不仅抗菌活性较高,且溶血活性大幅度降低[38]。Li 等通过化学合成法将PG-1 与脂多糖(LPS)的结合域杂交,设计了1 条新型杂合肽SynPG-1。结果表明SynPG-1 比PG-1 的抗菌活性和血清稳定性均更高[39]。Shan 等利用来源于PMAP-36 的PRW4 分别与Fowlicidin-2(aa1~aa15)的两亲性螺旋区域、PG-3(aa6~aa16)的β 折叠区域和Tritrpticin 中富含色氨酸(W)的活性中心连接,通过固相合成法设计合成了3 条杂合肽PR-FO、PR-PG 和PR-TR,这些杂合肽不仅比亲本肽的抗菌谱更广,抗菌活性、稳定性和杀菌效率更高,且在宿主红细胞和细菌细胞之间,其对细菌细胞的选择性更高,因而对宿主的杀伤性很小[40]。这些研究表明杂合肽优化是开发新型抗菌药物的非常有前景的一种优化方式。
2.7 截短优化抗菌肽的肽链通过分子内的氢键作用保持结构稳定,进而更好的发挥抑菌作用[41]。抗菌肽的肽链过长会增加其对细胞的毒性,肽链过短则会降低其形成两亲性结构的趋势和破膜能力,进而降低其抗菌活性。因此,合适的肽链长度对抗菌肽结构的稳定性和抗菌活性至关重要[41]。Shan 等根据抗菌肽PMAP-36 的结构特点,通过截短PMAP-36的氨基酸序列设计合成了GI24、GK12、RI12 和PG12 衍生肽,抗菌活性的测定结果显示,与亲本肽相比,GI24 的抗菌活性较高,GK12 和RI12 的抗菌活性显著降低,PG12 则失去了对所有测试菌的抗菌活性,且PMAP-36 与GI24 的溶血活性相似,而GK12 和RI12 均未显示出溶血活性[11]。Park 等使用固相合成法合成了PR-39 和具有其“N”端前35 个氨基酸序列的PR-35,通过测定其抗菌活性和细胞毒性发现,PR-35 不仅与PR-39 的抗菌活性相似,且对细胞的毒性更低[42]。因此,截短肽对抗菌活性的影响依赖于亲本肽的活性区域,且截短肽对细胞的毒性更低。截短优化为开发具有更高细胞选择性的抗菌药物提供了新思路。
2.8 脂肪酸修饰脂肪酸是生物膜磷脂的重要成分,具有高疏水性[43]。脂肪酸修饰不仅不会改变抗菌肽原有的作用方式,而且可以在提高抗菌肽疏水性的同时,增加其α 螺旋含量,稳定其α 螺旋结构[44-45]。脂肪酸修饰可以增强抗菌肽与细菌细胞膜的相互作用,进而提高其抗菌活性[45-46]。然而,随着脂肪链长度的增加,抗菌肽的抗菌活性和溶血性将同时增加[45]。因此,选择合适的脂肪酸修饰对于提高抗菌肽的抗菌活性至关重要。Wang 等将PMAP-23RI 的“C”端与癸酸共价连接得到1条新型抗菌肽PMAP-23RI-Dec。与PMAP-23RI 相比,PMAP-23RI-Dec的抗菌活性和热稳定性更高,而溶血性和对细胞的毒性基本未变,且在小鼠的刀伤、脓肿和腹膜炎模型中,PMAP-23RI-Dec 的细菌清除能力和疗效均比PMAP-23RI 更强[47]。Wang 等将肉豆蔻酸与PMAP-36PW 的“N”端共价连接得到1 条新型抗菌肽Myr-36PW。肉豆蔻酸的修饰提高了PMAP-36PW 的抗菌活性,但其溶血性和对细胞的毒性并未改变。同时,Myr-36PW 还表现出较高的热、酸碱、盐离子和血清稳定性,在小鼠的刀伤、脓肿、肺炎和腹膜炎模型中,Myr-36PW 的疗效均更好[48]。因此,脂肪酸修饰能够提高抗菌肽的抗菌活性和稳定性,是一种非常有潜力的抗菌肽优化方式。
3 小结与展望
猪源抗菌肽具有分子量小、抗菌谱广等优点,是构成猪免疫系统的关键因子。目前,已在猪体内鉴定出几十种抗菌肽,其多样化的结构使抗菌肽具有不同的生物学功能,相信随着质谱和色谱技术的广泛应用和研究的深入,将会发现越来越多的猪源抗菌肽,进一步丰富猪源抗菌肽的种类。由于全球都亟需寻找抗生素的替代品,对于猪源抗菌肽的结构优化成为当前开发新型抗菌药物的研究热点。本研究室多年从事天然抗菌肽的结构优化研究,尤其对猪源抗菌肽的结构优化研究得较为深入,证明了正电荷优化、疏水性优化、α 螺旋优化、脂肪酸修饰等是有效的抗菌肽优化策略,且通过各种优化可以提高猪源抗菌肽的抗菌活性、稳定性,拓宽其抗菌谱,为猪源抗菌肽结构优化的深入研究奠定了基础[3,4,5,22,28,33]。随着蛋白质修饰技术的快速发展,抗菌肽的抗生素偶联、金属修饰、聚乙二醇化和糖基化也取得了一些进展[44]。但这些结构优化策略在猪源抗菌肽上的研究尚未见报道。随着蛋白质修饰技术的发展和对猪源抗菌肽研究的进一步深入,猪源抗菌肽的结构、功能、优化策略和体内的代谢分布等薄弱环节的研究将会有新的突破。本文为猪源抗菌肽结构优化策略的选择和新型高效抗菌肽的研发提供了理论参考。
