干扰旋毛虫GAD 基因对其抗酸能力影响的研究
2022-04-25孟小晴王姗姗宋铭忻
张 妍,孟 诗,孟小晴,高 远,王 爽,赵 亚,王姗姗,郭 琨,宋铭忻
(东北农业大学动物源性人兽共患病黑龙江省重点实验室,黑龙江 哈尔滨 150030)
旋毛形线虫(Trichinella spiralis)是临床上最小但最重要的营寄生生活的线虫之一,也是引起旋毛虫病的主要病原。旋毛虫病已在全世界约55 个国家有报道,尤其在发展中国家非常普遍,是目前世界上分布最广泛的人兽共患病之一[1-2]。根据旋毛虫成虫和肌幼虫寄生的部位不同,将旋毛虫的生活史划分为肠期和肌肉期两个阶段[3]。人和动物因吞食含有肌幼虫的包囊而感染。包囊在胃液的作用下释放出旋毛虫肌幼虫,幼虫经过十二指肠迁移入小肠并在小肠绒毛内寄生,大约30 h 后经过4 次蜕皮发育为成虫。从旋毛虫的整个生活史可以看出,旋毛虫能否感染宿主关键在于包囊中的感染性幼虫能否成功通过胃部酸性环境侵入小肠上皮细胞[4]。从旋毛虫致宿主患病的原因推测,旋毛虫幼虫可以耐受极酸的环境。
谷氨酸依赖型抗酸系统2(Glutamic acid resistance 2,AR2)是谷氨酸脱羧酶在催化谷氨酸发挥脱羧作用过程中消耗细胞内的质子,进而发挥抗酸作用的一种抗酸机制。谷氨酸脱羧酶是催化谷氨酸脱羧生成γ-氨基丁酸(γ-aminobutyrate,GABA)的关键酶[5]。同时谷氨酸的脱羧产物GABA 会被反转运体蛋白(Antitransporter protein,GadC)转运到细胞外并且交换到新的底物—谷氨酸,进而调节细胞内的pH,以缓解细胞外低pH 对细胞的影响,AR2 是最有效的抗酸途径之一[6]。当细胞内的酸性降低时,谷氨酸脱羧酶就会通过催化谷氨酸脱羧消耗质子,以调节细胞内外的酸碱平衡[7]。RNA 干扰(RNA interference,RNAi)是一种分子生物学上由双链RNA 诱发的基因沉默现象,其机制是通过阻碍特定基因的转录或者翻译来抑制基因表达,是降低基因表达有效和特异的方法。本研究利用RNAi 技术干扰旋毛虫谷氨酸脱羧酶(Glutamate,GAD)基因的表达,结合体外酸性环境培养旋毛虫肌幼虫及其感染小鼠的体内试验,研究干扰GAD 基因表达对旋毛虫肌幼虫在酸性条件下的存活率与繁殖力的影响,并探究旋毛虫谷氨酸依赖型抗酸机制在其抗酸环境过程中发挥的作用。以期为抗旋毛虫药物的研发提供新的作用靶点。
1 材料与方法
1.1 实验动物与主要试剂BALB/c 小鼠购自哈尔滨医科大学;反转录试剂盒(HiScript Q Select RT SuperMix for qPCR(+gDNA wiper))、硝酸纤维素膜、荧光定量PCR 试剂盒(AceQ qPCR SYBR Green Master Mix)、TRIzol 试剂购自南京诺唯赞生物科技有限公司;转染试剂Lipofectamine 2000 购自Thermo Fisher Scientific;GABA 标准品和L-谷氨酸(L-Glu)购自Sigma 公司;表达GAD 蛋白的重组菌、兔源GAPDH单克隆抗体(MAb)和兔源GAD 免疫血清由东北农业大学动物源性人兽共患病重点实验室提供;辣根过氧化物酶标记的山羊抗鼠IgG(IgG-HRP)购自北京索莱宝科技有限公司。
1.2 荧光定量PCR 引物与siRNA 的设计与合成旋毛虫GAD 和内参GAPDH 基因的荧光定量PCR 引物参考文献[4]合成。根据GenBank 登录的旋毛虫GAD mRNA 参考序列(XM_003375768.1)设计3 条靶向GAD 的siRNA 和一条contro siRNA(NC siRNA),GAD-siRNA1 正义链序列为GCGACTGTACACTTGGA AATG,反义链序列为CATTTCCAAGTGTACAGTC;GAD-siRNA2 正义链序列为GCGACTGTACACTTGGA AATG,反义链序列为CATTTCCAAGTGTACAGTCG C;GAD-siRNA3 正义链序列为CCAAGGGUAUGAAU GGCUUTT,反义链序列为AAGCCAUUCAUACCCUU GGTT;NC siRNA 正义链序列为AUCGGCUACCAAG UCAUACTT,反义链序列为GUAUGACUUGGUAGCC GAUTT,引物及siRNA 均由上海吉玛制药技术有限公司合成。
1.3 最佳siRNA 及其转染剂量的筛选将无菌的旋毛虫肌幼虫(后均简写为肌幼虫)分为siRNA1、siRNA2、siRNA3、NC siRNA 和PBS 等5 组,分别置于RPMI 1640 培养液中培养,参照文献[8],采用浸染法利用2 μL Lipofectin 2000 分别与终浓度为2 μmol/L的siRNA1、siRNA2、siRNA3、NC siRNA 和等体积的PBS 转染各组肌幼虫,筛选出最佳干扰的siRNA。
将旋毛虫各组培养板置于37 ℃5%CO2培养12 h后,收集虫体,利用TRIzol 法提取各组肌幼虫总RNA 反转录为cDNA 作为模板,以GAPDH 基因为内参,利用荧光定量PCR 检测各组肌幼虫GAD 基因mRNA 的转录水平[4];将各组虫体研磨、离心后即获得了各组肌幼虫的粗蛋白并经SDS-PAGE 电泳,分别以兔源GAD 免疫血清[4](1∶100)、兔源GAPDH MAb(1∶5 000)为一抗,以羊抗兔IgG-HRP(1∶5 000)为二抗,采用western blot 检测siRNA 干扰后GAD 基因表达水平的变化。根据上述检测结果初步筛选最佳的siRNA。
将肌幼虫分为5 组(每组5 000 条),按照上述方法分别以1 μmol/L、2 μmol/L 和4 μmol/L 的剂量转染已筛选出的最佳siRNA,以转染2 μmol/L 的NC siRNA 及等体积的PBS 分别做为阴性对照和空白对照,12 h 后更换RPMI 1640 培养液后继续在37 ℃5%CO2培养3 d,收集虫体,采用上述荧光定量PCR 和western blot检测各组肌幼虫GAD基因的转录水平和蛋白表达,以确定最佳siRNA 的最适转染剂量。
1.4 酸环境对GAD 基因干扰后的肌幼虫存活率的影响将肌幼虫分为最佳siRNA 组、NC siRNA 组和PBS 组,每组设置3 个平行孔,每孔300 条肌幼虫,分别在pH 值2.5、4.0、6.6 和8.0 的培养液中利用浸染法分别转染相应的siRNA 和PBS,在37 ℃、5%CO2分别培养0.5 h、1 h 和2 h 时经显微镜观察虫体活性,记录活虫数,分析酸环境对GAD 基因干扰后肌幼虫存活率的影响。存活率=(总虫数-死亡数)/总虫数×100%。
1.5 不同酸环境培养GAD 基因干扰后的肌幼虫GAD 基因转录水平的检测按照1.4 的试验设计,分组并转染后分别培养0.5 h、1 h 和2 h 收集虫体,利用TRIzol 法提取各组肌幼虫总RNA,反转录为cDNA,以GAPDH 为内参基因,按照1.3 的荧光定量PCR 方法检测各组肌幼虫GAD 基因转录水平,分析酸性环境对诱导GAD 基因转录水平的影响。
1.6 不同酸环境培养GAD 基因干扰后的肌幼虫培养液中GAD 酶活性及其pH 值的测定分别收集上述各组肌幼虫培养0.5 h 后的培养液,参照文献[4],采用比色法以不同浓度的GABA 标准液和不同浓度的L-Glu 标准液按等摩尔浓度(如8 mmol/L L-Glu 和2 mmol/L GABA 为一组)的策略组成混合标准溶液,以混合后标准液中各GABA 的浓度为横坐标,以混合液对应的OD640nm值为纵坐标,建立GABA的标准曲线。取不同酸性条件下培养的肌幼虫,研磨、离心制备GAD 粗酶液,测定OD640nm处的吸收值。根据标准曲线获得GAD 粗酶液中GABA 的浓度,按照酶活力计算公式:酶活力=(GAD 粗酶液中GABA 浓度×酶反应总体积)/ GABA 的相对分子质量计算各组培养液中GAD 的酶活性;利用pH 仪检测各组肌幼虫培养液的pH 值,比较肌幼虫在不同pH 培养前后培养液pH 值的变化,分析干扰GAD 基因表达后培养液中GAD 酶活性与培养液pH 值的相关性。
1.7 GAD 基因干扰后的肌幼虫对小鼠感染能力及其子代肌幼虫保姆细胞影响的检测将2 月龄左右的健康BALB/c 小鼠分为3 组,9 只/组。实验组小鼠分别经口接种2 μmol/L siRNA1 和NC siRNA 各2 μL 转染的肌幼虫(NC 组),设口服等体积PBS 侵染的肌肉虫作为空白对照,接种量均为300 条肌幼虫。在感染后7 d,通过脱臼法随机迫杀各组中的3只小鼠,去除皮毛、内脏和脂肪,胴体称重,捣碎后转移至广口瓶,利用体外消化法和改良的贝尔曼收集装置收集成虫,计算成虫减虫率[4]。减虫率=(NC 组肌幼虫感染组的成虫数-RNAi 干扰肌幼虫组的成虫数)/NC 组肌幼虫感染组的成虫数×100%。在感染后42 d,采用上述方法收集各组肌幼虫,计算肌幼虫的减虫率、肌幼虫的繁殖力指数(Reproductive capacity index,RCI)和每克肌幼虫数(Larvae per gram,LPG)。RCI=接种小鼠后所获得的幼虫数/接种的幼虫数;LPG=每克肌肉消化后获得的幼虫数;采用上述方法迫杀每组剩余的3 只小鼠,采集膈肌,经固定脱水、透明、石蜡包埋等步骤后制作病理切片,HE染色后,经显微镜观察各组肌幼虫保姆细胞。
1.8 统计分析采用GraphPad Prism 5 用于siRNA 转染条件的筛选,采用Excel 统计并计算幼虫的存活率。并采用单因素方差分析法分析组间差异,P<0.05为差异显著,P<0.01为差异极显著,有统计学意义。
2 结 果
2.1 最佳GAD-siRNA 及其转染剂量的筛选结果通过浸染法将终浓度分别为2 μmol/L 的siRNA1、siRNA2、siRNA3 和NC siRNA(NC 组)分别转染至肌幼虫体内,12 h 后分别利用荧光定量PCR 和western blot 检测各siRNA 的干扰效果,筛选出最佳干扰的siRNA。结果显示,siRNA1、siRNA2、siRNA3 转染组肌幼虫组GAD 基因转录水平相对于PBS 组分别降低了48.03%、61.14%和83.12%,NC 组与PBS 组肌幼虫GAD 基因的转录水平无差异(图1A);western blot 结果显示,与PBS 和NC 组相比,上述siRNA 转染组肌幼虫GAD 的表达量分别降低了43.30%、69.50%和84.80%(P<0.01),而NC 组GAD 基因转录水平与PBS 组无显著差异(图1C、图1E,P>0.05)。表明siRNA1 对肌幼虫GAD 基因的干扰效果最好,因此选择siRNA1 用于后续试验。
采用浸染法分别将1 μmol/L、2 μmol/L、4 μmol/L GAD-siRNA1 和2 μmol/L NC siRNA 转染肌幼虫体内培养3 d 后,采用荧光定量PCR 和western blot 检测每组GAD 基因的转录水平和其蛋白的表达水平。结果显示,相对于PBS组和NC组,1 μmol/L、2 μmol/L、4 μmol/L siRNA1 转染组GAD 基因转录水平分别降低79.80%、47.70%和41.20%,NC 组与PBS 组GAD 基因转录水平无差异(图1B);Western blot 结果显示,相对于PBS 组,上述各浓度siRNA1 转染组GAD基因表达量分别降低了76.80%、49.70%和40.20%(P<0.01),其中2 μmol/L 和4 μmol/L 的siRNA1 干扰效率均较高,NC 组GAD 基因表达量与PBS 组无差异(图1D、图1F),出于成本考虑选择2 μmol/L siRNA1 用于后续试验。
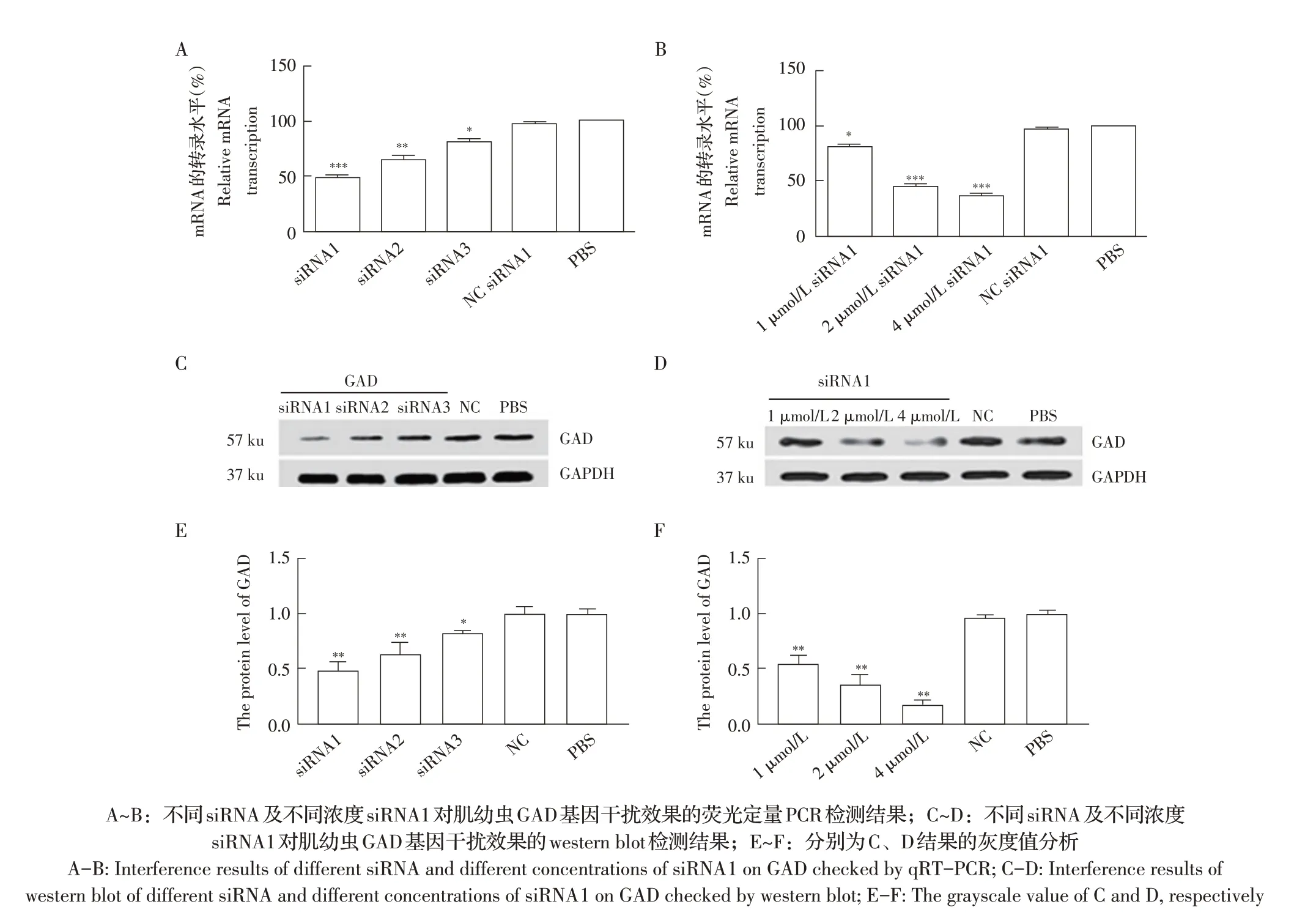
图1 最佳siRNA及其最佳转染剂量的筛选结果Fig.1 The screening of the best siRNA and concentration
2.2 酸环境对GAD 基因干扰后肌幼虫存活率的影响将siRNA1 组、NC 组和PBS 组肌幼虫在不同pH值的培养液中分别培养0.5 h、1 h 和2 h 时检测肌幼虫的存活率,结果显示,同一pH 值的培养液中,随着培养时间的增加,各组肌幼虫的存活率均降低,其中siRNA1 组肌幼虫的存活率明显低于PBS 组和NC 组(P<0.05),siRNA1 组在pH2.5 培养2 h 的存活率最低为30%;各组肌幼虫在pH6.6 时的存活率最高。NC 组肌幼虫的存活率则与PBS 组无明显差异(P>0.05)(表1)。表明干扰GAD 基因后,肌幼虫在酸性环境中的存活率降低。
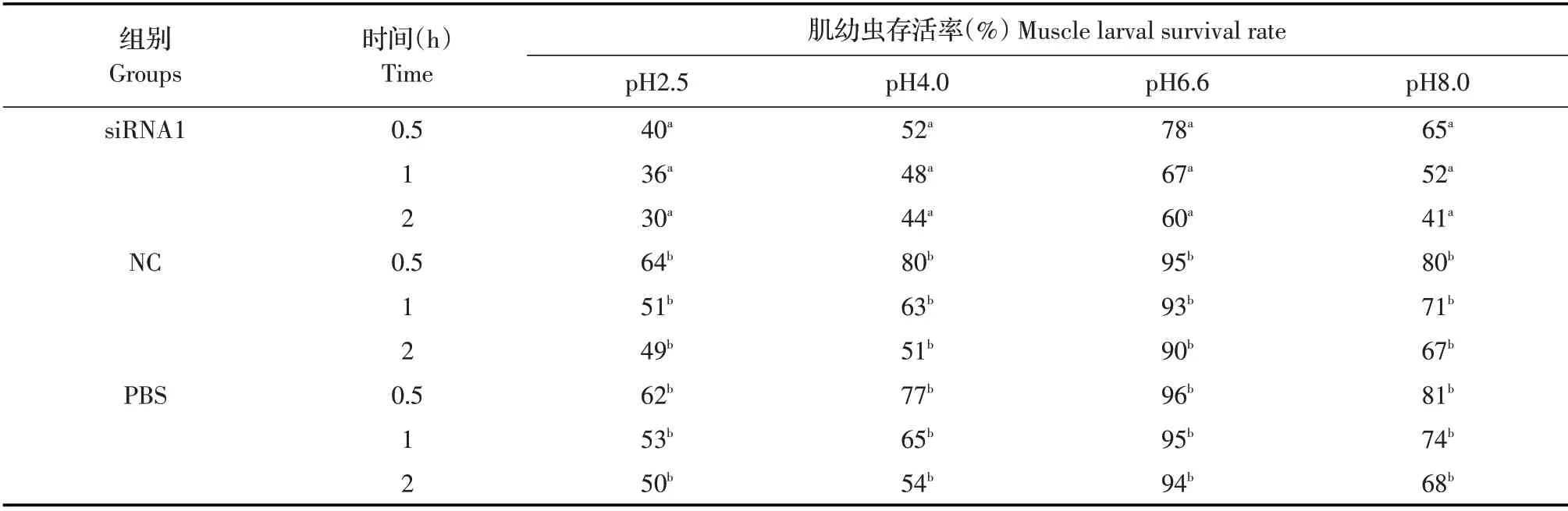
表1 各组肌幼虫在不同酸环境中的存活率检测结果Table 1 The survival rate of muscle larval in different acid medium
2.3 不同酸环境培养GAD 基因干扰后肌幼虫GAD基因转录水平的检测结果将siRNA1 组、NC 组和PBS 组肌幼虫分别在pH 值为2.5、4.0、6.6 和8.0 的培养液中分别培养0.5 h、1 h 和2 h 后,经荧光定量PCR 检测各组肌幼虫GAD 基因的转录水平。结果显示,在相同pH 培养条件下,随着培养时间的延长,siRNA1 组GAD 基因的转录水平均显著低于PBS组(P<0.05);在相同培养时间内,与PBS 和NC 组相比,随着培养液pH 值的减小,siRNA1 组肌幼虫GAD 基因的转录水平均升高;siRNA1 组肌幼虫在pH2.5 时GAD 基因的转录水平显著高于其pH6.6时GAD 基因的转录水平(P<0.05),在pH6.6 与pH8.0时该组肌幼虫GAD 基因的转录水平差异不显著(P>0.05);NC 组肌幼虫GAD 基因的转录水平无论是在不同的培养条件还是不同的培养时间均与PBS 组差异不显著(P>0.05)(图2)。表明酸性环境可以诱导旋毛虫肌幼虫GAD 基因转录水平的升高。

图2 不同培养时间和pH值条件下GAD基因转录水平的检测结果Fig.2 Expression of GAD gene under different culture time and pH value
2.4 不同酸环境培养GAD 基因干扰后的肌幼虫培养液GAD 的酶活性及其pH 值的测定结果将siRNA1 组、NC 组和PBS 组肌幼虫分别在pH 值为2.5、4.0、6.6 和8.0 的培养基中培养0.5 h 后,采用比色法绘制GABA 的标准曲线,根据标准曲线方程和酶活公式计算各组肌幼虫培养液中GAD 的酶活性;同时分别测定各组肌幼虫培养液的pH值。结果显示,绘制的标准曲线方程为y=0.1591x+0.0293,相关系数R2为0.9912,接近于1,符合线性化标准(图3A)。经计算结果显示,相同pH 条件下,siRNA1 组肌幼虫培养液中GAD 的酶活性均比PBS 组和NC 组低,且该组肌幼虫在pH2.5 和pH4.0 时GAD 的酶活性显著高于pH6.6 和pH8.0 时的该酶活性(P<0.05);不同pH 值培养条件下NC 组肌幼虫培养液中GAD 的酶活性均与PBS 组差异不显著(P>0.05)(图3B)。表明干扰GAD 基因后会降低肌幼虫GAD 的酶活性,且在酸性条件下该酶活性较高。
pH 值测定结果显示,siRNA1 组肌幼虫在不同pH 条件下培养后的pH 值均略升高,但均与PBS 组和NC 组培养液的pH 值差异不显著;且该组在pH 8.0 培养后pH 值略降低,但与两个组对照组差异均不显著(P>0.05)(图3C)。上述结果也显示,相同pH 条件下,随着培养液中肌幼虫GAD 酶活性的降低,该培养液中的pH 值则略升高,二者呈负相关性。表明TGAD 基因干扰后的旋毛虫肌幼虫调节细胞外pH 值的能力减弱。

图3 肌幼虫在不同pH培养0.5 h后GABA的标准曲线(A)、GAD酶活性(B)和pH值(C)的测定结果Fig.3 The GABA standard curve(A),the determination results of GAD enzyme activity(B)and pH(C)of Trichinella spiralis muscle larvae cultured with different pH for 0.5 h
2.5 GAD 基因干扰后的肌幼虫对小鼠的感染力及其子代保姆细胞影响的检测结果小鼠经口分别接种siRNA1 组、NC 组和PBS 组肌幼虫,感染后7 d 和42 d 迫杀各组小鼠后分别收集成虫及肌幼虫虫体,计算感染后7 d 小鼠机体成虫的减虫率及感染后42 d小鼠机体肌幼虫的减虫率、肌幼虫的RCI 及LPG(感染后42 d),采集感染后42 d 小鼠的膈肌,制作病理切片并经显微镜观察保姆细胞及其周围状态。结果显示,感染后7 d siRNA1 组小鼠机体旋毛虫成虫的减虫率为31.50%;感染后42 d,该组小鼠机体肌幼虫的减虫率为49.05%;感染后42 d siRNA1 组小鼠机体肌幼虫的RCI、LPG 分别为62.51±7.32 和1250.22±146.48,NC 组小鼠肌幼虫的RCI、LPG 分别为119.03±3.60 和2380.57±71.91,且均与siRNA1 组小鼠差异显著(P<0.05),但与PBS 组小鼠机体肌幼虫的RCI、LPG 差异均不显著(P>0.05)。表明GAD 基因干扰后的旋毛虫对宿主体内的抗酸能力降低,以至于对小鼠的感染力也降低。
感染后42 d 小鼠膈肌病理切片的观察结果显示, siRNA1 组小鼠机体内F1 代旋毛虫保姆细胞壁周围存在大量炎性细胞,保姆细胞裂解。NC 组和PBS 组肌幼虫保姆细胞周围未观察到炎性细胞,且保姆细胞完整(图4,箭头所指为保姆细胞)。表明GAD 基因干扰后的肌幼虫抗酸能力降低,对宿主体内免疫系统的抵抗力减弱。
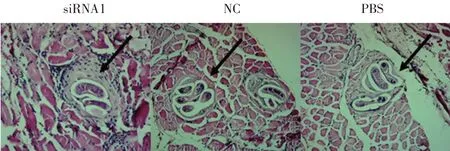
图4 各组小鼠膈肌中F1代肌幼虫保姆细胞的观察结果Fig.4 Nurse cells in the diaphragm of mice in each group
3 讨 论
胃液作为生态过滤器呈酸性,可以杀死大部分微生物,因此食源性致病菌必须经受极端的酸性环境才能通过胃进入肠道而感染、增殖,最终致宿主疾病的发生[9]。近年来有很多关于食源性致病菌抗酸机制研究,尤以致病性大肠杆菌抗酸系统的研究成果最为显著。旋毛虫作为一种食源性病原,其生活史决定旋毛虫肌幼虫必须通过宿主极酸的胃环境,在胃内停留数小时才能到达肠道,侵入小肠内引起宿主感染致病,这说明肌幼虫也应具有很强抗酸性环境的能力,但目前其是否存在抗酸机制尚未见报道。细菌耐酸性的判断依据是将其接种在pH2.0~pH2.5 的酸性培养基中培养2 h 后检测其存活率,若存活率大于10%就认定为该细菌具有抗酸性。本研究的前期预试验利用荧光定量PCR 方法,检测不同酸性条件下培养的肌幼虫GAD 基因mRNA的转录水平。结果显示,随着pH 值的降低,旋毛虫GAD mRNA 的转录水平逐渐升高,在pH2.5 时GAD mRNA 的转录水平显著高于pH4.0、pH6.6 和pH9.0 时的转录水平,并且培养不同时间后旋毛虫GAD mRNA 的转录水平也不同,培养1 h 旋毛虫GAD mRNA 的转录水平高于培养0.5 h 和2 h 的转录水平[4]。研究结果表明,强酸环境能显著诱导旋毛虫肌幼虫GAD 基因转录水平的升高。
RNAi 技术已被用于确定各种蠕虫中的特定关键基因,包括曼氏血吸虫、日本血吸虫、华支睾吸虫和旋毛虫。本研究利用siRNA 干扰旋毛虫GAD基因的表达后将其分别置于pH2.5、pH4.0、pH6.6和pH8.0的培养液中分别培养0.5 h、1 h和2 h后,检测旋毛虫的抗酸性,结果表明GAD基因干扰后旋毛虫的抗酸性降低,旋毛虫的抗酸性与其GAD基因相关。
AR2 的抗酸能力与细胞中谷氨酸的含量有关,当谷氨酸含量降低时,该系统将不能有效调节细胞内的pH 值,进而会导致旋毛虫的死亡。当在体外酸性环境中培养GAD 基因干扰后的旋毛虫,荧光定量PCR 结果显示,pH2.5 时旋毛虫GAD 基因的转录水平显著高于pH6.0 时GAD 基因的转录水平,但在pH6.0 的条件下时旋毛虫的存活率高于pH2.5 时的存活率,这说明酸刺激虽然可以诱导GAD 基因的高转录但并不意味着会提高旋毛虫的存活率。GAD 是一种吡哆醛5′-磷酸(PLP)依赖性酶,其活性的最适pH值为3.8~4.6,具有六聚体的晶体结构。在中性pH下,GadB(GAD 酶的一种形式)仅位于细胞质中,而在酸性条件下,它被募集到细胞膜中,并在此与Glu/GABA/GadC 协同作用[4]。体外酸性环境培养GAD基因干扰后的旋毛虫,培养2 h 后与PBS 组和NC 组相比,其培养液的pH 值升高不明显。在相同pH 条件下培养旋毛虫, siRNA1 组旋毛虫GAD 的酶活性比PBS 组低,且在pH2.5 和pH4.0 时该组旋毛虫GAD的酶活性高于pH6.6和pH8.0的该酶活性,结果证明通过siRNA干扰旋毛虫的GAD基因会降低其GAD的酶活性,该酶在酸性条件下的活性高,该结果与GAD的生物特性相符[5]。利用GAD 基因干扰的旋毛虫感染小鼠,siRNA1组小鼠的成虫减虫率为31.5%,肌幼虫的减虫率为49.05%。是因为与两个对照组相比,GAD基因干扰后的旋毛虫耐受胃部酸性环境的能力减弱,当经过胃部时会有大量旋毛虫死亡,因此获得成虫和肌幼虫的数量减少,因而相应的减虫率会升高。
保姆细胞是新生幼虫侵入宿主肌细胞后在原肌细胞的基础上结合毛细血管而形成的一种独立的结构,是新生幼虫在宿主体内生存的保护屏障。siRNA1 组小鼠膈肌的病理切片观察结果显示, GAD 基因干扰后,子代旋毛虫的保姆细胞周围存在大量炎性细胞,这些炎性细胞会破坏保姆细胞壁的结构,使旋毛虫幼虫失去保护屏障,致其存活率降低,这可能与旋毛虫GAD 基因干扰后的抗酸能力降低,子代肌幼虫抵抗宿主免疫应答的能力减弱有关。以上结果均表明GAD 基因干扰后旋毛虫的抗酸能力减弱,且旋毛虫的抗酸能力与GAD 基因相关。
本研究证明siRNA 可以干扰旋毛虫GAD 基因的表达,并通过对GAD 基因干扰后的肌幼虫体外和体内抗酸能力的研究,证明GAD 在旋毛虫耐受胃酸环境时发挥了重要作用。利用siRNA 干扰技术能够使旋毛虫耐酸能力发生改变,为预防旋毛虫病提供了新思路。
