前列腺癌患者癌组织中miR- 183- 5p表达的意义及其诊断价值分析
2022-04-25吴继宏梁泰生高宏君罗向东吴刚
吴继宏,梁泰生,高宏君,罗向东,吴刚
(广西中医药大学附属瑞康医院 泌尿外科,广西 南宁 530000)
前列腺癌(prostate cancer,PCa)在年龄≥50岁的男性中较常见,随年龄增长,其患病风险相应增高。该病发病危险因素包括不良饮食习惯、遗传史、年龄等,是导致男性肿瘤患者死亡的重要因素之一[1- 2]。研究表明PCa具有无限生长倾向以及转移风险高的特点,但该病早期缺乏典型症状,患者不易察觉,当出现明显症状时,通常已进展至中晚期,肿瘤生长可累及周围组织,或伴有转移,错过最佳干预时机,预后较差[3]。因此,尽早对PCa进行诊断是改善预后的关键。由于该病的发病机制比较复杂,涉及一系列基因、蛋白等的参与,临床仍需探索相关的基因、蛋白作为肿瘤标志物,为PCa诊疗提供新靶点。目前,已有大量研究提示微小核糖核酸(microRNA,miR)与细胞分化、代谢、增殖等过程有关,在PCa、肝癌、肺癌等恶性肿瘤中具有调节功能[4]。朱龙萍等[5]指出miR- 183- 5p在食管鳞状癌组织中呈高表达,其表达可能与淋巴结转移有关。还有研究发现子宫内膜癌组织中可见miR- 183- 5p表达下调,具有抗肿瘤活性[6]。这表明miR- 183- 5p表达与肿瘤发生有关,且在不同肿瘤中的表达存在特异性。Larne等[7]研究则提示miR- 183可能通过调节前列腺特异性抗原(PSA)水平影响PCa的进展。miR- 183- 5p是从miR- 183前体的5′端臂加工而来,间接推测miR- 183- 5p异常表达可能也会影响PCa患者的病情。基于此,本研究探讨PCa患者癌组织中miR- 183- 5p的表达水平及其诊断价值,以期协助该病的早期诊疗。
1 资料与方法
1.1 一般资料
选择我院2018年9月至2021年5月收治的PCa患者117例作为PCa组,同期收治的良性前列腺增生(benign prostatic hyperplasia,BPH)患者65例为BPH组。纳入标准:(1) PCa组:病理诊断为PCa的首诊患者;就诊时无急性或慢性炎症者;术前未行新辅助治疗者;自愿签署同意书者。(2) BPH组:临床诊断为BPH而行电切手术治疗者;就诊时无急性或慢性炎症者;自愿签署同意书者。排除标准:患严重心脑血管疾病(例如急性心肌梗死、脑卒中等)者;患其他部位的原发性肿瘤者;因PCa复发就诊者;既往有血液系统疾病、自身免疫性疾病、传染性病史者;急性尿潴留者。研究方案获医院伦理委员会批准,两组患者年龄、体质指数、前列腺体积、高血压史、糖尿病史等比较差异无统计学意义(P>0.05),见表1。
表1 两组患者基线资料比较
1.2 检测方法
通过手术获取组织样本,利用实时逆转录聚合酶链反应(quantitative real- time reverse transcription polymerase chain reaction,qRT- PCR)测定组织中miR- 183- 5p表达水平。主要仪器为荧光定量PCR仪(江苏迅睿生物技术有限公司,MA- 688型)、电热恒温水槽(上海森信实验仪器有限公司,DK- 8D型)、离心机(湘仪离知机仪器有限公司,YXJ- 2型)。主要试剂为乙醇、异丙醇、氯仿、逆转录试剂、PCR检测试剂,购自美国GIBCO公司。首先利用Trizol试剂对组织总RNA进行提取,取组织样本0.5 cm×0.5 cm×0.5 cm,置入研钵内,并加液氮,研磨,加裂解液,待裂解充分后移至EP管内,振荡,促使组织团块消失。加入0.2 ml氯仿,4 ℃下离心15 min(12 000 r·min-1),待离心完毕,可见3层水相,取上层无色水相置于EP管内,加入0.6 ml异丙醇,室温下反应10 min。4 ℃下离心10 min(12 000 r·min-1),对总RNA管底沉淀物进行观察,弃上清液。加入1.0 ml 75%乙醇,4 ℃下离心5 min(12 000 r·min-1),弃上清液。再次4 ℃下离心10 min(12 000 r·min-1),对总RNA管底沉淀物进行观察,弃上清液。风干3 min,加入DNA酶Ⅰ 30 μl,促进溶解、混匀。检测RNA样本浓度与纯度,A260 nm/A280 nm值范围需在1.8~2.1之间,确定样本符合要求后,存至-80 ℃温度下。采用逆转录试剂对样本进行逆转录,合成cDNA,行qRT- PCR扩增,并采用荧光定量PCR仪进行检测。PCR反应条件:94 ℃ 3 min预变性;94 ℃ 30 s变性,50 ℃ 30 s退火,72 ℃ 60 s延伸,45个循环。引物序列:(1) miR- 183- 5p上、下游序列分别为5′- GGTTTCATCCAGGATCGAGCAGG- 3′、5′- ACAAAGATGGTCACGGTCTGCC- 3′;(2) 内参引物U6上、下游序列分别为5′- CTCGCTTCGGCAGCACA- 3′、5′- AACGCTTCACGAATTTGCGT- 3′。采用2-ΔΔCt法表示miR- 183- 5p相对表达量。
1.3 统计学处理
采用SPSS 20.0软件行数据分析,分别以常数(百分比)、均数±标准差表示计数、计量资料,分别行χ2、独立样本t检验。绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析miR- 183- 5p诊断PCa的曲线下面积(area under the curve,AUC),利用Kappa检验分析miR- 183- 5p与病理诊断PCa的一致性,Kappa值范围-1~1,越接近-1或1表明一致性越高,通常在0~1间,该值范围0.1~0.20、0.21~0.40、0.41~0.60、0.61~0.80、≥0.81分别表示一致性极低、轻度一致性、中度一致性、高度一致性、完全一致。P<0.05为差异具有统计学意义。
2 结 果
2.1 两组样本组织内miR- 183- 5p表达比较
miR- 183- 5p表达量PCa组为3.96±1.03,BPH组为1.86±0.76,PCa组表达量高于BPH组(t=14.397,P<0.001)。根据PCa组miR- 183- 5p表达量均值将PCa组分成高表达组(表达量>3.96,65例)与低表达组(表达量≤3.96, 52例)。
2.2 miR- 183- 5p表达与PCa病理特征的关系
miR- 183- 5p高表达组血清PSA水平≥20 ng·ml-1、Gleason评分≥7分、肿瘤低分化、肿瘤分期Ⅲ期、肿瘤直径≥3 cm、血管间隙浸润、肿瘤转移者占比均高于miR- 183- 5p低表达组(P<0.05),见表2。
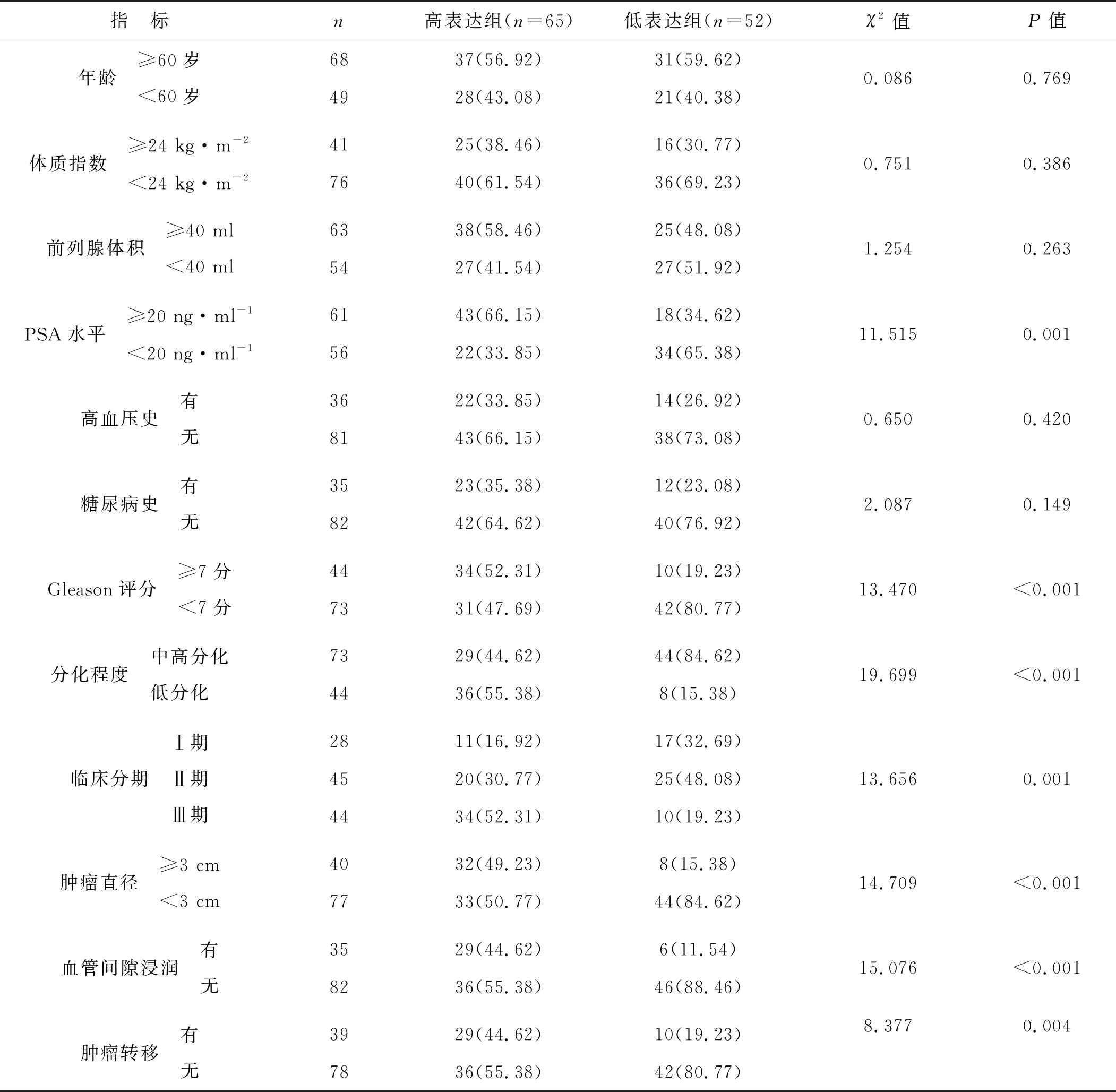
表2 miR- 183- 5p表达与PCa病理特征的关系 例
2.3 miR- 183- 5p表达量对PCa的诊断价值分析
miR- 183- 5p表达量诊断PCa的AUC为0.898(标准误=0.024,P<0.001,95%CI为0.851~0.945),最佳界值为2.490,敏感度为86.32%,特异度为86.15%,见图1。

图1 miR- 183- 5p表达量诊断PCa的ROC曲线
2.4 miR- 183- 5p表达量与病理诊断PCa的一致性分析
纳入的182例研究对象中,病理诊断为PCa 117例,BPH 65例,而miR- 183- 5p诊断提示PCa 110例,BPH 72例。以病理诊断为金标准,经miR- 183- 5p检出的110例PCa患者中有101例与病理诊断相符,72例BPH患者中有56例与病理诊断相符。miR- 183- 5p表达水平诊断PCa的敏感度为86.32%(101/117),特异度为86.15%(56/65),准确率为86.26%(157/182),阳性预测值为91.82%(101/110),阴性预测值为77.78%(56/72)。Kappa检验提示miR- 183- 5p表达量与病理诊断PCa具有高度一致性(Kappa值=0.708,P<0.001)。
3 讨 论
PCa是中老年男性的常见病,近年来我国PCa患病率逐年增高。由于早期症状比较隐匿,导致多数患者就诊时病情已进展得比较严重,常伴有骨转移,因而治疗难度与死亡率较高[8]。研究表明,miRNA能与靶基因3′- URT结合,或者对靶基因miRNA进行降解,影响癌细胞的凋亡及增殖,发挥抑癌或促癌作用,miRNA对肿瘤细胞的调节已成为临床研究热门课题[9]。肿瘤的发生与进展过程涉及机制复杂,在肿瘤进展期间可见相关miRNA表达水平增高或下降,促进或抑制癌细胞分化、增殖与凋亡,通过分析相关miRNA在PCa组织中的表达,能为PCa的早期诊断提供依据。
miR- 183- 5p具有促癌作用,它能通过对α- 1- B糖蛋白进行靶向调控,促进癌细胞增殖与迁移[10]。另有研究指出miR- 183- 5p表达失调与PCa发生有关[11]。本研究发现与BPH组织相比,PCa组织中miR- 183- 5p表达量增高,提示miR- 183- 5p在PCa中发挥了促癌作用。miR- 183- 5p是miR- 183基因簇的重要成员,而miR- 183在肿瘤中可见异常表达[12]。miR- 183- 5p作为miR- 183基因簇中的一员,也与肿瘤疾病存在密切关系,它在膀胱癌组织中可见表达上调,其可能通过调节某些相关信号通路(例如上皮间质转化通路),促进膀胱癌进展[13]。miR- 183- 5p可能靶向程序性细胞死亡因子4抑制肿瘤细胞凋亡,促进肿瘤进展[14]。外泌体介导的miR- 183- 5p能够从肿瘤细胞移至巨噬细胞,可对肿瘤相关巨噬细胞表型进行调节,加速肿瘤发展与转移,这可能是miR- 183- 5p的促癌机制[15]。
PCa的病理特征比较复杂,在肿瘤进展过程中,相关癌基因的表达可能受不同病理特征影响,通过明确其表达与病理特征的关系,有利于进一步明确肿瘤进展机制[16]。本研究结果显示,癌组织中miR- 183- 5p表达与PCa患者的血清PSA水平、Gleason评分、肿瘤分化程度、肿瘤分期、肿瘤直径、血管间隙浸润、肿瘤转移相关。PSA是典型的PCa标志物,对这类肿瘤筛查有一定价值,其浓度与前列腺细胞数目存在关联,当前列腺组织受损后可见血PSA水平增高,当PSA水平超过20 ng·ml-1时,提示极有可能为PCa[17]。但有研究认为单纯采用血PSA水平诊断PCa时的特异度非常低[18]。肿瘤分化程度、临床分期、肿瘤直径、有无转移与浸润是评估肿瘤进展程度的常见病理特征,肿瘤进展越严重,临床分期越高,分化程度越低,生长速度越快,转移与浸润风险越大。癌组织中miR- 183- 5p表达与上述病理特征有关,原因可能为miR- 183- 5p在PCa中有促癌作用,其表达增高能促进癌细胞增殖,致病灶恶性程度增强,加速病情发展。本研究结果显示,癌组织中miR- 183- 5p表达对PCa有一定诊断价值,与病理诊断具有较高一致性。Pudova等[19]发现,miR- 183- 5p与PCa淋巴结播散有关,其参与了PCa进展。本研究则更深入阐述了癌组织中miR- 183- 5p表达对PCa的诊断价值,证实其与病理诊断一致性高,临床有望将其作为预测或诊断PCa的靶标。
综上所述,PCa组织中miR- 183- 5p表达增高,其表达变化与PCa患者多种病理特征有关,对PCa诊断有一定价值。此外,本研究也存在不足,仅分析了miR- 183- 5p在PCa组织中的表达水平,尚未进行体外实验明确miR- 183- 5p的靶基因,日后有待对此深入探讨。
