癫痫患儿血清脯氨酸肽酶活性、丙二醛水平与注意缺陷多动障碍的关系研究
2022-04-25刘锐林尧陈小建韩淑莉
刘锐,林尧,陈小建,韩淑莉
(1.海口市妇幼保健院 儿童保健科,海南 海口 570203; 2.中南大学湘雅医学院附属海口医院 儿科,海南 海口 570203)
注意缺陷多动障碍(attention deficit hyperactivity disorder,ADHD)是一种常见的儿童期发病的行为学疾病,以癫痫患儿的发病风险更高[1]。而且由于ADHD通常被误认为是癫痫发作的一种形式,或者是抗癫痫药物的副作用,因此在临床上易被忽略。癫痫与精神障碍共病的病理生理机制复杂,潜在的大脑病理学、神经信号紊乱、反复发作、癫痫脑电图放电以及环境和遗传易感性等都与之息息相关[2]。尤其是氧化应激机制已被证实与多动症风险增加之间存在线性关系[3]。而癫痫患儿频繁的癫痫发作增加了大脑中活性氧自由基的产生,这使他们更容易患上心理和认知障碍。脯氨酸肽酶(prolidase,PEPD)是胶原蛋白生物合成所必需的,血清中PEPD活性升高与多种疾病如肺癌、高血压、静脉曲张等的氧化应激状态相关[4]。丙二醛(malondialdehyde,MDA)是一种脂质过氧化的最终产物,反映机体的抗氧化应力[5]。氧化应激和血清PEPD活性升高在包括癫痫在内的许多神经系统疾病中都会发生,然而其对精神共病发展的影响尚缺乏足够的数据支持。本研究旨在评估血清PEPD活性、MDA水平变化与癫痫患儿发生ADHD的关系,以期为临床治疗提供参考。
1 对象与方法
1.1 研究对象
本项前瞻性病例对照研究于2020年2月至2021年4月在海口市妇幼保健院儿科开展,符合《赫尔辛基宣言》的原则,由海口市妇幼保健院医学伦理委员会审核及批准,并获得受试儿童父母或法定监护人的书面知情同意。共纳入122例特发性癫痫患儿作为研究对象,患儿年龄6~16岁,中位年龄8岁,男85例,女37例。根据《精神障碍诊断与统计手册》(DSM- V)标准(美国精神医学学会,2013年),62例患儿符合ADHD诊断而设为ADHD组,其余患儿则纳入无ADHD组。病例纳入标准:(1) 符合文献[6]中癫痫的诊断标准;(2) 体格检查无异常,在随访中获得临床、生化、脑电图和脑磁共振成像表现记录。排除标准:(1) 患有急性或慢性疾病如心血管、内分泌、呼吸、肝脏、肾脏疾病或神经肌肉功能障碍;(2) 使用经过验证的心理测试,被筛选出合并任何心理障碍方面的疾病如焦虑、抑郁、分裂性精神障碍。另外选择同期在该院进行体格检查的健康儿童60例作为对照组,均既往健康、神经系统查体未见异常,父母或监护人愿意完成问卷,且Conners儿童行为问卷得分≤60分;此外对照组儿童未使用任何药物,且年龄、性别与癫痫患儿相匹配。
所有患儿都有详细的病史,包括社会人口学数据、围产期事件、神经和精神行为表现、症状发作年龄、病程、用药史,以及在过去12个月中癫痫发作的频率和反应;进行了全身和神经系统的临床检查。癫痫类型根据国际抗癫痫联盟分类和术语委员会的分类标准确定;癫痫发作严重程度用国立医院癫痫发作严重程度量表(NHS3)评估,评分范围1~27分,分数越高表明发作程度越严重。如果过去12个月没有发生癫痫发作,则认为癫痫得到了控制。
1.2 ADHD的诊断
入组儿童及其生活在一起的父母或法定监护人都被询问和评估。根据《精神障碍诊断与统计手册》(DSM- V)标准进行诊断,包括注意缺陷、主要表现为多动/冲动症状和组合症状。利用Conners儿童行为问卷(共43项,每项0~3分)对儿童行为进行评估,该问卷是一个用于筛查儿童和青少年多动症的诊断工具,包括认知问题、对立、多动冲动、焦虑害羞和社会问题。问卷得分>60分表明有ADHD,61~70分表明中度严重,70分以上表明问题更严重。测试时间60~90 min。
1.3 血清生化指标检测
血清样本从受检儿童的生化试管中分离获取。于清晨抽取空腹静脉血2 ml,4 ℃、3 000 r·min-1离心25 min,收集血清样本,-80 ℃保存备用。采用生物素双抗体夹心技术,根据杭州东方生物医药有限公司生产的试剂盒,用酶联免疫吸附法(ELISA)测定血清PEPD活性。组内和组间的变异系数均<10%。用硫代巴比妥酸法测定血清MDA水平,并在532 nm处测定粉红色络合物的分光光度。在240 nm处测定过氧化氢酶对H2O2底物的分解速率。另外根据Erel等描述,采用分光光度法和HITACHI全自动生化分析仪(日本HITACHI)测定血清总抗氧化状态(total antioxidant status,TAS)和总氧化状态(total oxidant status,TOS),氧化应激指数(oxidative stress index,OSI)用TOS与TAS比值描述。
1.4 统计学处理
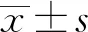
2 结 果
2.1 3组儿童一般资料比较
ADHD组、无ADHD组及对照组3组受试儿童年龄、性别等比较,差异均无统计学意义(P>0.05);ADHD组与无ADHD组患儿首次发作年龄、病程、NHS3评分、药物治疗方式、癫痫类型和1年内癫痫发作控制情况比较,差异亦无统计学意义(P>0.05)。见表1。
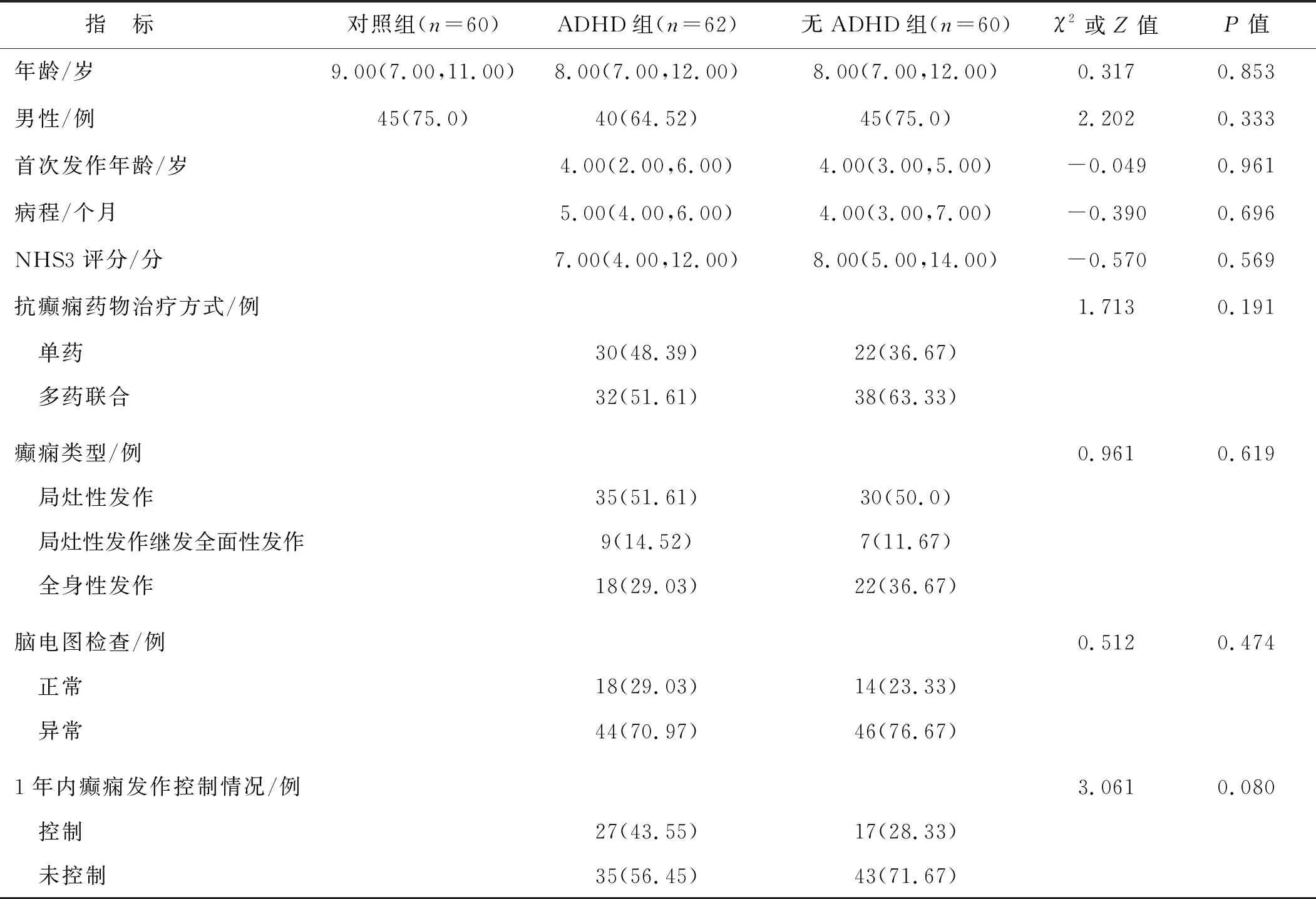
表1 3组受试儿童一般临床资料比较
2.2 3组儿童血清PEPD活性、MDA水平及氧化应激状态比较
3组间血清PEPD活性、MDA水平及氧化应激状态比较,差异有统计学意义(P<0.05);ADHD组和无ADHD组患儿PEPD活性、MDA水平及TOS、OSI值均高于对照组,TAS值低于对照组;ADHD组患儿血清PEPD活性、MDA水平及OSI值均高于无ADHD组(P<0.05)。见表2。
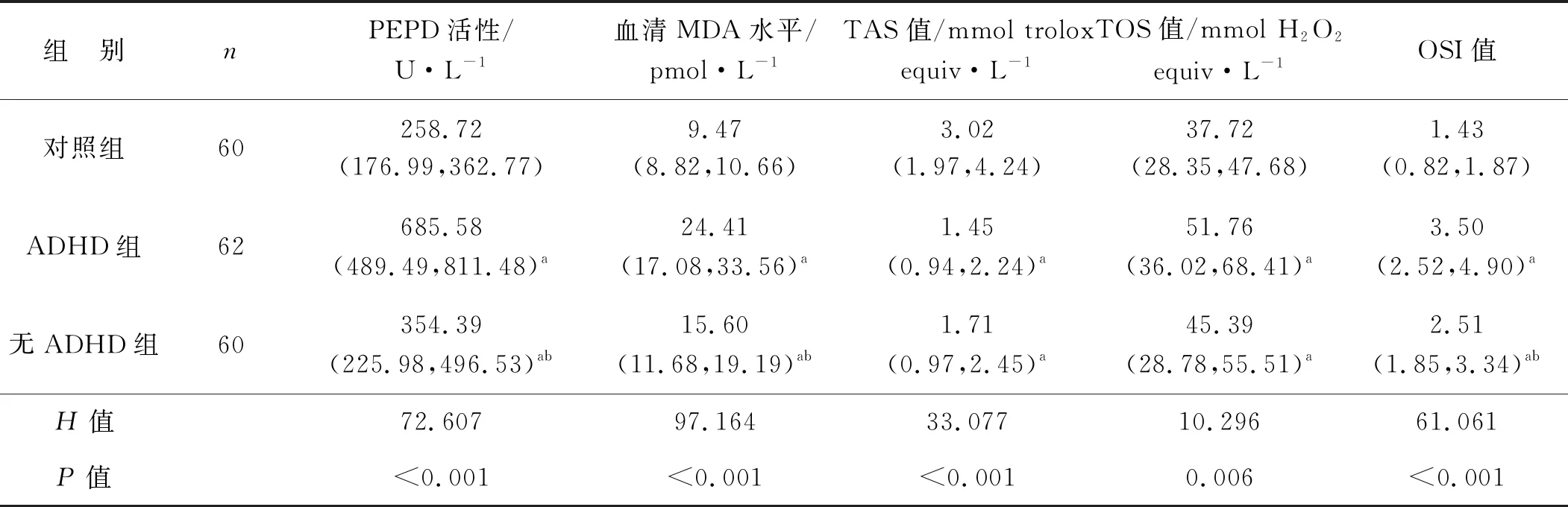
表2 3组儿童血清PEPD活性、MDA水平及氧化应激状态比较[M50(P25,P75)]
2.3 ADHD组患儿PEPD活性、MDA水平与氧化应激状态的关系
Pearson法分析显示, ADHD患儿血清PEPD活性与TOS值相关(r=0.411,P<0.05),血清MDA水平与TAS值相关(r=-0.432,P<0.05),血清PEPD活性、MDA水平均与OSI值相关(分别r=0.505、r=0.595,P<0.05)。
2.4 多因素Logistic回归分析
以是否发生ADHD作为因变量,将ADHD组与无ADHD组患儿基本临床资料进行单因素分析显示,血清PEPD活性、MDA水平、OSI值与ADHD的发病风险有关(P<0.05);将这3个变量纳入多因素Logistic回归模型,结果显示,血清PEPD活性、MDA水平是影响癫痫患儿ADHD发生风险的独立危险因素(P<0.05)。见表3。
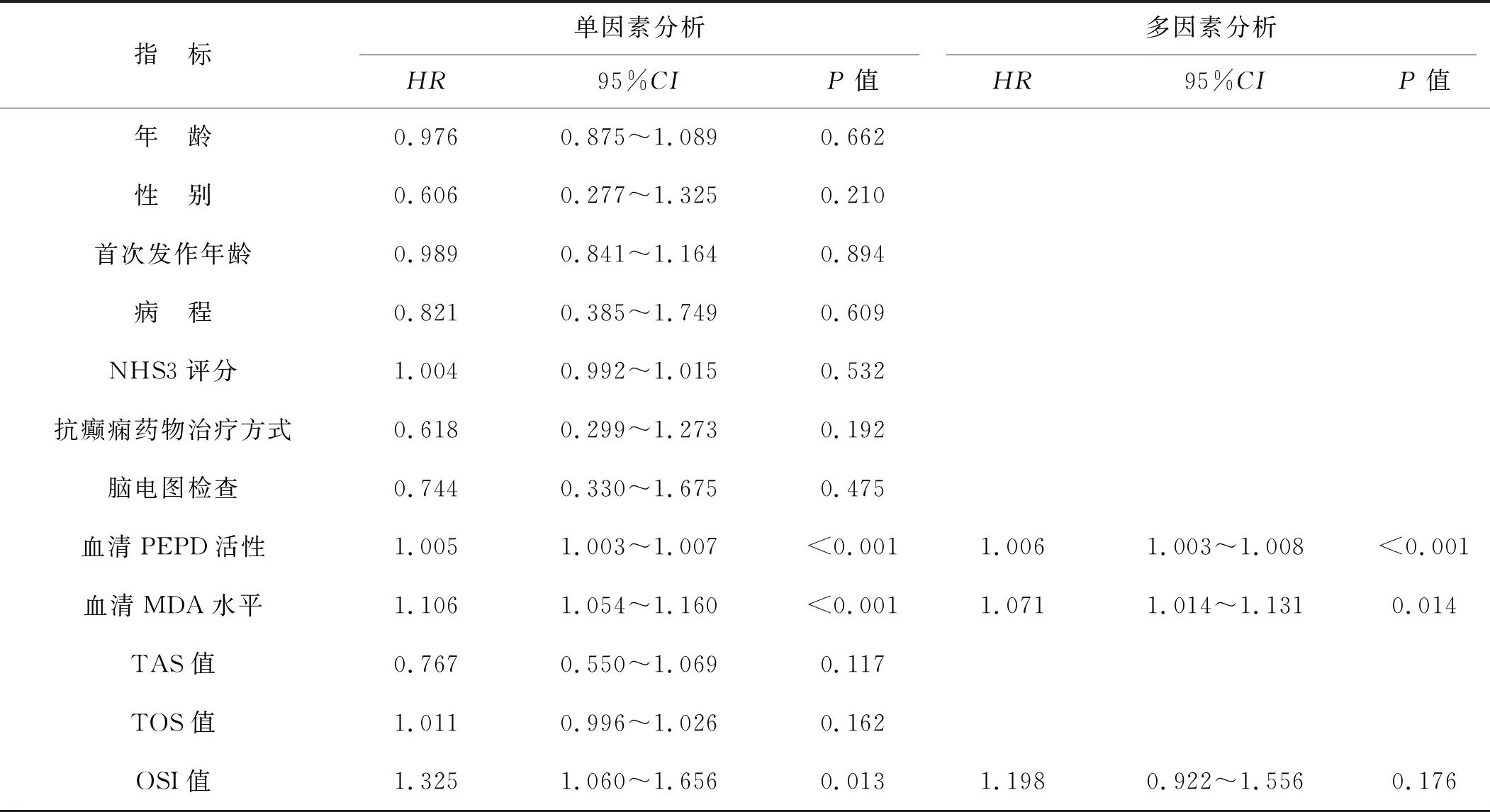
表3 单因素和多因素Logistic回归分析
2.5 ROC曲线分析
ROC曲线分析显示,血清PEPD活性、MDA水平诊断癫痫患儿ADHD发生的曲线下面积(area under curve,AUC)分别为0.817(95%CI为0.741~0.894)、0.760(95%CI为0.674~0.847),对应截断值分别为535.335、20.755,特异度分别为86.7%、78.3%,敏感度分别为71.0%、66.1%。将血清PEPD活性、MDA水平进行多因素Logistic回归分析,得到回归方程:Y=-3.830+0.005X1+0.072X2(X1:血清PEPD活性;X2:血清MDA水平),计算联合诊断概率,根据联合诊断概率值绘制ROC曲线,AUC为0.838(95%CI为0.767~0.909),特异度和敏感度分别为81.7%和77.4%。
3 讨 论
癫痫是一种慢性疾病,其特征是由整个皮层或局部大脑区域的神经元过度兴奋引起的反复发作[7]。而ADHD是癫痫儿童常见的合并症之一[8]。两者共病的病理生理机制是复杂的,包括潜在的脑病理学、癫痫的慢性影响、抗癫痫药物的影响等[9]。在本研究中,癫痫患儿血清PEPD活性、MDA水平均高于对照组,且血清PEPD活性和MDA水平升高是增加ADHD发病风险的独立危险因素,这两项指标变化均与机体的氧化应激状态有关,说明氧化应激可能是癫痫患儿发生ADHD的重要机制之一。
PEPD是一种蛋白酶,可将酰亚胺肽降解为脯氨酸或羟脯氨酸残基,在胶原蛋白代谢中起重要作用[10]。目前已在红细胞、白细胞、真皮成纤维细胞及肾、脑、心脏、胸腺、子宫中检测到PEDP。广泛的组织分布表明,PEPD的变化可能在某些疾病的发病机制中起重要作用[11]。然而关于血清PEPD活性与癫痫发作的关系一直存有争议。例如Ayas等[12]已经通过检测原发性全身性癫痫成人患者血清PEPD活性,证实其与癫痫发作无关。而在本研究中,我们却得出癫痫患儿血清PEPD活性较健康儿童普遍升高的结果,这与Karacan等[13]的研究结果一致。这可能与病例纳入标准有关,Ayas等[12]的研究主要纳入的是50岁以上患者(年龄范围18~88岁),多数患者存在基础性疾病,且年龄越大胶原蛋白代谢越慢;而本研究纳入的主要是癫痫患儿,机体代谢过程处于快速阶段,因此与胶原蛋白代谢密切相关的PEPD则更易因应激因素的影响出现波动。此外,我们还发现癫痫儿童的氧化抗氧化能力与血清PEPD活性之间存在相关性。MDA是脂质过氧化最常见和最有害的产物之一,可能导致细胞损伤[14]。因此,血清MDA的测定可用于评估脂质过氧化引起的氧化应激或损伤的强度,并反映机体的抗氧化应力。本研究中,癫痫患儿中血清PEPD活性和MDA水平显著升高,说明机体存在异常氧化应激状态。而活性氧引起的脂质过氧化可能干扰正常的膜兴奋性和涉及多巴胺能及5- 羟色胺能系统的神经传递,从而诱发多动症。
ADHD是一种神经行为障碍,由额叶纹状体大脑网络中断引起,癫痫发作或结构性脑损伤对这些大脑网络的破坏可导致ADHD样症状或行为问题[15]。早发性、更频繁和(或)更严重癫痫发作的患儿发生ADHD的风险更大。由PEPD活性增加引起的氧化应激和炎症在癫痫的发病机制中起重要作用。自由基释放过多导致的氧化应激可能在癫痫的发生和发展中发挥作用,进而导致神经变性风险增加。大脑对氧化应激特别敏感,增加的PEPD可导致脯氨酸和羟脯氨酸水平增加[16]。
综上,癫痫患儿血清PEPD活性及MDA水平显著增加,说明癫痫患儿的氧化- 抗氧化状态与ADHD发病风险之间存在关联[16]。检测血清PEPD活性、MDA水平对预测癫痫患儿ADHD发生风险能够提供一定的参考信息。本研究尚处于初步探索阶段,需要更大的临床样本以证实本研究结论的可靠性。
