沙库巴曲/缬沙坦对应激性心肌病大鼠室性心律失常的影响及其机制
2022-04-25孙亚洲刘韬石少波刘欣冉倩杨波
孙亚洲 刘韬 石少波 刘欣 冉倩 杨波
应激性心肌病又称Takotsubo综合征(TTS),是一种急性、通常可逆的心力衰竭(简称心衰)综合征。既往认为TTS是一种良性疾病,但最近的研究发现,TTS急性期的死亡率与急性冠脉综合征相当[1]。TTS可并发心衰、心源性休克、左室流出道梗阻、系统性血栓栓塞和心律失常[2-3]。其中,1/4以上TTS患者急性期出现多种心律失常[4]。TTS主要发生于绝经后女性[2],而室性心律失常更常见于男性TTS患者[4]。此外,男性TTS患者更容易出现室性心动过速、心脏骤停等危及生命的心律失常,故更需关注男性TTS患者的心律失常事件[4]。沙库巴曲(SAC)/缬沙坦(VAL)是由内啡肽酶抑制剂沙库巴曲和血管紧张素受体阻滞剂缬沙坦组成的复方药物。临床研究表明,SAC/VAL在急性失代偿心衰中具有较好的心脏保护作用[5]。基础研究也验证了SAC/VAL在心衰、心肌梗死、心肌肥厚甚至肺动脉高压和右心衰等多种病理情况下均可改善心室功能[6-7]。此外,在兔心房颤动模型中,SAC/VAL可恢复Cav1.2表达,延长心房有效不应期,减轻心房结构重塑[8];同样,SAC/VAL可上调钾通道蛋白的表达,降低心肌梗死诱导的心衰大鼠模型室性心律失常易感性[9]。以上研究结果均表明SAC/VAL具有抗心律失常潜质,但SAC/VAL对TTS室性心律失常的作用尚不清楚。本研究采用单次大剂量注射异丙肾上腺素(ISO)构建TTS大鼠模型,短期给予SAC/VAL和VAL,探究SAC/VAL和VAL对TTS室性心律失常的作用。
材料与方法
1.材料:60只野生型雄性SD大鼠(体重200~220 g)购自三峡大学动物实验中心,饲养于武汉市第三医院实验动物中心。所有实验流程已通过武汉市第三医院实验动物伦理审定委员会批准(SY2020-002)。
2.方法
(1)模型制作:将雄性SD大鼠随机分为4组:对照组(CTL组)、TTS组、SAC/VAL组、VAL组,每组各15只。CTL组大鼠予无菌生理盐水(1 ml/kg)腹腔注射(IP),其余3组大鼠均予ISO(50 mg·ml-1·kg-1)IP,24 h后行灌胃处理。CTL组和TTS组大鼠给予生理盐水灌胃,SAC/VAL组大鼠给予SAC/VAL 68 mg/kg灌胃,VAL组大鼠给予VAL 31 mg/kg灌胃。
(2)超声心动图检查:所有大鼠在生理盐水或ISO注射后2 d和7 d进行经胸超声心动图检查。大鼠麻醉后,平卧于自制的恒温发热垫上。使用vivo成像系统(VINNO 6 VET超声系统)和18 MHz探头进行经胸超声心动图检查,胸骨旁左心室长轴切面运动减弱或无运动区域>左心室内膜周长的10%表明TTS模型建立成功。在胸骨旁左心室短轴测定左心室心尖部和左心室心底部的短轴缩短率(FS),FS=[舒张期左心室内径(mm)-收缩期左心室内径(mm)]/舒张期左心室内径(mm)[10]。
(3)离体电生理检测:在生理盐水或ISO注射后8 d,按照既往流程[11]进行离体电生理检测。大鼠麻醉后,快速取出心脏,将心脏连接到Langerdorff灌流系统(AD Instruments),系统中含有正常的Tyrode溶液,包括氯化钠135 mmol/L、氯化钾5.4 mmol/L、氯化镁1.0 mmol/L、氯化钙1.8 mmol/L、磷酸氢二钠0.3 mmol/L、羟乙基哌嗪乙硫磺酸10 mmol/L、葡萄糖10 mmol/L,用氢氧化钠将pH值调至7.35~7.45。用2个定制的Ag-AgCl电极在左心室基底部和左心室心尖部记录心室单相动作电位。使用PowerLab系统(AD Instruments)对所有信号进行测量,并使用Chart 8.0软件记录所有信号。采用S1S2方案测量心室有效不应期(ERP),由8个连续的基本刺激(S1)[起搏周期长度(PCL)为200 ms]和一个提前的刺激(S2)组成,S2的PCL由100 ms逐步降低至1 ms,ERP定义为S2未能捕获心脏的最长S1S2间隔。S1S1方案由10个连续刺激(S1)组成,记录PCL为200 ms时心室动作电位持续时间(APD),计算90%复极时间(APD90)。采用Burst起搏法测定室性心律失常易感性,室性心律失常的诱发刺激电极发放Burst刺激(50 Hz),每次刺激持续2 s,如未诱发出室性心律失常则间隔2 s再次发放,共发放20次,如诱发出持续时间超过2 s的不规则电活动则记为室性心律失常可诱发,计算每组大鼠室性心律失常诱发率。
(4)Masson染色:大鼠麻醉后,迅速取出心脏,采用5%福尔马林固定。取左心室心底部和左心室心尖部组织固定,按Masson染色标准方法进行染色,采用Image J软件测量心肌纤维面积分数。
(5)蛋白质免疫印迹法(Western blot):大鼠在深度麻醉状态下处死,迅速取出心脏左心室心尖组织,液氮冷冻。 采用Western blot检测RyR2、磷酸化的RyR(p-RyR2)[RyR2-S2814,RyR2有两个磷酸化位点,分别为S2808和S2814。S2808为蛋白激酶A(PKA)的磷酸化位点,而S2814为Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)的磷酸化位点。PKA介导的RyR2磷酸化不影响心肌细胞对β受体的反应性,RyR2-S2808突变也不改变慢性应激所致的心肌重构[12]。而CaMKⅡ介导的RyR2-S2814参与心律失常的发生[13]。故本研究中只检测RyR2-S2814的水平。]、Smad3、CollagenⅠ、转化生长因子(TGF)-β1、CaMKⅡ、磷酸化的CaMKⅡ(p-CaMKⅡ)蛋白水平,GAPDH作为内参。采用Image J软件对Western blot图像进行扫描和分析。
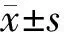
结 果
1.4组大鼠超声心动图检查结果比较:生理盐水或ISO注射后2 d,TTS组、SAC/VAL组、VAL组心尖部FS均明显低于CTL组(P<0.001),而4组大鼠心底部FS比较差异均无统计学意义(P>0.05)。生理盐水或ISO注射后7 d,4组大鼠心底部、心底部FS比较差异均无统计学意义(P>0.05)。见表1。
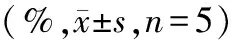
表1 4组大鼠超声心动图检查结果比较
2.4组大鼠心尖部ERP、APD90及室性心律失常发生情况比较:4组大鼠心尖部ERP、APD90比较差异均无统计学意义(P>0.05)。见表2。CTL组、TTS组、SAC/VAL组、VAL组大鼠室性心律失常发生率分别为0(0/10)、80%(8/10)、20%(2/10)、50%(5/10),其中TTS组高于CTL组,SAC/VAL组低于TTS组(P<0.05),而TTS组和VAL组比较差异无统计学意义(P>0.05)。
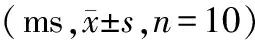
表2 4组大鼠心尖部ERP和APD90比较
3.4组大鼠左心室心尖部和心底部纤维化面积分数比较:4组间大鼠左心室心尖部纤维化面积分数比较差异有统计学意义(P<0.05),其中TTS组高于CTL组,SAC/VAL组低于TTS组(P<0.05),SAC/VAL组和VAL组比较差异无统计学意义(P>0.05),而4组间大鼠左心室心底部纤维化面积分数比较差异无统计学意义(P>0.05)。见图1和表3。
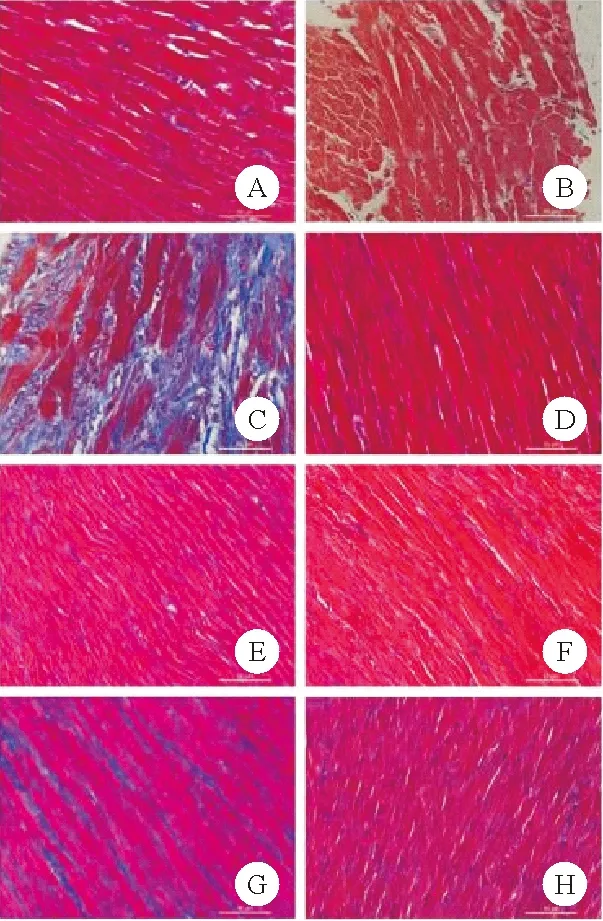
图1 4组大鼠左心室心尖部和心底组织Masson染色结果(A、B分别为CTL组心尖部、心底部;C、D分别为TTS组心尖部、心底部;E、F分别为SAC/VAL组心尖部、心底部;G、H分别为VAL组心尖部、心底部,×400)
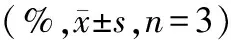
表3 4组大鼠左心室心尖部和心底部纤维化面积分数比较
4.4组大鼠TGF-β1、Smad3、CollagenⅠ、RyR2、p-RyR2、CaMKⅡ、p-CaMKⅡ蛋白表达水平比较:4组大鼠TGF-β1、Smad3、CollagenⅠ、p-RyR2及p-CaMKⅡ蛋白表达水平比较差异均有统计学意义(P<0.05),其中TTS组上述指标均高于CTL组,SAC/VAL组均低于TTS组(P<0.05),VAL组与TTS组比较差异均无统计学意义(P>0.05)。而4组间CaMKⅡ和RyR2蛋白表达水平比较差异均无统计学意义(P>0.05)。见表4。
讨 论
近年来的研究发现,TTS并非良性疾病[1,3],心律失常是TTS急性期的常见并发症[2-4],但尚缺乏对TTS相关心律失常的探讨。SAC/VAL可缓解多种病因所致的心功能不全和心律失常[5-7]。本研究结果显示:(1)SAC/VAL可降低TTS的室性心律失常易感性;(2)SAC/VAL可减弱TTS心尖部纤维化;(3)SAC/VAL对心室肌细胞的ERP或APD无明显影响,但可能降低致心律失常的肌浆网Ca2+泄漏。
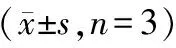
表4 4组大鼠TGF-β1、Smad3、CollagenⅠ、RyR2、p-RyR2、CaMKⅡ、p-CaMKⅡ蛋白表达水平比较
ISO可用于多种动物模型的制备,包括急性心肌梗死、心肌肥厚/纤维化、ISO所致的心肌损伤、心衰及本研究中的TTS。虽不同的动物模型采用的药物相同,但药物剂量和给药方式有所差异。ISO用于诱导大鼠急性心肌梗死时,常采用大剂量给药,一般为连续两次皮下或IP 75~150 mg/kg ISO,注射间隔时间为24 h[14]。心肌肥厚、纤维化、心衰等常采用小剂量给药方式[15-16]。而本研究中的TTS,最早来源Sachdeva等[10]报道的模型研究,采用单次大剂量注射ISO,剂量为50 mg/kg或100 mg/kg,模型构建成功率与ISO剂量无明显相关性。所以本研究选择50 mg/kg ISO诱导TTS[10,17]。
临床上,典型的TTS主要累及左心室心尖部和心室中部,少有累及左心室基底部,其超声表现为心尖部、心室中部收缩功能减弱或消失,心室基底部收缩增强或正常[18]。在本研究制作的模型中,注射ISO后2 d,大鼠心尖部收缩功能下降而心底部收缩功能正常。故可模拟临床TTS的心脏表型,而7 d后行心脏超声检查,心尖部收缩功能亦恢复正常,这与临床TTS患者的收缩功能迅速恢复类似[18]。
磁共振研究显示,TTS患者细胞外体积分数明显增加[19],提示细胞外纤维增多;Sachdeva等[10]发现ISO注射8 d后心肌细胞间出现明显的胶原沉积。同样,本研究制作的TTS模型中,左心室心尖部出现明显纤维化,但心室心底部未见明显胶原沉积,这可能与TTS累及的病变范围有关[18]。TTS的结构重塑进一步说明TTS并不是一种预后良好的临床疾病[1-3]。既往的研究结果显示,TGF-β1/Smad-3信号通路在心脏重塑过程中被激活[20]。本研究中,ISO注射后8 d大鼠TGF-β1和下游信号分子Smad3蛋白表达增加,表明TGF-β1/Smad3通路的过度激活参与了急性ISO诱导的心肌病的纤维化过程。与心肌梗死、心衰等多种疾病模型类似,SAC/VAL可降低TTS左心室心尖部纤维化[6]。SAC可抑制脑钠肽的降解,脑钠肽主要通过激活环磷酸鸟苷(cGMP)/环磷酸鸟苷依赖的蛋白激酶(PKG)信号通路发挥作用。本研究结果显示,SAC/VAL的使用可降低TGF-β1/Smad3的表达,而单独使用VAL对上述通路无明显影响。故通过cGMP/PKG/TGF-β1/Smad3通路下调CollagenⅠ的表达,可能是SAC/VAL发挥抗纤维化作用的主要机制[20]。
大部分TTS患者急性期QT间期延长,提示TTS急性期患者心室肌细胞APD延长[5],但大多数TTS患者QT间期在数天内可迅速恢复正常[21]。既往研究表明,大剂量短期使用ISO可延长大鼠QT间期[22],ISO还可延长心肌细胞的APD[23]。结合本研究结果,ISO诱导的TTS大鼠第8 d的APD和ERP均恢复正常,表明采用大剂量ISO诱导的动物模型符合TTS患者的临床特征。同时,SAC/VAL在心房颤动、心肌梗死等ERP改变时可调节Cav1.2或钾通道蛋白的表达,部分恢复ERP,降低心律失常的发生,但在本研究中,TTS组大鼠ERP和APD均无明显变化,提示Cav1.2和钾通道蛋白等影响动作电位的离子通道无明显改变,使用SAC/VAL后ERP和APD亦保持正常,表明SAC/VAL不影响正常的Cav1.2和钾通道蛋白表达[8-9]。舒张期肌浆网Ca2+泄漏增加可激活内向Na+/Ca2+交换电流,引起延迟后去极化,可触发心律失常[24]。一项对TTS大鼠的钙成像研究发现,在ISO注射后15 d内,肌浆网Ca2+泄漏频率显著增加。故肌浆网Ca2+泄漏介导的延迟后去极化可能是TTS急性期心律失常的潜在机制[17]。RyR2是肌浆网Ca2+泄漏的主要通道,虽然注射ISO后RyR2不变,但作为RyR2的活性形式,p-RyR2蛋白表达水平升高,间接证明了肌浆网Ca2+泄漏增多。RyR2可被PKA或CaMKⅡ磷酸化,而后者在心律失常中的比例更大,p-CaMKⅡ蛋白表达水平升高,表明RyR2活性增加主要由CaMKⅡ介导。Eiringhaus等[25]发现SAC/VAL可降低终末期心衰患者的心室肌细胞Ca2+泄漏,还可降低自发Ca2+火花的频率。本研究结果显示,短期应用SAC/VAL可降低RyR2的磷酸化水平,进一步验证了SAC/VAL的抗心律失常作用。TTS发生后向血浆释放大量的儿茶酚胺。过量的去甲肾上腺素和肾上腺素激活β肾上腺素能受体,通过β受体-Gs途径引起RyR2过度磷酸化,介导肌浆网Ca2+泄漏,进而激活Na+/Ca2+交换体,导致触发活动,使心律失常易感性增加[26-27]。同时,过量的β受体激活可引起心脏结构重塑,因β受体分布差异,过量的肾上腺素介导的纤维化在左心室心尖部最严重,而在左心室基底部较少见[26]。纤维化的空间分布异质性可进一步促进心律失常的发生[28]。短期使用SAC/VAL可减少由CaMKⅡ上调的RyR2磷酸化水平,而RyR2磷酸化的降低使其介导的致心律失常肌浆网Ca2+泄漏减少;此外,SAC/VAL阻断胶原纤维的沉积,显著减少纤维化和整个心室的电不均一性,从而降低心律失常的发生,故本研究中SAC/VAL组的实验结果为药物干预所致,而非心脏自动恢复。
综上,短期使用SAC/VAL对TTS具有抗心律失常作用,但其对TTS患者的使用价值尚需临床试验进行验证。
