胃癌前病变肠化分型与胃镜下表现和病理组织学表现的相关性分析
2022-04-25刘平王凤云王萍唐旭东刘炯张伟
刘平 王凤云 王萍 唐旭东 刘炯 张伟
慢性萎缩性胃炎(CAG)是临床常见疾病,主要特征为胃黏膜固有腺体减少或消失,或伴有肠化(IM)或假幽门腺化生[1]。根据Correa[2]提出的肠型胃癌(GC)级联模式,即浅表性胃炎-CAG-IM-异型增生(Dys)-GC,CAG是肠型GC的背景病变,其癌变率随病程进展而增加,而IM及Dys均为相对公认的胃癌前病变(PLGC)[3]。据2019年美国胃肠病协会(AGA)报道,IM进展为GC的发病率为年12.4/10 000[4]。IM分型可能与GC发生相关,其中不完全型(大肠型)发生GC的可能性更大[5-6]。PLGC多无特异性症状,可表现为非特异性消化不良症状,诊断主要依赖胃镜及病理检查结果。基于GC早期筛查、早期预防的理念,对PLGC的病理组织分型进行临床观察和深入研究具有一定意义。本研究旨在观察PLGC患者IM分型的分布情况,以探讨IM分型与胃镜下表现(胃镜象)及病理组织学表现(病理象)的相关性。
对象与方法
1.对象:2018年1月~2020年12月就诊于中国中医科学院西苑医院脾胃病科的PLGC患者157例,其中男71例,女86例,男女比为1∶1.21;年龄33~77岁,平均年龄(56.94±9.79)岁。PLGC诊断标准:胃镜及病理诊断标准参照《中国慢性胃炎共识意见(2017,上海)》[5]。纳入标准:(1)经胃镜和病理检查符合CAG伴IM或轻度Dys诊断;(2)年龄为18~75岁;(3)意识清楚、语言表达清晰、有阅读能力、具有民事行为能力;(4)同意接受临床调查、同意留取组织学标本用于检测,并自愿签署知情同意书。排除标准:(1)有胃部手术史;(2)怀疑有GC或其他系统恶性病变;(3)合并其他系统原发性疾病。本研究经中国中医科学院西苑医院伦理委员会批准。根据胃黏膜组织形态及分泌黏液的性质不同,采用苏木素-伊红(HE)染色和阿利新蓝-过碘酸雪夫氏(AB-PAS)染色,根据染色检查结果将入组患者分为完全型IM组85例和不完全型IM组72例[6]。
2.方法
(1)一般资料收集:通过问卷调查收集患者的一般资料,包括年龄、性别、幽门螺杆菌(Hp)感染情况。
(2)观察指标检测:胃镜检查由胃镜室1名固定主任医师采用同一台普通白光内镜,按内镜操作规范进行胃镜检查、病理活检并出具统一诊断报告。胃镜象积分统计:分别对胃窦、胃体、胃角、胃底4个部位进行评分,对常见胃镜下表现(平坦糜烂、隆起糜烂、出血斑点、IM结节)按无、散在、多发、弥漫分别计为0分、1分、2分、3分;黏膜水肿按无、轻度、中度、重度分别计为0分、1分、2分、3分;黏膜花斑、粗糙不平、血管显露按无、有分别计为0分、1分;4个部位积分相加为胃镜象积分。对皱襞变平按无、轻度、中度、重度分别计为0分、1分、2分、3分;黏膜变薄按无、轻度、中度、重度分别计为0分、1分、2分、3分;不区分部位。由我院病理科医师采用HE和AB-PAS染色法对活体胃黏膜组织标本进行病理诊断:正常胃黏膜中的柱状细胞分泌中性黏液;完全型IM的胃黏膜组织中柱状细胞消失,主要由吸收细胞、潘氏细胞及分泌唾液酸的杯状细胞组成;不完全型IM的胃黏膜组织中存在柱状细胞和杯状细胞,而柱状细胞分泌黏液的性质与正常胃黏膜相比发生改变,即可分泌中性黏液,又可分泌酸性黏液,杯状细胞主要分泌酸性黏液。根据胃黏膜组织分泌黏液的酸碱度不同,染色结果不同:中性黏液染色呈红色,酸性呈蓝色,混合性呈蓝紫色或紫蓝色。病理象评估:胃黏膜组织病理表现萎缩、肠化、慢性炎症、活动性炎症按无、轻、中、重度计数统计,异型增生按无、轻度进行统计,淋巴细胞增生、淋巴滤泡形成、糜烂按有、无进行计数统计;多部位组织活检按最重的病理表现统计。由两名病理科医师进行盲法阅片,填写病理组织学评价表。若诊断结果不一致,请两名病理科医师重新阅片,商议后做出最终病理诊断。
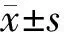
结 果
1.两组患者一般资料比较:完全型IM组患者男性少于女性[40例(47.1%)比45例(52.9%)],不完全型IM组患者男性少于女性[31例(43.1%)比41例(56.9%)]。内镜活检胃黏膜组织行快速尿素酶测定Hp阳性患者21例,其中完全型IM组14例(16.5%),不完全型IM组7例(9.7%)。完全型组和不完全型组性别、年龄、BMI、Hp阳性患者比例比较差异均无统计学意义(P>0.05)。见表1。
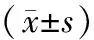
表1 完全型IM组和不完全型IM组患者一般资料比较
2.两组患者的胃镜象积分比较:不完全型IM组患者肠化结节积分明显高于完全型IM组(P<0.05)。两组间其余胃镜象积分比较差异均无统计学意义(P>0.05)。见表2。
3.两组患者的病理象结果比较:两组患者不同活动性炎症程度比较差异有统计学意义(P<0.05),其余病理象结果比较差异均无统计学意义(P>0.05)。见表3。
讨 论
2020年全球癌症统计报告显示[7],GC是全球第五大常见恶性肿瘤,占新发病例数5.6%,居恶性肿瘤死亡率第四位。2015年关于恶性肿瘤的调查结果显示,GC为我国第二大肿瘤,居我国恶性肿瘤死亡率的第三位[8-9]。根据Laruen分型,GC可分为肠型、弥漫型和混合型/不确定型;1995年基于修订版Laruen分型[10]又将后者分为混合型和实性型。其中,肠型GC是早期GC最常见的亚型,男性患者多于女性,预后良好[11]。以萎缩为背景的肠型GC的Correa级联发展模式已得到普遍认可,临床提倡对GC进行早期防治。许多研究表明,IM分型与GC发生的风险可能具有相关性。IM主要分为完全型IM和不完全型IM。完全型IM又称为小肠型IM,由成熟的吸收细胞、潘氏细胞和杯状细胞组成,后者分泌唾液酸黏液。不完全型IM又可以分为Ⅱa型和Ⅲb型,由柱状细胞、不成熟的杯状细胞和极少数吸收细胞组成,Ⅱa型柱状细胞可分泌中性黏液或唾液酸,杯状细胞分泌唾液酸黏液,偶尔分泌硫酸黏液,Ⅲb型柱状细胞分泌硫酸黏液,杯状细胞分泌唾液酸或硫酸黏液[12]。HE染色可用于区别细胞形态以初步判断IM类型,特殊染色高铁二胺-阿利新蓝(HID-AB)和AB-PAS可进一步区别IM亚型,尤其是对于不完全型IM诊断具有意义。
对具有癌变风险的PLGC患者进行识别和监测是减轻GC负担最有效的方法。既往有学者认为,胃黏膜萎缩、IM病变范围和程度应较IM分型更有意义[13]。在最新的一项关于哈萨克斯坦地区人群“可操作的与胃癌风险联系的萎缩/肠化评估”(OLGA/OLGIM)与IM分型关系的研究中,哈萨克斯坦地区人群OLGIM Ⅰ期和Ⅱ期患病率分别为39.8%和4.8%,而OLGIM Ⅲ期患病率为1.2%,IM患病率为45.8%,其中不完全型IM比例高于完全型IM(52.6%比47.4%),而OLGIM不同分期中均以不完全IM的患病率居高。该研究结果表明,对于GC高危个体的早期筛查和监测,IM的亚型与OLGA/OLGIM分期相比更有早期预警的价值和意义,IM分型有助于提高对GC高风险患者的监测[14]。一项关于IM分型的发病率及GC发生风险的Meta分析显示,不完全型IM的GC发生率明显高于其他胃部病变,且与GC风险显著相关;与完全型IM比较,不完全型IM的GC相对风险高出4~11倍,表明不完全型IM可作为早期监测的遴选指标[15]。因此,IM分型作为GC风险预测指标的实用性应受到重视。
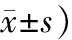
表2 两组患者的胃镜象积分比较(分,

表3 两组患者的病理象结果比较[例,(%)]
本研究中,完全型IM比例高于不完全型IM,与既往横断面研究结果一致。目前有关IM分型与内镜象、病理象的相关性研究较少[16]。胃镜象是指运用电子胃镜检查获得的有关胃黏膜变化的客观征象。CAG内镜下可见黏膜红白相间,以白色为主,皱襞变平或消失,部分黏膜血管显露,可伴有黏膜颗粒或结节状等,还可伴有黏膜红斑、黏膜粗糙、糜烂、水肿、充血、出血或胆汁反流等胃镜象[4]。由于在Hp感染状态下,胃黏膜会出现一定规律改变,如结节样胃炎[17]、腺管开口改变[18]。本研究对纳入患者行胃黏膜组织快速尿素酶试验结果显示,Hp阳性者21例,不同IM分型组Hp阳性患者比例比较差异无统计学意义,排除了Hp现症感染的影响。
本研究中胃镜象主要以黏膜水肿、花斑、皱襞变平、IM结节、粗糙不平等表现明显,不完全型IM组肠化结节积分明显高于完全型IM组,表明IM结节与不完全型IM发生可能具有相关性。既往研究发现IM结节可能与PLGC有关。一项关于窄带成像联合放大胃镜下活检在胃低级别上皮内瘤变术前诊断与术后病理诊断符合率的研究表明,在癌变组中表面结节隆起、表面凹陷的比例明显高于非癌变组[19]。一项基于美蓝放大胃镜下IM黏膜表面小凹结构与IM分型相关性的研究发现,显示不规则斑点型多提示为不完全型IM,而绒毛型表型多提示为完全型IM,表明IM黏膜小凹结构的表型可用于初步判断IM分型[20]。本研究结果显示,完全型IM组的活动性炎症程度明显高于不完全型IM组。炎-癌转化在PLGC病变进展中至关重要,炎症细胞浸润引起的组织结构和微环境的改变是目前研究的热点之一。但目前IM分型与炎症的相关性研究较少,有待于进一步观察与研究。考虑活动性炎症主要与Hp感染、胆汁反流、溃疡、服用非甾体类抗炎药、饮食等有关系,本研究虽未发现Hp现症感染与IM分型的相关性,但尚需增加既往Hp感染病史的分层分析。
综上所述,不完全型IM与胃镜下胃黏膜表现IM结节有关,提示IM结节可能具有更高的恶变潜能或风险,需在内镜筛查中引起重视。活动性炎症与完全型IM可能相关,但尚需对多种炎症因素如Hp感染情况进行分层分析。对于IM分型的随访和预后,还需进一步的临床观察与深入研究。
