猪源肠外致病性大肠杆菌抗体间接ELISA检测方法的建立
2022-04-25程家园刘雪兰魏建忠
程家园,李 亮,邢 刚,刘雪兰,孙 裴,魏建忠,李 郁
(1.安徽农业大学动物科技学院,安徽 合肥 230036;2.马鞍山史记动物健康管理有限公司,安徽 马鞍山 238251)
大肠埃希氏菌(Escherichia coli, E.coli)俗称大肠杆菌,根据E.coli致病性特征以及发病机制的不同,可将其分为共生型E.coli、肠内致病型E.coli和肠外致病型E.coli[1]。肠外致病性E.coli(Extraintestinal Pathogenic Escherichia coli,ExPEC)是一组异质类E.coli,不仅可正常定植于人和动物的肠道,而且能侵入机体引起菌血症,并诱发败血症或局部肠道外感染,如脑膜炎、关节炎、肺炎、心内膜炎等。养猪生产中常使用抗生素防治大肠杆菌病,但随着抗生素的不合理使用,ExPEC耐药菌株日渐增多,故在减抗、限抗和禁抗已成为养殖行业发展趋势的背景下,疫苗免疫不失为一种有效策略。当前市面上暂无猪源ExPEC商品化疫苗,研发有效的疫苗对于防控猪源ExPEC感染至关重要。猪源ExPEC血清型众多,不同血清型之间的交叉免疫能力较弱。疫苗的合理选择及其免疫效果的科学评价将是有效预防该病以提高生产效益的重要环节。抗体检测不仅能掌握猪群中ExPEC免疫抗体的消长情况和评估疫苗免疫的效果,而且有助于对未经疫苗免疫的猪群进行ExPEC感染的调查和诊断。因此,建立和应用一种快速、敏感且特异的检测猪源ExPEC抗体的方法意义显著。
用于检测E.coli抗体的方法有试管凝集试验、间接血凝试验和玻板凝集试验等。试管凝集试验工作量大,且需大量凝集抗原和动物血清,费时费力;间接血凝试验操作步骤繁琐、稳定性差、成本耗费较高;玻板凝集试验虽操作简单,但仅适用于定性检测而不适用于定量检测。微量凝集试验(Microagglutination Test, MAT)是对试管凝集试验的改良,具有微量、简便、稳定性和特异性好等特点,但其结果主要是依靠肉眼观察判定结果,具有一定的主观性[2]。而酶联免疫吸附试验(Enzyme-linked Immuno Sorbent Assay, ELISA)则具备成本低、敏感性强、特异性好、准确性高、能定量检测血清中抗体水平的特点[3]。本研究将猪源ExPEC超声裂解所得菌体蛋白包被酶标板,建立了基于猪源ExPEC全菌体蛋白的间接ELISA抗体检测方法,为猪源ExPEC抗体检测和血清流行病学调查提供了技术储备。
1 材料与方法
1.1 试验时间和地点
试验于2021年6月18日在安徽农业大学动物传染病实验室进行。
1.2 菌株、血清和培养基
猪源ExPEC血清O38型(编号为SDjie18-10)、O127型(编号为HByan18-2)受试菌株,安徽农业大学动物传染病实验室分离鉴定和保存;猪源ExPEC O38型及O127型、产肠毒素大肠杆菌(ETEC)、产志贺毒素大肠杆菌(STEC)、鼠伤寒沙门氏菌(Salmonella typhimurium)阳性血清、猪源ExPEC O38型及O127型阴性血清,安徽农业大学动物传染病实验室制备和保存;副猪嗜血杆菌4型(Haemophilus parasuis 4, HPS4)阳性血清,郑州百基生物科技有限公司;猪链球菌2型(Streptococcus suis 2, SS2)阳性血清,马鞍山史记动物健康管理有限公司惠赠;猪圆环病毒2型(Porcine circovirus 2, PCV2)、猪伪狂犬病病毒(Pseudorabies Virus, PRV)、猪瘟病毒(Classical Swine Fever Virus, CSFV)、猪繁殖与呼吸综合征病毒(Porcinereproductive and Respiratory Syndrome Virus, PRRSV)阳性血清均来自IDEXX公司相应的ELISA检测试剂盒;临床检测应用的猪血清样品采自安徽地区部分猪场;LB肉汤,绍兴天恒生物科技有限公司。
1.3 主要试剂和仪器
牛血清蛋白(BSA),生工生物工程(上海)股份有限公司;脱脂奶粉,Sigma公司;HRP标记羊抗猪IgG抗体,Solarbio公司;酶标板,Corning公司;全波长酶标仪,美国博腾公司。
1.4 猪源ExPEC凝集抗原的制备
将灭活的猪源ExPEC血清O38型(编号为SDjie18-10)、O127型(编号为HByan18-2)菌株等体积混合制备凝集抗原用于MAT[4]。
1.5 猪源ExPEC阳性血清的制备
将临床送检的猪血清通过MAT进行猪源ExPEC O38型、O127型阳性血清的筛选[5],判定结果为阳性的猪血清置于-80 ℃保存备用。
1.6 猪源ExPEC抗体间接ELISA检测方法的建立
1.6.1 猪源ExPEC全菌体蛋白的制备 将培养至稳定期(培养8 h)的受试菌株等体积混合,经8 000 r/min离心10 min后收集菌体,加入10 mL灭菌PBS(pH=7.4)重悬沉淀,同时采用超声波破碎的方式充分释放菌体抗原。将破碎后的菌体经8 000 r/min离心10 min,取上清液置于-80 ℃保存备用。
1.6.2 间接ELISA操作步骤 将包被液(pH=9.6的碳酸盐缓冲液)稀释后的全菌体蛋白(20 μg/mL)以100 μL/孔包被酶标板,4 ℃过夜,弃去包被液;PBST洗涤后(洗板3次,每次加入洗涤液200 μL,振荡1 min),每孔加入200 μL 0.5%脱脂奶粉,37 ℃封闭2 h后PBST洗涤;将阳性血清用PBST稀释至1∶1 600加入孔内,同时设立猪源ExPEC阴、阳性血清对照,37 ℃作用1 h后,PBST洗涤;每孔加入100 μL羊抗猪IgG(1∶3 000稀释),37 ℃作用1 h,PBST洗涤;每孔加入100 μL TMB显色液,37 ℃避光显色10 min;每孔加入100 μL H2SO4终止反应,于450 nm波长读取OD值并计算P/N值(P:待检血清OD450nm值;N:阴性对照OD450nm值)[6]。每种反应条件作3个重复,取其平均值,以P/N值最大的孔所对应的优化条件为最佳[7]。
1.6.3 最佳抗原包被浓度和血清稀释度的确定 采用方阵滴定法确定最佳抗原包被浓度和血清稀释度。以pH=9.6的碳酸盐缓冲液将猪源ExPEC全菌体蛋白稀释至终浓度分别为20.0、15.0、10.0、5.0 μg/mL,每孔100 µL包被96孔酶标板,4 ℃过夜。猪源ExPEC阳性血清和阴性血清均按1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400倍比稀释后进行方阵滴定试验,测定OD450nm,计算P/N值以确定最佳抗原包被浓度和血清稀释度。
1.6.4 最佳抗原包被条件的确定 以最佳的抗原浓度进行包被,将包被条件分成5种:37 ℃ 2 h+4 ℃过夜、37 ℃ 1 h+4 ℃过夜、4 ℃过夜、37 ℃ 2 h及37 ℃ 1 h,分别按照间接ELISA抗体检测方法的程序进行操作,测定OD450nm,计算P/N值以确定最佳抗原包被条件。
1.6.5 最佳封闭液及封闭时间的确定 以最佳的抗原包被浓度和条件包被酶标板,分别以1%BSA、2%BSA、5%脱脂奶粉、5%胎牛血清为封闭液,按照间接ELISA操作程序筛选出最佳封闭液。将该封闭液分别于37 ℃封闭1 h、2 h、3 h后进行间接ELISA抗体检测,测定OD450nm,计算P/N值以确定最佳封闭时间。
1.6.6 最佳血清作用时间的确定 按照确定好的最佳条件依次进行包被、封闭、加入血清,分别在37 ℃作用 30、45、60、75 min后进行间接ELISA抗体检测,测定OD450nm,计算P/N值以确定最佳血清作用时间。
1.6.7 最佳酶标二抗浓度及作用时间的确定 加入血清后,将羊抗猪IgG-HRP分别进行1∶3 000、1∶5 000、1∶10 000、1∶15 000稀释后进行间接ELISA检测。确定最佳酶标二抗浓度后于37 ℃分别孵育30、45、60、75 min,按照间接ELISA方法步骤进行抗体检测,测定OD450nm,计算P/N值以确定最佳酶标二抗作用时间。
1.6.8 最佳显色时间的确定 按照筛选的最佳条件进行间接ELISA抗体检测,加入TMB显色液后分别于37 ℃避光显色5、10、15 min,测定OD450nm,计算P/N值以确定最佳显色时间。
1.6.9 临界值的确定 按照上述优化的方法检测30份已知猪源ExPEC抗体阴性血清,测定其OD450nm值,计算平均值(X)和标准方差(SD),以OD450nm≤X+3SD作为阴性判定标准,OD450nm>X+3SD作为阳性判定标准。
1.7 特异性试验
采用优化的方法检测E T E C、S T E C、Salmonella、HPS、SS、PCV2、PRV、CSFV、PRRSV阳性血清,同时设立猪源ExPEC阳性血清和阴性血清作对照,以评估该方法的特异性。
1.8 敏感性试验
将猪源ExPEC阳性血清用PBST按照1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800、1∶25 600、1∶51 200、1∶102 400稀释,利用优化的方法进行抗体滴度的检测,以评估该方法的敏感性。
1.9 重复性试验
取3份猪源ExPEC阳性血清和3份猪源ExPEC阴性血清样品,用同一批次的猪源ExPEC全菌体蛋白包被酶标板,对该6份血清样品进行ELISA检测,每份样品重复3次操作,结果进行统计学分析,以检测批内重复性;相同条件下,使用3个不同批次包被的酶标板分别检测该6份血清样品,结果进行统计学分析,以检测批间重复性。
1.10 符合率试验
应用建立的间接ELISA方法对30份未经猪源ExPEC疫苗接种的猪血清样品进行抗体检测,同时与MAT作平行比较,计算符合率以考察该方法的可靠性。符合率=(阳性结果相同样本数+阴性结果相同样本数)/总样本数×100%。
1.11 临床猪血清样品的感染抗体检测
利用建立的间接ELISA和MAT对安徽10个地市200份未经猪源ExPEC疫苗接种的猪血清样品进行感染抗体检测,以验证该方法的应用性。
1.12 统计分析
采用单因素ANOVA检验和Kappa检验对结果进行统计学分析。
2 结果与分析
2.1 猪源ExPEC阳性血清制备
由图1可见,96孔微量反应板A、B孔边缘有明显的凝集片,与C、D孔(对照孔)的圆点有明显的区别,A、B孔加入的血清即为猪源ExPEC阳性血清。

图1 猪源ExPEC阳性血清制备结果
2.2 猪源ExPEC抗体间接ELISA检测方法的建立
2.2.1 间接ELISA反应条件的优化 通过确定最佳抗原包被浓度、温度和时间,最佳血清稀释度和作用时间,最佳封闭液和封闭时间,最佳酶标二抗浓度和作用时间,以及最佳显色时间等一系列试验,优化了间接ELISA的反应条件,具体如下:包被抗原浓度为15 μg/mL,37 ℃ 1 h+4 ℃过夜;2%BSA于37 ℃封闭2 h;血清稀释度为1∶800,37 ℃孵育30 min;酶标二抗稀释度为1∶5 000,37 ℃作用30 min;显色时间为37 ℃ 15 min。
2.2.2 临界值的确定 按照上述优化的方法检测30份已知猪源ExPEC抗体阴性血清,测定其OD450nm值,计算平均值X=0.269,标准方差SD=0.015,临界值X+3SD=0.314,即当血清样品的OD450nm值>0.314为阳性,OD450nm值≤0.314为阴性。
2.3 特异性试验
表1结果显示,用建立的猪源ExPEC抗体间接ELISA方法检测ETEC、STEC、Salmonella、HPS、SS、PCV2、PRV、CSFV、PRRSV阳性血清的OD450nm值均小于0.314,而且猪源ExPEC阳性血清和阴性血清对照均成立。表明该方法与常见病原阳性血清无交叉反应,具有良好的特异性。
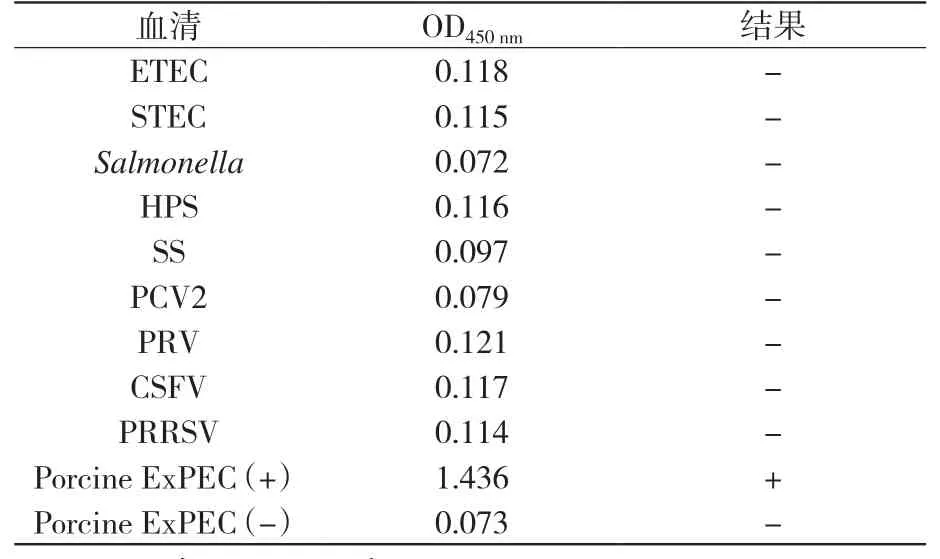
表1 特异性试验结果
2.4 敏感性试验
表2结果显示,建立的猪源ExPEC抗体间接ELISA方法能检测到最高稀释度为1∶6 400的猪源ExPEC阳性血清,具有良好的敏感性。

表2 敏感性试验结果
2.5 重复性试验
表3结果显示,批内变异系数均小于8%(1.92%~7.60%),批间变异系数均小于5%(1.50%~4.72%)。批内及批间重复试验的结果表明建立的猪源ExPEC抗体间接ELISA方法具有良好的重复性。
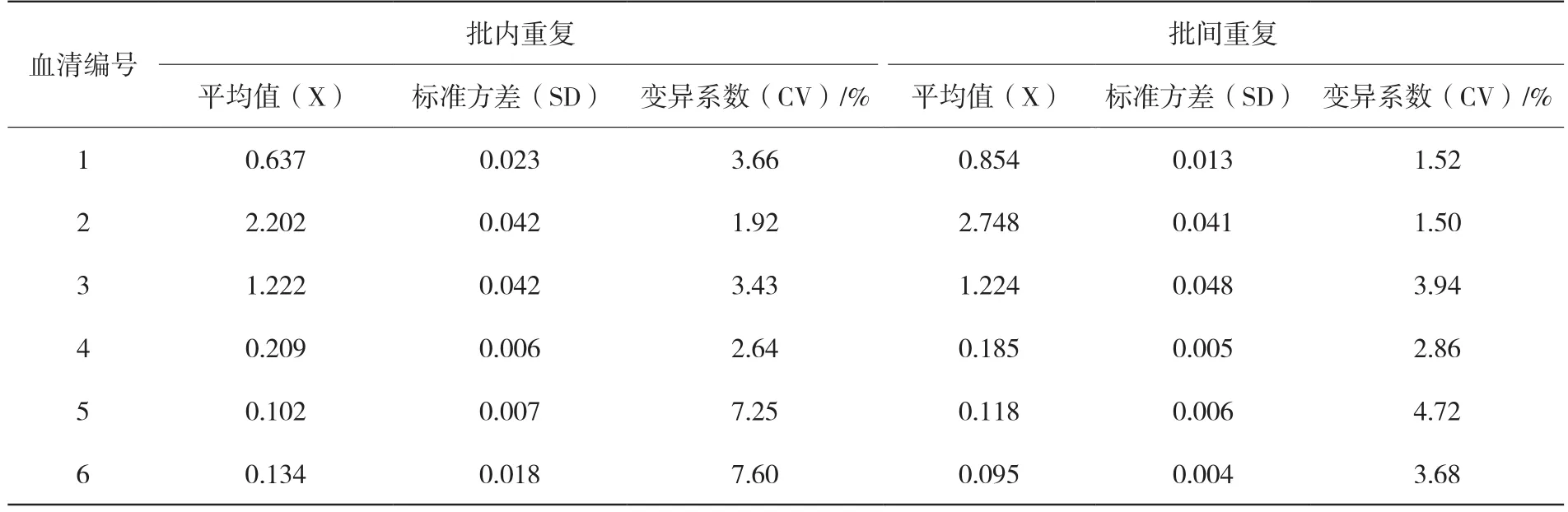
表3 重复性试验结果
2.6 符合率试验
表4结果显示,在30份未经猪源ExPEC疫苗接种的猪血清样品中,猪源ExPEC抗体间接ELISA方法检测出4份猪源ExPEC阳性血清,而MAT检测出2份猪源ExPEC阳性血清,与该方法的总符合率为93.33%,具有较高的一致性。
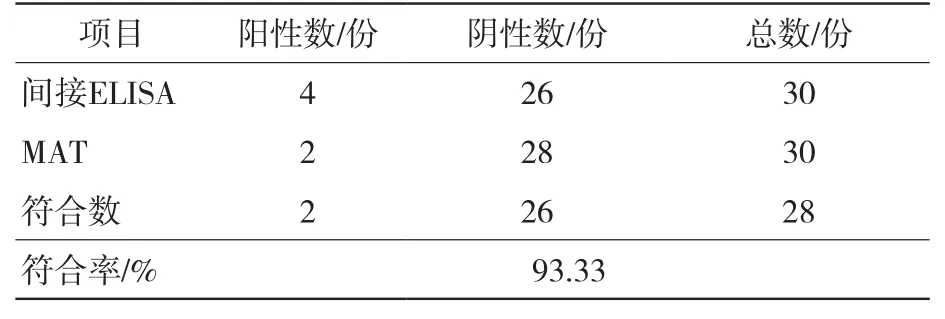
表4 猪源ExPEC抗体间接ELISA与MAT检测结果比较
2.7 临床猪血清样品的感染抗体检测
在200份未经猪源ExPEC免疫接种的猪血清样品中,间接ELISA检出38份阳性血清,162份阴性血清,感染率为19.00%;MAT检出35份阳性血清,165份阴性血清,感染率为17.50%。两种方法检测同为阳性样品有31份、阴性样品有158份,符合率为94.50%,检测结果无显著性差异,高度一致(P>0.05,K=0.816),见表5。卡方检验结果显示:合肥与马鞍山、芜湖、亳州、阜阳、蚌埠、池州、安庆、淮南、六安9个地市之间感染率差异显著(P<0.05);马鞍山与亳州、蚌埠、池州、安庆、六安5个地市之间感染率差异不显著(P>0.05),而与合肥、阜阳、淮南、芜湖4个地市之间感染率差异显著(P<0.05);芜湖、阜阳、淮南3个地市与合肥、马鞍山、亳州、蚌埠、池州、安庆、六安7个地市之间感染率差异显著(P<0.05)。表明安徽10个地市均存在不同程度的猪源ExPEC感染,其中合肥感染率最高(表6)。
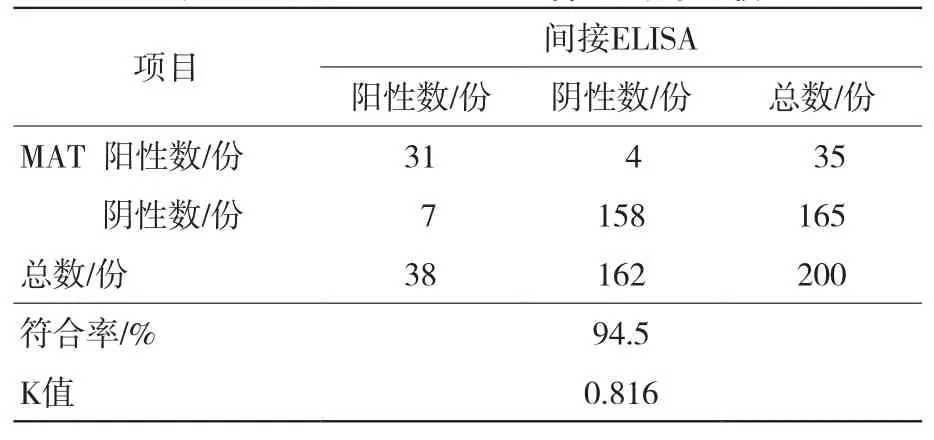
表5 间接ELISA和MAT的检测结果比较
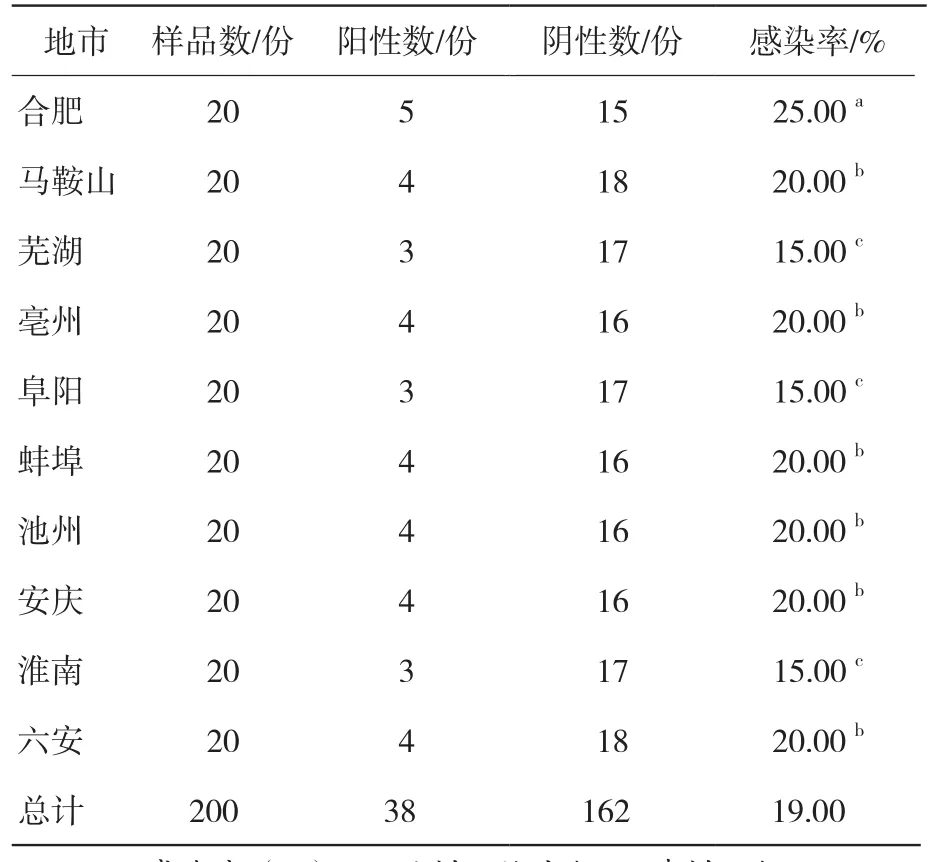
表6 间接ELISA对安徽10个地区猪源ExPEC感染抗体的检测结果
3 讨论与结论
近年来,猪源ExPEC已成为影响我国养猪业最重要的细菌性病原体之一,在临床上的检出率呈现逐年升高的态势[8-11]。由于发病率、死亡率升高和体重降低情况的增多,以及治疗、疫苗和饲料添加剂的成本增加,ExPEC引起的猪大肠杆菌病导致的经济损失日趋显著。猪源ExPEC血清型的种类繁多,不同血清型菌株之间缺乏交叉免疫保护,优势血清型在不同地区、不同时段上的流行分布均存在一定差异,呈现动态过程[12]。鉴于此,本实验室前期对某集团公司分布在安徽、江苏、山东、河北、广西5个省区家庭农场以及安徽地区不同规模养猪场(户)进行猪细菌病学调查,确定ExPEC血清型O38、O127为优势菌株,进而依据抗原性试验筛选出抗原性良好的血清O38型(编号为SDjie18-10)、O127型(编号为HByan18-2)受试菌株,将其超声裂解蛋白作为包被抗原,通过对抗原浓度、血清、酶标二抗稀释度及反应时间等条件优化,建立了检测猪源ExPEC血清O38、O127型抗体间接ELISA方法。
选择合适的包被抗原是建立间接ELISA抗体检测方法的关键。采用超声裂解蛋白作为包被抗原,其优势是包被抗原制备过程简单,只需将菌体超声裂解即得,且包被抗原稳定易保藏,冷冻保藏期可达半年以上[13],缺点在于用全菌体超声裂解蛋白作为包被抗原理论上存在特异性差的可能[7]。本研究结果则显示,建立的猪源ExPEC抗体间接ELISA方法与ETEC、STEC、Salmonella、HPS、SS、PCV2、PRV、CSFV、PRRSV共9种常见细菌和病毒阳性血清无交叉反应,猪源ExPEC阳性血清稀释至1∶6 400仍可检出,批内及批间变异系数均小于10%,表明该方法具有特异性强、敏感性高、重复性好等优点,可进行临床样品猪源ExPEC血清抗体检测的应用。
在间接ELISA和MAT中,同一血清型菌株的抗原与抗体能发生特异性反应,而不同血清型菌株的抗原与抗体往往不发生反应或因共性抗原的存在,发生不同程度的交叉反应。本研究应用以血清O38、O127型猪源ExPEC制备包被抗原和凝集抗原建立的间接ELISA和MAT进行符合率试验及对临床猪血清样品感染抗体的同步检测,两者的符合率分别为93.33%和94.50%,感染抗体阳性检出率分别为19.00%和17.50%,符合率与阳性检出率均无显著性差异,且感染抗体检测结果Kappa检验一致性极高。这不仅表明间接ELISA同MAT均一性较高,均可用于临床血清O38、O127型猪源ExPEC抗体的检测;而且进一步显示猪源ExPEC在临床上存在普遍感染现象。但在临床大批量检测时,间接ELISA所需的包被抗原量远少于MAT所需的凝集抗原,可有效减少抗原制备成本。同时MAT主要是依靠肉眼观察测定结果,具有一定的主观性;间接ELISA结果则由样品吸光值进行判断,客观准确。而且,当血清中抗体水平较低时,凝集抗原往往不易与相应抗体发生明显的凝集反应,从而影响判断,导致假阴性出现,与之相比,低抗体滴度的血清应用间接ELISA则更容易检出[14]。因此,本研究建立的间接ELISA用于临床特定血清型猪源ExPEC抗体检测和流行病学调查时,更具有普适性和准确性。当前猪源ExPEC血清型众多,各地区优势血清型存在较大差异,呈现动态过程,建立同步检测多种血清型猪源ExPEC抗体的方法势在必行。本研究着实为猪源ExPEC抗体检测方法的深入研究奠定了良好基础。
