犬子宫内膜炎的新分类:从解剖学和组织病理学角度分析
2022-04-24王靖萱王颢然刘志远赵启达刘瑞芳王鑫宇宋旭东肖建华
王靖萱,徐 瑶,王颢然,刘志远,赵启达,刘瑞芳,王鑫宇,刘 涛,宋旭东,肖建华*
(1.东北农业大学动物医学院 黑龙江省普通高等学校动物普通疾病防治重点实验室,哈尔滨 150030;2.宋医生宠物医院,哈尔滨 150030)
子宫内膜炎是指子宫内膜结构发生炎性改变,是母犬最常见且最复杂的疾病,严重影响母犬的繁殖性能[1-2]。目前,一般认为导致本病的因素包括生殖激素及其受体功能障碍、致病菌感染和品种遗传等[3-5]。在过去的几十年里,与犬类繁殖相关的疾病日益增加[6]。犬子宫内膜炎常在母犬发情、交配、流产和分娩之后发生,其中,老龄犬的发病率较高,有研究发现,高于8岁的母犬发病率高达15%~50%[7],且多发于屡配不孕和无生育史的母犬[8-9]。
De Bosschere等[10]通过计算机图像分析了68例患子宫疾病的犬的病例:测量子宫内膜占子宫内膜腺腔的百分比,计算子宫内膜/肌层(Endo/Myo)比值,观察子宫内膜间质水肿、出血、成纤维细胞增殖和炎症反应情况。但由于个别动物疾病的严重程度和研究人员使用的诊断标准不一,目前还缺乏深入且可应用于临床诊断的子宫内膜炎分类。因此,本研究的目的是对犬子宫内膜炎的组织病理学类型进行分析,进而为其标准化提供一定的参考。
1 材料与方法
1.1 试验动物
本试验共收集并检测了40例子宫内膜炎病例,患犬的年龄从9个月到10岁不等,动物在接受卵巢子宫摘除术之前没有经过任何的激素疗法,且均无生育史。病例均取自哈尔滨市宋医生宠物医院(2018.05—2019.12),所有的病例均进行了临床及B超影像学诊断(图1),其中包括30例出现相关临床症状并经B超检查确诊为子宫内膜炎的病例和10例进行生理绝育手术的健康母犬,并将后者作为试验对照。

2张在本次病例收集中具有典型性的子宫蓄脓B超确诊影像图。子宫角均明显扩张,宫腔可见液性暗区(细箭头所示),提示宫腔积液。A.子宫壁显著增生变厚(粗箭头),内膜游离侧呈褶皱样;B.宫腔内液性暗区面积占比较大,子宫壁明显变薄(粗箭头)
1.2 血液学分析
用BC-5000vet全自动兽用五分类血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司产品),按产品使用说明测定红细胞检测指标:红细胞数(RBC)、平均红细胞体积(MCV)、红细胞压积(HCT)、血小板压积(PCT)、血红蛋白(HGB)、平均红细胞血红蛋白量(MCH)和平均红细胞血红蛋白浓度(MCHC)。以及测定白细胞检测指标:嗜中性粒细胞数(Neu)、淋巴细胞数(Lym)、单核细胞数(Mon)、嗜酸性粒细胞数(Eos)和嗜碱性粒细胞数(Bas)。
1.3 病理组织学检测
对临床上的绝育及子宫内膜炎发病犬,在进行卵巢子宫摘除术后,无菌收集子宫组织,一部分迅速用液氮冷冻,随后转移至冻存管内于-80 ℃冰箱保存。另一部分于4%多聚甲醛固定后常规石蜡包埋,连续切片,切片厚度4 μm,经HE染色中性树胶封片后,在光学显微镜(日本OLUMPUS,BX53)下观察子宫内膜及其肌层组织状态,对典型病变处进行拍照保存,同时利用Image J软件测量并计算内膜与肌层厚度比。
1.4 Real-time PCR检测
用TRIzol(中国Solarbio公司)提取子宫内膜总RNA,并用NanoDrop2000紫外分光光度计(Thermo Fisher Science)对其进行定量。根据制造商的说明书,使用NovoScript®Plus All-in-one 1stStrand cDNA Synthesis SuperMix(gDNA Purge)(中国NovoProtein公司)合成cDNA。随后,将cDNA 在StepOnePlus仪器(中国Thermo Fisher Science公司)上使用特异的有效引物和NovoStart®SYBR qPCR SuperMix Plus(中国Novoprotein公司)进行RT-qPCR分析。采用StepOnePlusTM软件(中国Thermo Fisher Science公司)对标准进行分析和定量,选用的内参基因是GAPDH。参照NCBI上已经发表的犬GAPDH基因的mRNA序列(GenBank登录号为NM001003142.2),利用Primer Premier 5.0设计并合成3对特异性引物,IL-1β上游引物:5′-TGTGAAGTGCTGCTGCCAAGAC-3′;下游引物:5′-ACAGAGCTGGTGGGAGACTTGC-3′;IL-6上游引物:5′-TGCTCCTGGTGATGGCTAC-3′;下游引物5′-ATTATCCGAACAGCCCTC3′;IL-8上游引物:5′-AACACACTCCACACCTTTCCATCC-3′;下游引物5′-TCCAGGCACACCTCATTTCCATTG-3′。
1.5 统计学分析
real-time PCR反应中每个样品均重复3次,试验数据结果采用2-ΔΔCt算法和SPSS17.0软件进行分析。所有测试数据均以“平均值±标准差(Means±SD)”表示。同时使用GraphPad Prism7.0软件进行统计处理,采用单因素方差分析,P<0.05表示差异显著。
2 结 果
2.1 临床症状
表1总结了30例患犬的病史和临床症状,包括阴道分泌物、嗜睡/抑郁、食欲不振/厌食、多尿、烦渴贪饮、可触摸到的子宫体增大、高热和胃肠道功能障碍。

表1 患犬病史及临床症状
2.2 血常规分析
无临床症状组的所有血常规指标均在正常范围内。在临床症状组的30份子宫样本中,白细胞类指标出现异常的病例较多,红细胞类指标检测结果在正常范围内的病例较多,各项指标的具体变化范围及检测值分布见表2。
2.3 解剖学和组织病理学检查
通过对Endo/Myo比值的测量,观察到本研究中病例的Endo/Myo比值与De Bosschere等[10]描述的子宫内膜炎的研究结果相似,详细数据见表3。由于临床症状组无炎症类的病例数为1,此次数据测量计算不将其列为统计范围内。

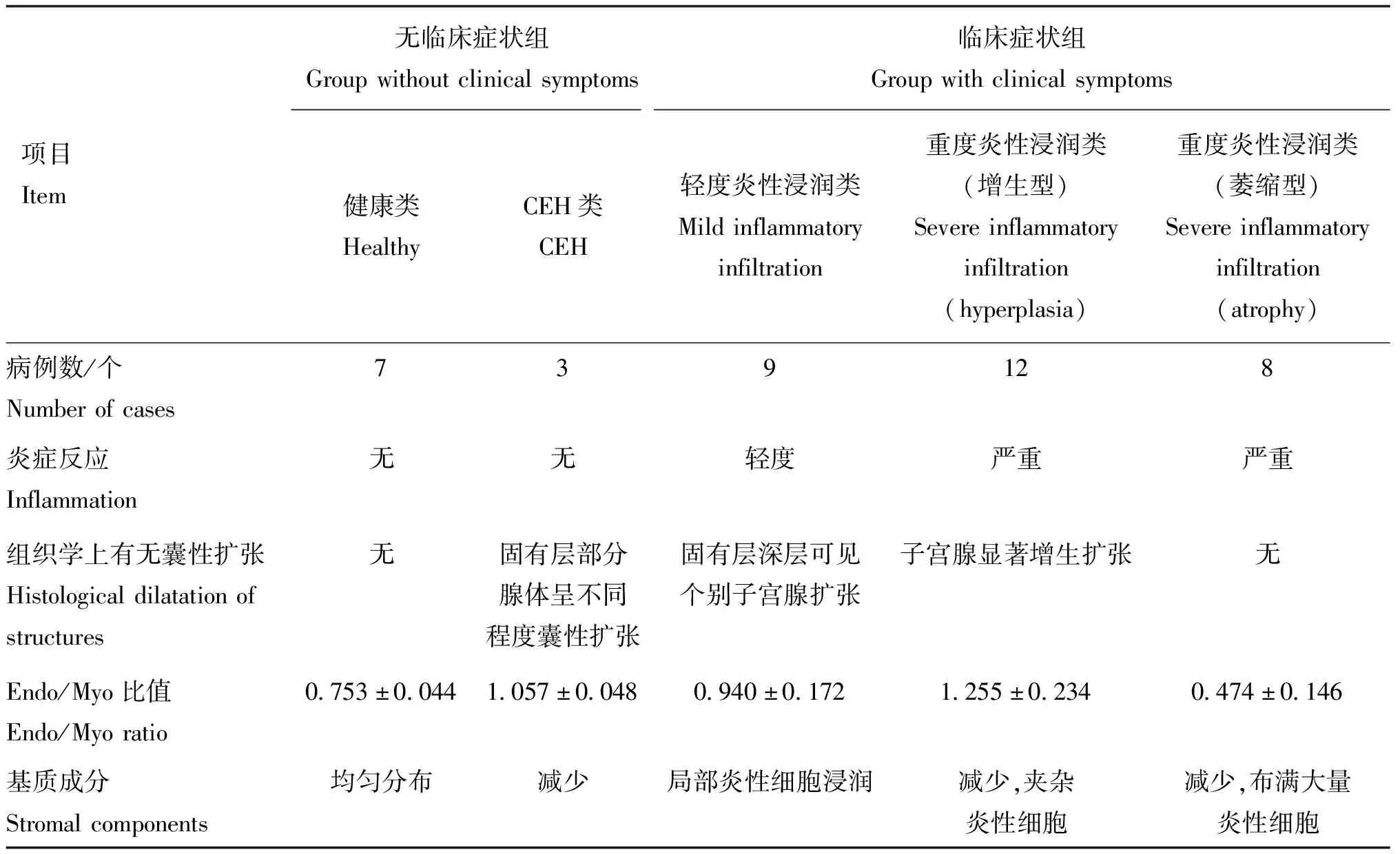
表3 子宫内膜炎的病理分类标准
健康类子宫外观个体细小,双侧子宫角直径均匀,无膨隆。内观宫腔内膜表面光滑,颜色呈肉粉色(图2A)。镜下内膜上皮完整,固有层腺体数量较少、大小适中,且结构完整无破坏,固有层基质均匀分布(图2B、2C、2D)。

A.子宫角纵向切开图片。B、C、D.HE染色的子宫内膜上皮和固有层结构组织学图像。放大倍数分别为40、100和400
内膜囊性增生类子宫眼观双侧子宫角细小直径均匀、无膨隆。暴露宫腔可见子宫壁表面光滑、颜色正常,子宫壁无内膜囊性增生样病变,与健康子宫在解剖学水平上并无明显差异(图3A)。镜下可见子宫内膜存在特征性的囊性增生样病变,基质成分减少(图3B、3C、3D)。
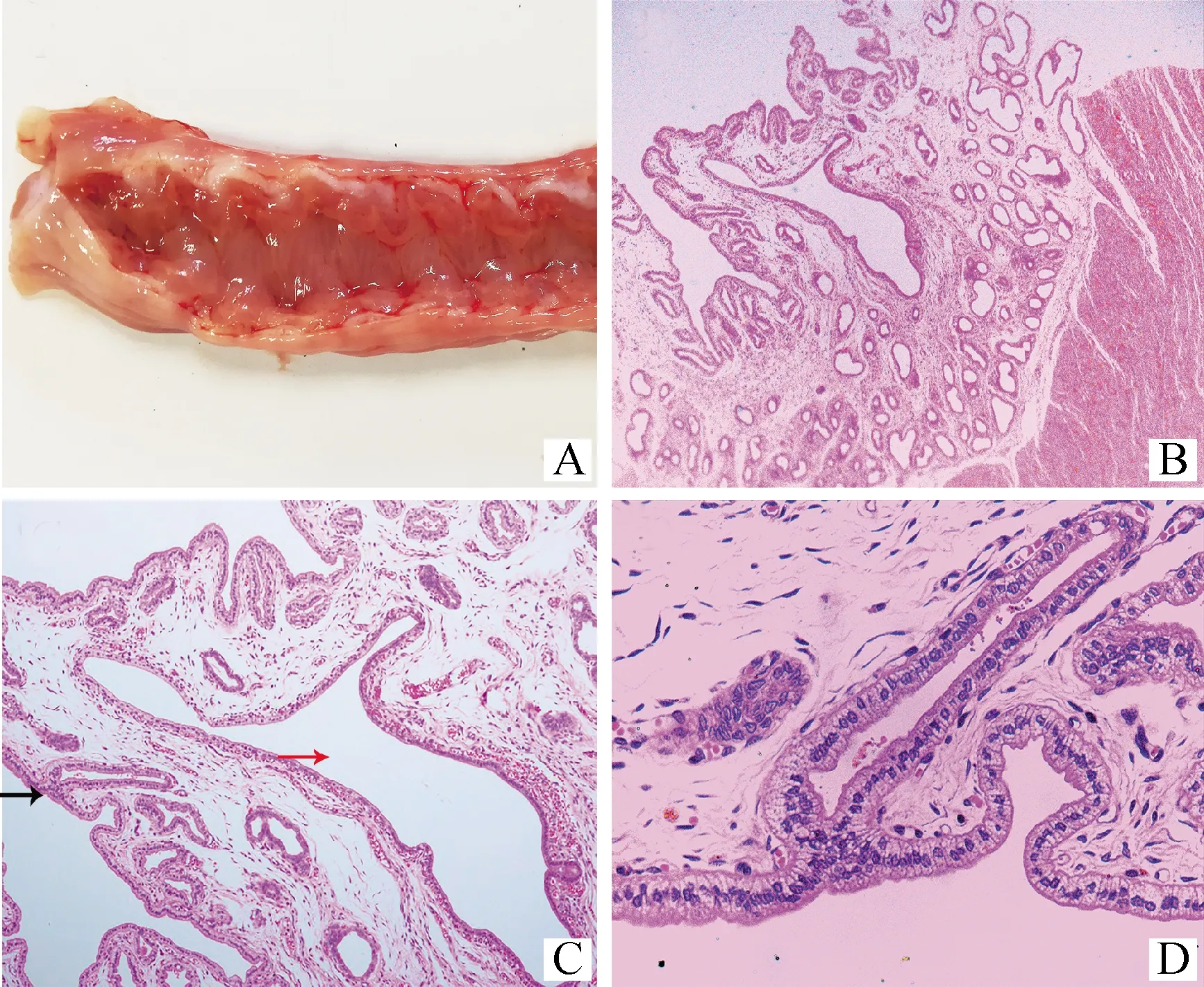
A.子宫角纵向切开图片。B、C、D.HE染色的子宫内膜上皮和固有层结构组织学图像。放大倍数分别为40、100和400。C中黑色箭头所指为内膜上皮结构,红色箭头为极度扩张的子宫腺体。D为C中黑色箭头处的放大图
轻度炎性浸润类子宫的双侧子宫角膨隆不明显。宫腔内有少量浑浊、化脓性液体,子宫内膜显著充血,子宫壁颜色较深且纹路明显(图4A)。镜下偶见内膜上皮部分脱落,固有层浅层腺体呈扁的褶皱样扩张,血管明显充血,基质可见局部炎性细胞浸润(图4B、4C、4D)。

A.子宫角纵向切开图片。B、C、D.HE染色的子宫组织学图像。放大倍数分别为40、100和400
病理组织学检查发现:重度炎性浸润的子宫又可分为两种类型,即增生型与萎缩型。外观此类子宫的子宫角均显著膨隆,经测量此类患犬子宫角最大直径为4.08 cm(大型犬),最小直径为1.83 cm(小型犬)。触之弹性较大,颜色深暗呈粉紫色,子宫壁血管明显扩张淤血。打开宫腔,里面充盈大量出血性/化脓性液体,散发恶臭气味。重度炎性浸润类(增生型)子宫眼观内膜表面布满大小不一的透明或半透明的囊泡,同时伴有许多乳头状的赘生物,且内膜表面附着少许血凝块(图5A)。镜下可见内膜上皮完全脱落,固有层子宫腺极度囊性扩张致使腺体破裂、与临近腺体相连并内折入腺腔,从而呈迷路样外观,固有层浅层基质成分基本消失,固有层深层基质则以严重炎性细胞浸润为主(图5B、5C、5D)。重度炎性浸润类(萎缩型)子宫的眼观可见内膜萎缩,表面呈深红色的蜂窝状凹陷(图6A)。镜下可见大部分内膜上皮坏死脱落,固有层子宫腺极度萎缩,甚至不见腺腔,基质减少,内膜全层布满大量的炎性细胞(图6B、6C、6D)。

A.子宫角纵向切开图片。B、C、D.HE染色的子宫组织学图像。内膜固有层浅层腺体严重扩张,腺上皮细胞形态肥大,呈空泡样变性(黑色箭头)。放大倍数分别为40、100和400

A.子宫角纵向切开图片。B、C、D.HE染色的子宫组织学图像。内膜全层弥漫性炎性浸润。放大倍数分别为40、100和400
在30例发病(或疑似发病)的犬中,有1例阴门出现少量异常分泌物,但经病理学检查未见子宫内膜内有炎性病变,眼观可见双侧子宫角轻微膨隆(图7A),解剖显露宫腔可见少量浑浊液体,镜检子宫内膜轻度萎缩,基质成分明显减少,未见炎性细胞浸润(图7B、C、D)。

A.子宫角纵向切开图片。B、C、D.HE染色的子宫内膜及肌层结构图,内膜层明显萎缩。放大倍数分别为40、100和400
2.4 促炎因子IL-1β、IL-6和IL-8的表达量
如图8A、8B和8C,相比健康子宫组织样本,出现炎症组织学表征的子宫样本内IL-1β、IL-6和IL-8的mRNA含量均明显升高。其中,内膜增生/萎缩型重度炎性浸润子宫组织3种因子的mRNA含量显著高于其它两组(P<0.001)。

*和#表示两组差异显著,P <0.05;**表示两组差异极显著,P <0.01;****和####表示两组极显著,P <0.001;ns表示两组差异变化无统计学意义
3 讨 论
Barrau等[11]描述了母犬在发情周期中子宫内膜厚度的变化周期。子宫壁的厚度从发情前期到发情后期的早期逐渐增加,然后逐渐减小,子宫内膜和子宫肌层的厚度也都遵循相同的变化规律[12]。在发情前期,由于子宫内膜发生水肿和增生,Endo/Myo比值很高。在发情期,这一比值迅速下降,然后在发情后期和间情期略有上升。从发情期到发情后期的早期,子宫腺体分泌活动增加,且增生、肥大,以一种高度分枝和盘绕的状态存在。在发情后期,子宫腺细胞的大小比子宫腺腔的大小减小得更快,此时更容易导致腺体发生囊性增生[10]。在母犬的发情周期中,孕酮和雌激素可以促进子宫内膜层增生增厚,减弱子宫平滑肌层的运动,抑制子宫内局部免疫作用[13-14]。由于母犬具有以上发情特点,使其易患子宫类疾病。又由于大多数的犬慢性子宫内膜炎病例在临床上都出现了子宫内膜囊性增生的病理表现,于是,Dow[15]建议使用“增生性子宫内膜炎”来定义此类疾病。但这忽略了一个重要的病理过程,即组织的增生不一定引起其发生炎症反应,且发生炎症反应的病例大多会出现典型的临床症状。虽然这种命名有一定的优点,但由于它只描述了疾病过程的一个特征或一个阶段,容易在临床上引起误诊。为了深入分析子宫壁病变、减少犬子宫蓄脓的误诊几率,De Bosschere等[10]根据Endo/Myo比值、炎性浸润程度、子宫腺体的变化等病理特征对犬子宫蓄脓制定了较具体的组织学标准。同时,他们的研究也证实了子宫内膜增生和宫腔积脓确实是两个独立的疾病类型。在他们的研究中,4只母犬的子宫内膜出现轻度炎性细胞浸润,腺腔占到子宫内膜面积的(15.60±4.09)%。观察到的Endo/Myo比值为1.26±0.29,他们将该组病例归类为子宫内膜炎组。通过Endo/Myo比值的测定,观察到本试验中所有病例的比值均在De Bosschere等[10]描述的参考范围内。在参考De Bosschere等[10,16]总结的组织学分类标准的基础之上,本研究综合患犬的临床体征、影像学、血液学、组织病理学变化结果以及RT-qPCR(IL-1β、IL-6和IL-8)检测结果,将40个 病例分为两组:无临床症状组(健康类和囊性子宫内膜增生类)和临床症状组(无炎症类、轻度炎性浸润类、增生型重度炎性浸润类和萎缩型重度炎性浸润类)。
大量研究表明,CEH和子宫内膜炎在发展过程中可能都有自己特有的诱发因素[17]。有研究报道,性激素受体数量的变化可能增加患CEH的概率[18]。在本研究中,CEH类、轻度炎性浸润类和增生型重度炎性浸润类的诱因就不一样,CEH母犬子宫中的子宫内膜增生主要源于腺体囊性增生,而轻度炎性浸润类和增生型重度炎性浸润类母犬子宫的内膜增生,则与间质内成纤维细胞增殖、炎症反应及其引发的腺体囊性变形有关。另外,Novak[19]指出,在人类的增生型子宫内膜炎病例中,临床上出现异常分泌物的症状是罕见的。而在Dow[15]报道的犬子宫蓄脓病例中,黏蛋白的产生似乎与增生的程度成正比。根据大量对犬子宫蓄脓的研究报道及本研究对子宫样本进行的组织病理学检查,可进一步证实犬CEH的病理变化应该是机体在生殖激素的异常作用下,导致子宫内膜腺体数量增多,体积增大,子宫内膜增生增厚,增生肥大的子宫内膜腺体分泌功能增强。根据子宫内容物的黏度,即黏蛋白含量的多少,决定无菌液体是否在腺体和子宫腔内积聚,无法排出,从而在宫腔内形成积液。此时,由于子宫颈口未开张,没有细菌进入到宫腔[20],所以CEH组犬子宫组织没有发生炎性细胞浸润等炎症过程,机体不表现患子宫内膜炎较明显的临床症状。CEH增生的程度与是否有症状无直接关联,只有并发或继发炎症时才出现症状。当子宫颈口开张时细菌进入宫腔,子宫内容物被污染进而发生炎症反应,而后CEH才表现出较明显的子宫蓄脓的临床症状[21-23]。
值得注意的是,De Bosschere等[10]采用计算机图像分析系统对26只健康母犬和42只疑似宫腔积脓母犬的子宫进行组织学检查,结果发现在42只存在疑似宫腔积脓临床症状的母犬中,有12例子宫无炎症反应,因此单纯进行临床检查很难对子宫内膜炎进行确诊,即临床上有症状但无炎症的情况很容易被误诊[24]。本研究在30例出现相关临床症状并经B超检查宫腔含液性内容物的患犬中,有1只犬的临床症状仅为外阴有少量分泌物,在病理上并无变化。出现这种情况可能是由于雌激素或孕激素紊乱造成机体产生与“假孕”相似的临床症状[25-27],或者该犬子宫并无异常,分泌物来自于阴道。其余患犬的子宫组织样本均呈轻或重度炎性浸润。重度炎性浸润的子宫样本中,内膜萎缩型的IL-1β和IL-6基因的mRNA含量明显升高,且IL-6在内膜增生型与萎缩型重度炎性浸润子宫组织中的基因表达差异结果与Hagman等[28-30]的研究结果相似。所以,当母犬出现相关的临床症状时,并不能说明其子宫组织发生了炎症反应,或确定发生炎症反应的轻重程度。相反,未出现临床症状的母犬也会患子宫内膜炎,在组织病理上呈现出子宫内膜囊性增生或亚临床型子宫蓄脓的病理变化[31]。同时,该病的严重程度与犬所处发情周期的阶段、子宫颈是否开放、子宫内是否存在细菌感染情况、疾病持续时间的长短及生殖道及生殖系统外的损害程度等因素有关[32-33],所以,观察患犬的临床症状只能缩小疾病的诊断范围,对犬子宫内膜炎的诊断起到一定的指导作用,但不能起到确诊作用。
B超影像学对子宫内膜炎的诊断也有着一定的指导意义,B超影像学可用于观察子宫腔大小、子宫轮廓、子宫腔内是否有渗出物、子宫内是否存在肿瘤、子宫内膜是否增厚或萎缩,但健康的子宫在B超下很难看到。且超声检查增生存在一定的局限性:对于子宫增大不明显、症状不典型的患犬病例,诊断较困难,很难显示出异常图像;当发现增生后,不能明确区分内膜增生过长、内膜息肉及局限型宫体癌;且B超只能用于诊断密度比较大的肿瘤或增生;在B超图像上,可以发现并诊断出纤维性增生,但很难诊断出囊性腺体增生[34-35]。B超检查虽然可提示萎缩的子宫内膜厚度,但不能作出病因诊断[36]。子宫萎缩的B超诊断需联合腹腔镜,并反复抖动腹腔镜,才能在B超下确定极度萎缩的子宫的位置[37]。
血液学检查对诊断该病同样有着重要的意义,它可以发现体内潜在的病理过程,了解疾病的进程,但不可单独用于临床诊断。患病初期的犬,血液中白细胞数量一般不高,随着病情发展,血液中白细胞总数的数量变化比较明显,白细胞总数从逐步升高到急剧升高。且有些重度炎性浸润型子宫伴有不同程度的贫血,可能是由于子宫发生出血性炎症,炎症渗出物即脓汁含有大量红细胞,血管通透性增强所致[38]。有临床症状组犬的子宫组织可以在病理切片中看到炎症细胞,但却存在白细胞数量减少的情况,这种情况在临床上是偶尔会遇到的,出现这种情况的原因首先可能是机体出现白细胞生成障碍,由于感染、免疫学等因素,使得免疫器官胸腺受损、骨髓造血功能受损,且又由于白细胞破坏过多,使得外周血液中白细胞含量减少[39]。这种情况的出现,与任守爱等[16]和邵卫国等[24]的研究结果一致。其次可能是机体白细胞分布异常,由于感染、免疫学等因素,使边缘池中的白细胞增多,循环池中的白细胞减少[40-41]。
缺乏临床症状并不是排除犬子宫内膜炎的根本依据,有临床症状的犬也并不一定患有子宫内膜炎,因此要以有无临床症状为基础,再结合影像学、解剖学、血液学与组织病理学等方面的检查,才能得到比较可靠的诊断结论。本研究提出的子宫内膜炎分类方法是在进行客观的病理组织学检查基础上总结得出的,可为子宫内膜炎的临床诊疗及深入研究提供一定的参考依据。
4 结 论
本研究通过观察患犬在临床上有无患子宫内膜炎的常见症状、子宫内膜结构在组织学上有无囊性扩张、子宫内膜与肌层厚度(Endo/Myo)比值,以及基质成分和炎性细胞浸润情况,并结合B超影像学、解剖学、血液学及RT-qPCR(IL-1β、IL-6和IL-8)检测结果,将犬子宫内膜炎在解剖学和组织病理学上进行了更深入的分类:无临床症状组(健康类和囊性子宫内膜增生类)和临床症状组(无炎症类、轻度炎性浸润类、增生型重度炎性浸润类和萎缩型重度炎性浸润类),对指导临床诊治具有一定的参考价值。
