COL3A1对胃癌细胞增殖及侵袭影响的实验研究
2022-04-24姜洪伟白钰灵套格苏李海军胡锦峰
姜洪伟,胡 琦*,王 举,白钰灵,套格苏,李海军,胡锦峰
(1.内蒙古自治区人民医院 胃肠外科,内蒙古 呼和浩特010017;2.内蒙古赤峰市敖汉旗医院 普外科;3.内蒙古赤峰市医院 肛肠外科)
我国胃癌(GC)发病数占全球的42.6%,死亡数占全球胃癌的45.0%,在全球所有的国家中居发病率第5位、死亡率第6位[1]。细胞外基质(ECM)具有多种功能——它为干细胞创造了一个生态区域,包括调节细胞间化学和机械信号网络,血管生成,先天和适应性免疫反应,以及细胞的迁移和侵袭[2-3]。ECM成为癌症进展和治疗反应的关键调节因子之一,能够调节癌症的基本特征[4]。胶原蛋白是ECM的重要组分,COL3A1基因编码Ⅲ型胶原α-1链。A J d’Ardenne 等人[5]早在1984年就对不同良恶性肿瘤中COL3A1的表达进行了免疫组化染色,结果显示其在所有的肿瘤标本中均为阳性染色;良性肿瘤中以平滑肌瘤、肌腱鞘巨细胞瘤Ⅲ型胶原表达量最高,恶性肿瘤中以平滑肌肉瘤、纤维肉瘤胶原表达量最高。Hongyu Shen等[6]利用在线生物信息软件预测胃癌中表达上调的基因及其上游miRNAs,并进行生存分析,发现COL3A1在胃癌中表达上调,并且可以预测胃癌的预后。本课题组前期采用实时定量PCR法(qRT-PC)及免疫组化法检测胃癌及其正常组织中COL3A1的mRNA及蛋白表达水平,发现胃癌组织中COL3A1的mRNA及蛋白表达水平均显著高于正常组织。本研究采用靶向COL3A1的干扰慢病毒(3个靶点)及阴性对照慢病毒转染胃癌细胞株MGC803,嘌呤霉素抗性筛选稳转细胞株,qRT-PCR法及Western blot法筛选出转染效率高的胃癌细胞株,进行后续MTT及Transwell实验,进一步探讨COL3Al在胃癌增殖、侵袭及迁移中所扮演的角色。
1 材料与方法
1.1 实验材料及仪器MGC803 细胞(北京 Biobw,bio-81816)、青霉素-链霉素溶液(武汉普诺赛,PB180120)、RPMI-1640 培养基(武汉普诺赛,PM150110/500 ml)、0.25%胰酶(美国 Hyclone,SH30042.01/100 ml)、COL3A1 基因敲除慢病毒(上海吉凯基因)、MTT(上海 Biosharp,5 g)、4%多聚甲醛(上海碧云天,P0099-100 ml)、1%结晶紫染色液(北京索莱宝,G1062)、Matrigel 基质胶(美国BD Biocoat,356234)、PVDF膜(Millipore,ISEQ00010)、ECL发光液(Tanon,180-5001)、BCA蛋白浓度测定试剂盒(Beyotime,P0010)、荧光定量PCR仪(美国Applied Biosystems,ABI-7500)、微量分光光度计(美国ThermoFisher,Nanodrop 2000)、SDS-PAGE电泳仪(Bio-Rad,Mini Protean 3)、湿法转膜仪(Bio-Rad,170-3930)、脱色摇床(金坛市医疗仪器,TY-80R)、化学发光检测系统(Tanon,5200)。
1.2 方法
1.2.1细胞培养 MGC803细胞在含有10%胎牛血清和100 U/ml青霉素-链霉素溶液的RPMI-1640细胞培养液,37℃、5% CO2的细胞培养箱中培养。
1.2.2细胞转染 (1)嘌呤霉素浓度筛选:浓度分别为0、0.5、1、2、3、4、5 μg/ml,培养1周。调整浓度为5×104cells/ml后加入有促转染剂polybrene(8 μg/ml)新鲜培养基,配置悬液,计算公式:病毒体积=(MOI×细胞数目)/病毒滴度。加入嘌呤霉素后观察荧光蛋白表达。
1.2.3qRT-PCR法 根据TAKARA PrimeScriptTMRT reagent Kitwith gDNA Eraser试剂盒的标准操作步骤进行,提取 total RNA,3%琼脂糖凝胶电泳及紫外分光光度计测定RNA浓度和纯度,A260/A280比值在1.8-2.0之间。反转录后以 cDNA 为模板进行荧光定量 PCR。COL3A1引物序列:正向TTGAAGGAGGATGTTCCCATCT,反向ACAGACACATATTTGGCATGGTT。GAP
DH引物序列:正向GAGTCAACGGATTTGGTCGT,反向TTGATTTTGGAGGGATCTCG。反应体系为cDNA 2 μl、PCR 上游引物 0.4 μl、PCR 下游引物 0.4 μl、SYBR Green solution 10 μl、灭菌双蒸水 7.2 μl。每个样品mRNA相对表达量通过计算其各自的Ct值计算得出。
1.2.4Western blot法 培养基PBS洗涤,1000转离心 5 min,将细胞浓度调整为3×104cells/ml。接种于培养板培育48 h。PBS洗涤后,0.2 ml/孔加入裂解液,置入-80℃超低温冰箱中。离心后留下细胞上清液,-20℃下保存。配置BCA工作液:按照0、1、2、4、8、12、16、20 μl的浓度量加入96孔中。加入BCA工作液孵育。测定吸光度值。清洗玻璃板后灌胶,80V电泳30 min,样品进入分离胶后,改120V电泳90 min。电流320 mA开始转膜。转膜结束后用1×丽春红染液染膜5 min。浸泡TBS后,转移到5%脱脂奶粉、TBST溶液的平皿中,脱色摇床封闭。TBST稀释一抗,4℃孵育,脱色摇床清洗10 min,重复3次。二抗的孵育首先使用TBST溶液1∶5000稀释,然后孵育2h,脱色三次。用Tanon ECL作为发光试剂,Tanon 5200化学发光成像仪拍照,留下拍照后图片。
1.2.5MTT实验 培养基终止消化后离心5 min。倒掉上清,加入3 ml培养基重悬细胞。胰酶消化细胞,离心后去上清,重悬细胞。细胞接种在6孔板中,每孔1×106个细胞,接种后培养12 h贴壁。敲减COL3A1处理下,细胞培养至设定时间(0、12、24、48 h)后,每孔分别加入5 mg/ml MTT溶液20 μl,培养4 h后去除,加入150 μl DMSO摇匀。吸光值用酶标仪进行测定,波长570 nm,根据吸光值和时间绘制生长曲线。
1.2.6细胞迁移实验 PBS洗涤后胰酶消化,放入新培养基计数。10% FBS的培养液加入孔板,使细胞浓度为(5×105/ml),Transwell小室加入100 μl 悬液并放培养24 h。取出小室,吸净培养液后清理掉上层细胞,PBS洗涤,甲醇固定。PBS洗涤三次,擦干后使用1%结晶紫染液染色后PBS清洗3次,常温倒置晾干。显微镜下(200倍)拍照并计算各视野中穿膜细胞的平均数。
1.2.7细胞侵袭实验 将无血清培养基与预冷的Matrigel基质胶9∶1混匀。
将上步Matrigel基质胶100 μl加入Transwell小室,然后放入37℃、5% CO2培养箱中,等待基质胶凝固。其余实验步骤同迁移实验相同。
1.3 统计学分析实验所得数据采用平均数±标准差(Mean±SD)表示,每组实验至少重复三次,数据处理软件为GraphPad Prism 6,两组样本均值之间的比较采用t检验,多组样本均值之间的比较采用ANOVA检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 细胞培养
常规培养MGC803胃癌细胞株,发现正常的MGC803细胞多为梭形或多角形,也有部分为圆形。呈单核、单层贴壁生长的特点(图1)。

图1 光镜下 MGC803 细胞形态观察(200 倍)
2.2 MGC803细胞转染
靶向COL3A1的干扰慢病毒转染48 h后,倒置荧光显微镜下可见COL3A1 shRNA慢病毒成功转染到MGC803细胞内(图2)。将稳定转染的干扰组及对照组细胞株分别分为阴性对照组(NC组)、shRNA 1组、shRNA 2组和shRNA 3组,未转染慢病毒的细胞株为空白对照组(Control组)。

图2 转染后细胞荧光携带情况
用qRT-PCR和Western blot法筛选出转染效率最高的细胞株,qRT-PCR结果显示:转染shRNA-COL3A1慢病毒后,COL3A1的mRNA表达水平均显著下降(P<0.05);与NC组相比,COL3A1在shRNA 1组、shRNA 2组、shRNA 3组的mRNA表达同样显著下降,而NC组与Control组相比细胞的mRNA表达无明显变化(P>0.05),在这三组中抑制效果最好的是shRNA 1组(P<0.01)、shRNA 3组(P<0.001)(图3)。选择shRNA 1组和shRNA 3组进行后续实验,后续实验中shRNA 1组及shRNA 2组为该步中的shRNA 1组和shRNA 3组。重新分组后进行Western Blot实验,结果表明,shRNA-COL3A1转染后,胃癌细胞中COL3A1的蛋白表达水平均显著降低,其中shRNA 2组抑制效果更显著(P<0.01)(图4),这与PCR的结果一致。

图3 shRNA-COL3A1转染后COL3A1 mRNA表达水平(*P<0.05,**P<0.01,***P<0.001 vs.Control;##P<0.01,### P<0.001vs.NC)

A:WB曝光条带;B:COL3A1的蛋白表达水平
2.3 MGC803 MTT
转染后各组细胞增殖能力通过MTT法检测(表1),通过绘制不同时间点的光吸收值得到生长曲线,结果发现shRNA-COL3A1转染后,胃癌细胞的生长在48 h内受到明显抑制,在各时间点OD值均低于NC组(P<0.05),其中shRNA 2组抑制效果最为显著(P<0.0001)(图5)。

表1 敲减COL3A1后各组MGC803细胞平均吸光值(OD值:Mean±SD)

图5 shRNA-COL3A1转染后48 h内胃癌细胞增殖情况 (*P<0.05,**P<0.01,***P<0.001,****P<0.0001 vs NC,n=3)
2.4 MGC803细胞迁徙
通过Transwell小室检测细胞迁移情况,计数膜下细胞数。结果发现shRNA-COL3A1转染后,shRNA 1组(P=0.0029)及shRNA 2组(P<0.0001)胃癌细胞的迁移能力显著降低,其中以shRNA 2组最为显著(P<0.0001)(图6)。
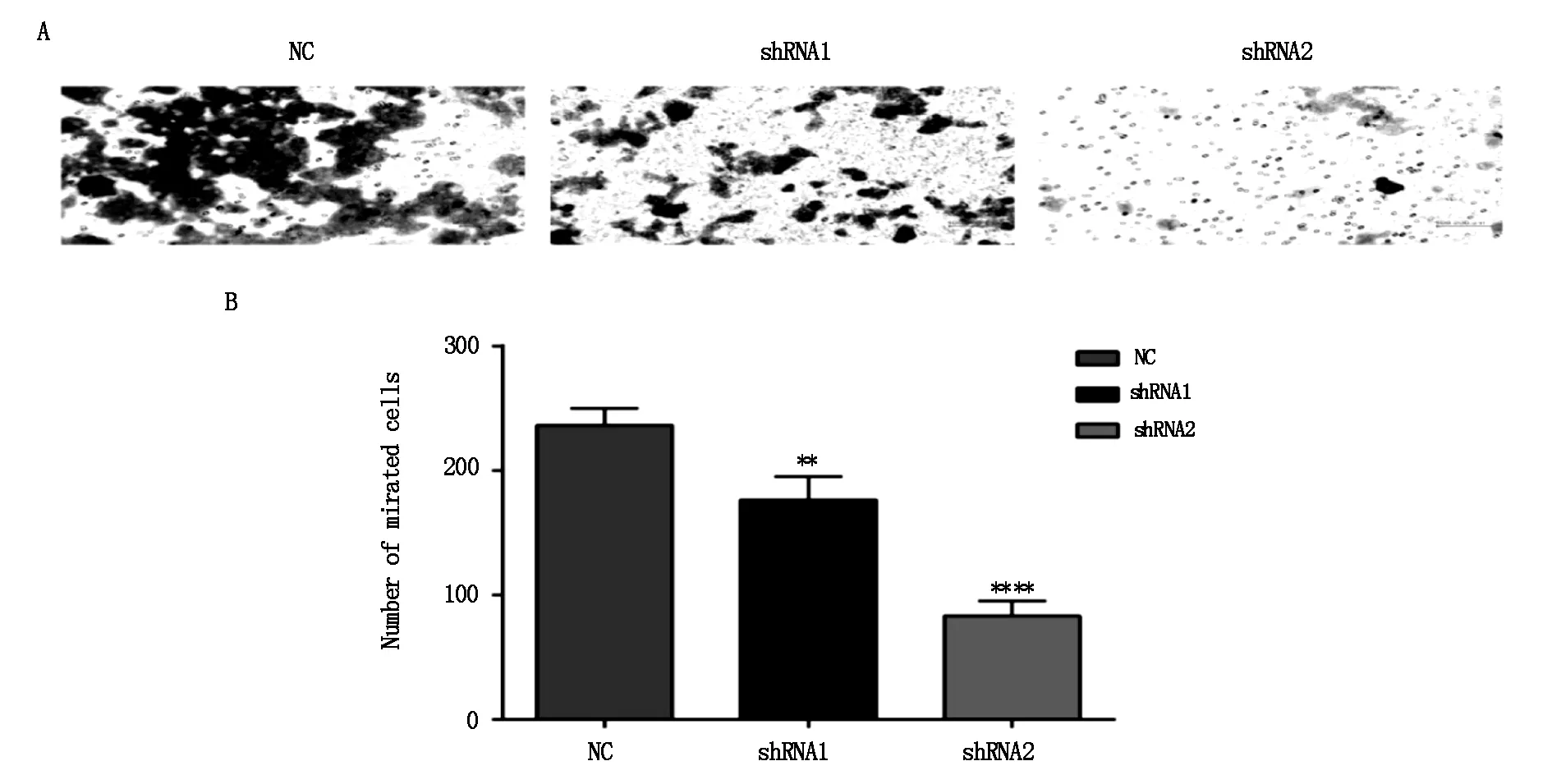
A:显微镜下穿膜细胞观察(200 倍);B:各组穿膜细胞数量统计
2.5 MGC803细胞侵袭
通过Transwell小室(加Matrigel基质胶)检测细胞侵袭能力,结果发现shRNA-COL3A1 转染后,shRNA 1组(P=0.0046)及shRNA 2组(P=0.0002)胃癌细胞的侵袭能力均显著降低,其中同样以shRNA 2组最为显著(P<0.001)(图7)。

A:显微镜下穿膜细胞观察(200倍);B:各组穿膜细胞数量统计
3 讨论
肿瘤的侵袭和转移是癌症相关死亡的主要原因,为了进一步探究COL3A1与胃癌的关系,本研究通过COL3A1敲减的慢病毒转染人胃癌细胞株BGC-803,并检测经处理后胃癌细胞的迁徙及侵袭能力,结果显示敲减COL3Al能抑制胃癌细胞的增殖、迁移及侵袭,说明COL3Al可能是胃癌侵袭及转移过程中的重要角色。推测这是由于COL3A1表达降低后胃癌细胞周围胶原网络刚度下降所致。细胞外基质硬化导致的细胞内收缩可引起肌动蛋白硬度和细胞迁移增加[7]。肿瘤硬度增加可能在几个方面调节肿瘤进展。例如增加基质刚度会增加细胞骨架张力,以促进粘连聚集,并增加生长因子依赖性的胞外调节蛋白激酶(ERK)[8]。此外,基质刚度促进整合素聚类,导致黏着斑激酶1(FAK1)的激活,进而激活ERK通路,引起细胞迁移、侵袭和增殖[9]。小鼠肿瘤模型中FAK1的缺失抑制了肿瘤细胞的局部侵袭和转移,这表明FAK1的激活可能是引起肿瘤ECM刚度增加、促进肿瘤细胞转移的重要介质[10]。王颉[11]等发现COL3A1可以通过蛋白激酶B(PKB) /哺乳动物雷帕霉素靶蛋白(mTOR)通路发挥促结肠癌肿瘤生长的作用。Wang Xiao-Qing[12]等同样发现COL3A1在结直肠癌中存在过表达,并且是影响预后的危险因素,COL3A1还可以通过刺激磷脂酰肌醇3激酶(PI3K)-AKT信号通路促进结肠癌细胞增殖。Becky[13]等学者通过体外动物实验发现当COL3A1缺乏后,乳腺癌的黏附、侵袭和迁移均被抑制,癌细胞的增殖能力增强。而艾尔肯·肉孜比拉力[14]等的研究结果则不同,她们发现COL3A1在宫颈癌中为低表达,且人乳头状瘤病毒(HPV)阴性的宫颈癌细胞COL3A1的表达水平更高,过表达COL3A1后的宫颈癌细胞迁徙能力下降,这提示 COL3A1 在不同肿瘤中可能存在不同的功能。引起这种不同结果的原因可能是ECM与肿瘤细胞间复杂的动态变化所致。
综上所述,COL3A1在恶性肿瘤的发生发展过程中扮演着重要的角色,这为探究微环境与肿瘤细胞之间的相互作用提供了新的思路。但是COL3A1与胃癌的关系还是有待进一步的深入研究。本研究因客观原因仍存在很多不足,如未检测COL3A1在不同胃癌细胞系中的基础表达情况,也未构建COL3A1过表达细胞系对其在胃癌增殖、转移中的作用进一步作证,这也是我们下一步的研究方向。
