AK4在大鼠雄性生殖系统中的表达特点及应激反应机制
2022-04-24李建远
李 岩,李建远
(烟台大学生命科学学院,山东 烟台 264005)
腺苷酸激酶(adenylate kinase,AK)是普遍存在于动物、植物及微生物体内的单体酶,通过催化可逆的高能磷酰基的转移反应,维持细胞内腺苷酸组成的稳定,并且可实现能量由生成部位向消耗部位传递[1-2]。迄今为止,在高等脊椎动物中已经发现了9种AK家族的同工酶 (AK1—AK9)[3]。AK家族各成员在细胞内的分布、组织表达特性和底物特异性等方面均有差异。
AK家族成员可广泛参与细胞凋亡和应激反应。AK4是AK家族中唯一不具有催化活性的应激反应蛋白,其过表达可对应激状态下的细胞起到保护作用,在应激条件下如缺氧、H2O2处理,AK4的mRNA和蛋白表达水平均显著上调[4-6],AK4过表达的细胞系在应激状态下的成活率明显高于对照组。免疫共沉淀证明,AK4可能是通过与ADP/ATP转化酶(ANT)相互作用来实现对细胞的保护作用[6]。此外,AK4基因在耐缺氧、抗肿瘤药物耐药、调节线粒体活性等方面发挥重要作用,并且AK4基因的表达水平在多种疾病中显著上调[7-8]。因此,研究AK4在疾病的发生和发展过程中的生物学功能可为疾病的治疗提供新的药物靶点。
睾丸和附睾是高等动物精子发生、成熟并获得运动和受精能力的重要雄性生殖器官,这些过程需要充足的能量供应[9-10]。本研究系统分析了AK4在成年雄性大鼠各组织及在不同周龄大鼠睾丸和附睾中的表达特点,并探究了AK4在雄性大鼠生殖系统中的应激调控机制,以期为深入探讨雄性生殖系统中AK4在应激状态下参与的信号通路提供数据支持和理论依据。
1 材料与方法
1.1 实验动物
SPF 级雄性Sprague-Dawley大鼠(50只,体重均达到350~400 g)购买于济南朋悦实验动物繁育有限公司,动物许可证号 SCXK(鲁)2019-0003,质量合格证流水号:1107261911003748。实验动物饲养温度20.0±2.0 ℃,相对湿度为 40%~70%,采用人工照明,且12 h/12 h 明暗交替的条件下适应7 d,期间自由饮食饮水。本研究动物实验经过烟台大学动物伦理委员会审查批准。
1.2 实验试剂
Bouin′s固定液购自sigma公司。RNA提取试剂盒RNAiso Plus购自TaKaRa公司(D9108A)。ReverTra Ace 反转录酶购自日本TOYOBO公司(FSK-100)。PCR扩增试剂盒购自TaKaRa公司(DRR001A)。DL2000 DNA Marker 购于TaKaRa公司(D501A)。AK4抗体购自ProteinTech公司(13206-1-AP)。内参抗体GAPDH购自Santa Cruz公司(sc-25778)。阿霉素(注射用盐酸多柔比星,国药准字H20013334)购自辉瑞制药有限公司。MDA试剂盒购自南京建成生物工程研究所(A003-1)。大鼠β-actin、AK4引物均由primer 5.0软件设计,由上海生工生物有限公司合成。引物序列见表1。
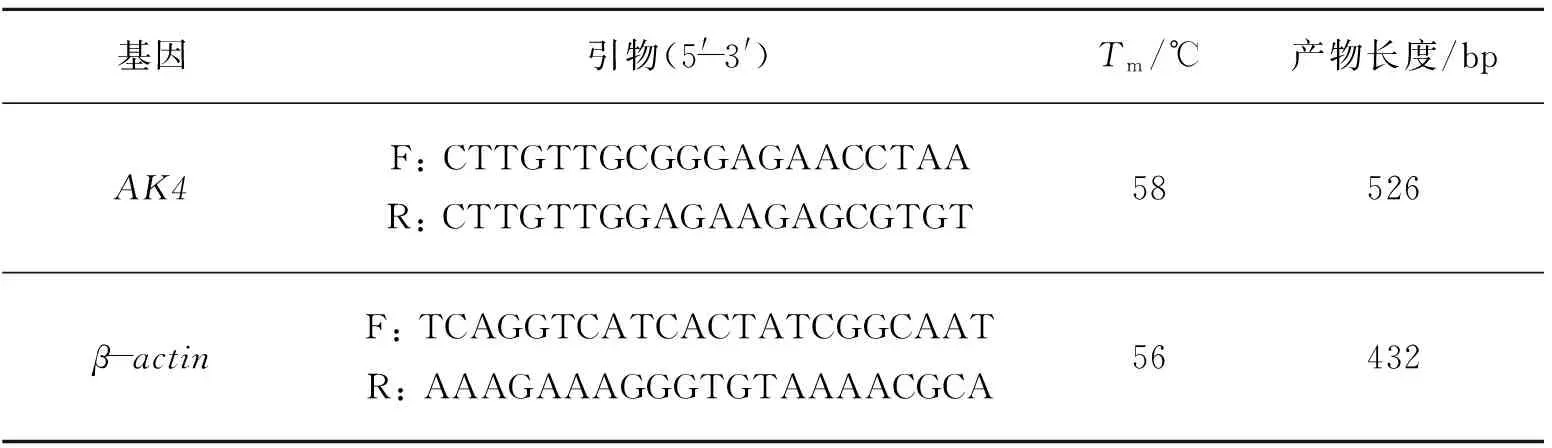
表1 引物序列、Tm值及PCR扩增产物长度
1.3 实验方法
1.3.1 RNA提取 大鼠处死后迅速分离各组织,于液氮中冻存。各组织总RNA提取严格按照说明书步骤操作。分光光度计测定总RNA浓度及纯度。
1.3.2 反转录及半定量PCR 取1μg总RNA作为反转录模板,利用ReverTra Ace试剂盒合成cDNA第一条链。以cDNA为模板,使用AK4和β-actin引物进行PCR扩增。操作步骤严格按照PCR扩增试剂盒说明书进行。
1.3.3 Western blot 大鼠各组织蛋白质提取步骤严格按照BCA蛋白提取试剂盒说明书进行。各组织取50 μg上样,具体操作步骤参照文献[11]。
1.3.4 大鼠睾丸、附睾热应激模型的构建 将大鼠随机分为两组,对照组与热应激组各8只。水合氯醛麻醉后,将热应激组大鼠阴囊浸于42 ℃水浴中20 min,擦干后回笼,待恢复4 h后处死[12]。取睾丸、附睾组织分别用于RNA和蛋白质提取。对照组大鼠阴囊浸于室温水浴中20 min,其余操作步骤同实验组。
1.3.5 大鼠睾丸、附睾氧化应激模型的构建 将大鼠随机分为3组,分别为对照组、2 mg/kg阿霉素组、3 mg/kg阿霉素组(每组各8只)。实验组每周腹腔注射阿霉素,对照组注射生理盐水,连续处理5周后处死[13]。取两侧睾丸和附睾组织,一侧睾丸和附睾用Bouin′s固定液固定,用于组织形态观察;另一侧睾丸和附睾用于MDA含量的测定及RNA和蛋白质的提取。
1.3.6 苏木素-伊红(HE)染色 通过HE染色观察组织形态。具体操作步骤参照文献[13]。
1.3.7 MDA检测 MDA含量测定方法严格按照试剂盒说明书进行。MDA含量计算公式为:MDA含量(nmol/mg)=[(样本A532-样本空白管A532)/(标准品A532-标准品空白管A532)]×10 nmol/mg样品蛋白含量。
1.3.8 统计方法 所有实验数据均采用EXCEL 2019、SPSS 18.0进行统计和初步分析。统计结果用平均数±标准差表示。未配对t检验用于表示组间的差异,P<0.05表示差异具有统计学意义。
2 结果与分析
2.1 AK4在成年雄性大鼠各组织中的表达谱
通过半定量RT-PCR方法检测AK4 mRNA在成年雄性大鼠(18周龄)心、肝、脾、肺、肾、睾丸及附睾组织中的表达谱。如图1(a)所示,AK4 mRNA在各组织中呈泛在表达模式,且在心脏组织中表达量较其他组织低。如图1(b)所示,AK4 蛋白水平与mRNA表达谱一致,即在心脏组织中表达略低于其他组织。
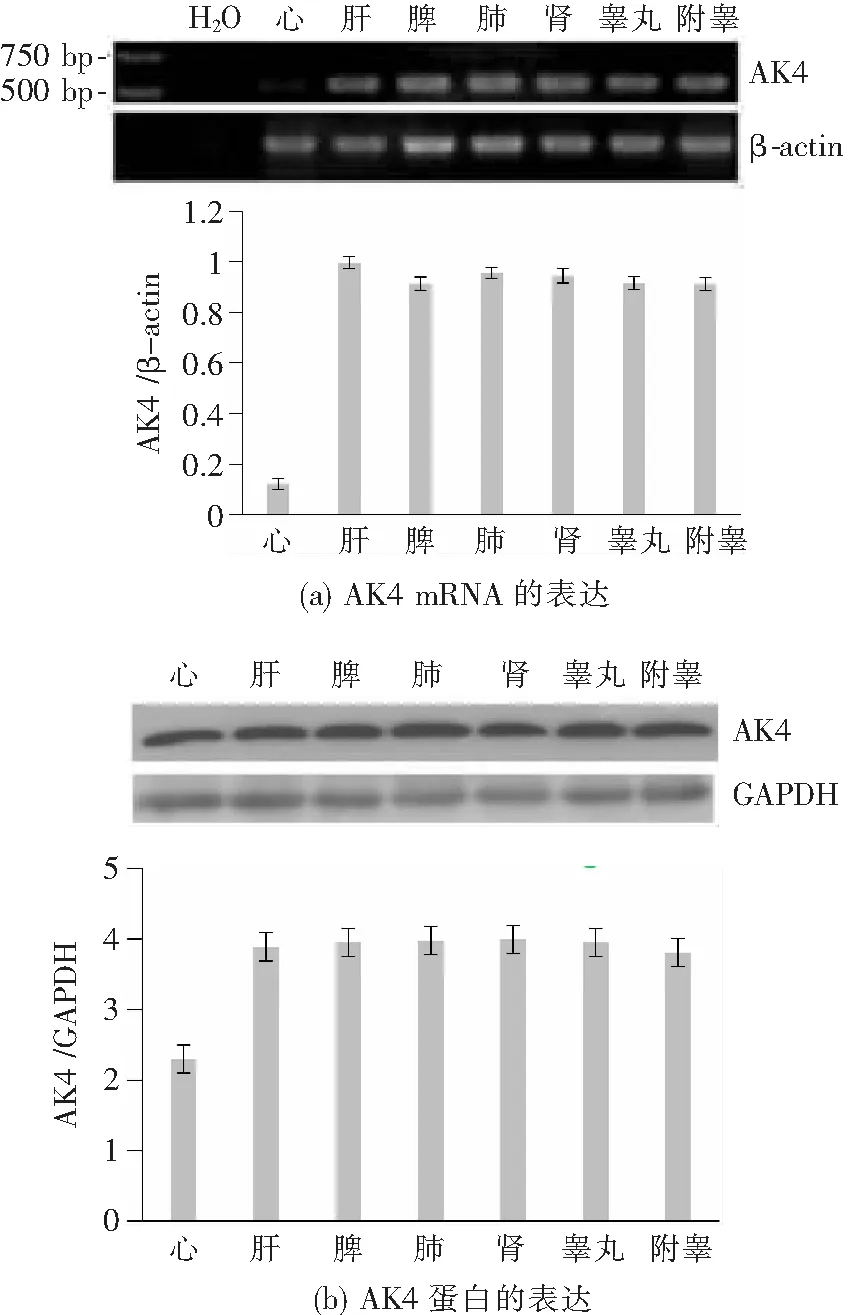
图1 AK4在成年雄性大鼠各组织中的表达谱
2.2 AK4在大鼠睾丸与附睾中的发育时序表达谱
通过半定量RT-PCR方法检测AK4 mRNA在2周龄、3周龄、4周龄、5周龄、7周龄、9周龄及18周龄大鼠睾丸、附睾组织中的表达谱,如图2所示,在睾丸组织中,AK4 mRNA水平从2周龄到4周龄逐渐上调,5周龄后表达趋于稳定;在附睾组织中,AK4 mRNA在2周龄大鼠中不表达,从3周龄到4周龄表达逐渐上调,5周龄后表达基本趋于稳定。如图3所示,Western 结果表明,在睾丸组织中,AK4蛋白从2周龄到4周龄逐渐上调,5周龄后表达趋于稳定;在附睾组织中,AK4蛋白在2周龄大鼠中不表达,从3周龄到4周龄表达逐渐上调,5周龄后表达基本趋于稳定,与AK4 mRNA表达时序相吻合。
2.3 AK4在大鼠睾丸、附睾热应激模型中的表达变化
采用半定量RT-PCR方法检测AK4 mRNA和蛋白质在大鼠睾丸、附睾热应激模型中的表达水平,结果表明,与对照组相比,热应激大鼠模型中AK4 mRNA和蛋白质的表达水平均在睾丸、附睾组织中显著上调(图4)。
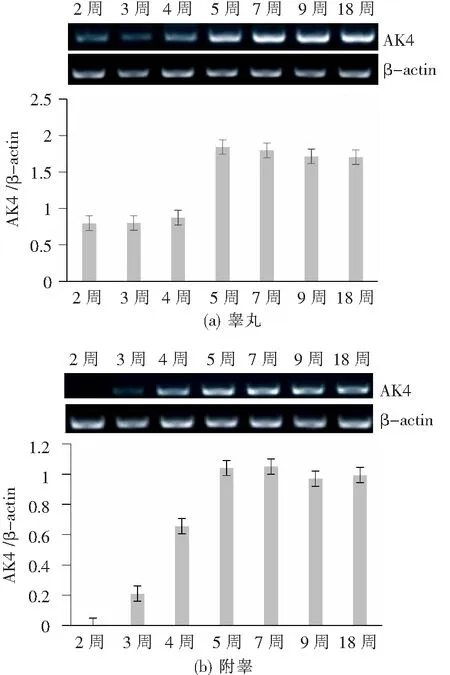
图2 AK4 mRNA在大鼠睾丸与附睾中的发育时序表达谱
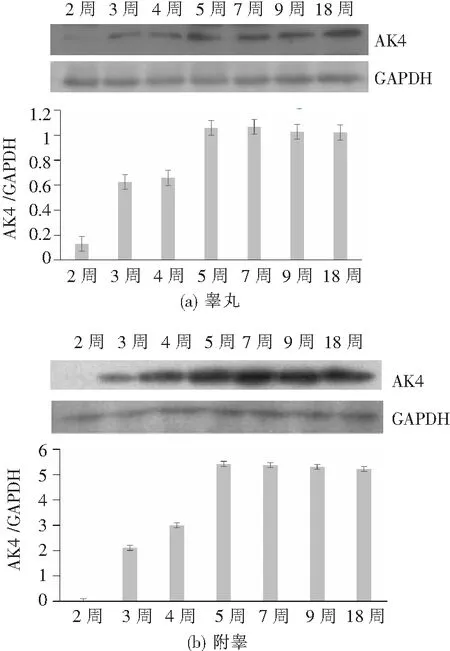
图3 AK4 蛋白在大鼠睾丸与附睾中的发育时序表达谱
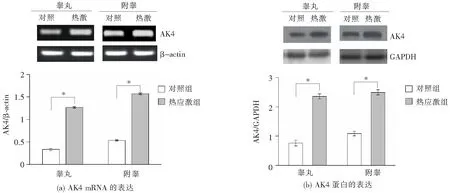
与对照组相比,*P<0.05。
2.4 AK4在大鼠睾丸、附睾氧化应激模型中的表达变化
通过腹腔注射阿霉素建立大鼠睾丸、附睾的氧化应激模型。HE染色对睾丸和附睾组织的氧化损伤程度进行了初步判断。如图5(a)所示,HE染色结果表明,与对照组相比,以2 mg/kg和3 mg/kg剂量连续腹腔注射阿霉素五周后,大鼠的睾丸组织形态受到严重破坏,且随着注射剂量的增加,损伤程度增强。对照组大鼠睾丸精曲小管排列紧密,管壁有5~7层细胞,从管外侧到中央分别为精原细胞、初级精母细胞、圆型精子细胞和长型精子细胞等不同发育期的生精上皮细胞,且细胞排列紧密,成熟精子丰富,间质和间质细胞无异常。随着注射剂量的加大,睾丸广泛性精曲小管生精细胞排列松散,结构紊乱,呈条索状,仅剩2或3层细胞;部分精曲小管内见大量脱落细胞,且成熟精子数目减少。而附睾组织的形态结构未发生明显变化(图片不显示)。
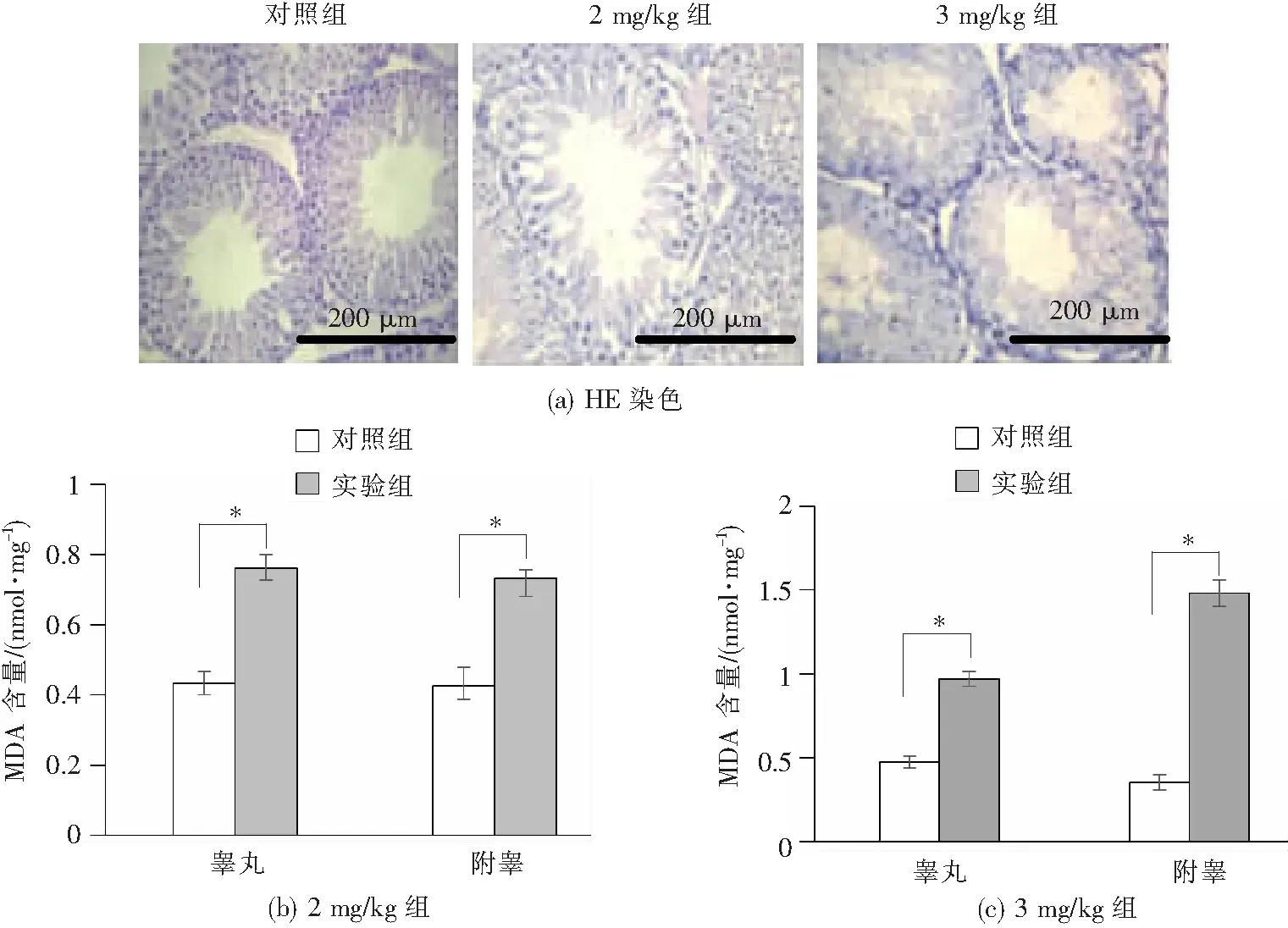
与对照组相比,*P<0.05。
脂质过氧化的产物MDA也可反映睾丸、附睾组织的氧化损伤程度。如图5(b)、(c)所示,与对照组相比,2 mg/kg剂量组大鼠睾丸和附睾组织MDA含量增加近2倍,与对照组相比差异显著(P<0.05);当注射剂量增加到3 mg/kg时,睾丸和附睾组织中MDA含量均升高2倍以上,与对照组相比差异显著(P<0.05)。
半定量RT-PCR及Western结果表明,与对照组相比,AK4 mRNA和蛋白在睾丸组织中的表达量随注射剂量增加而显著上调(P<0.05)(图6),而在附睾组织中表达无明显差异(图片不显示)。
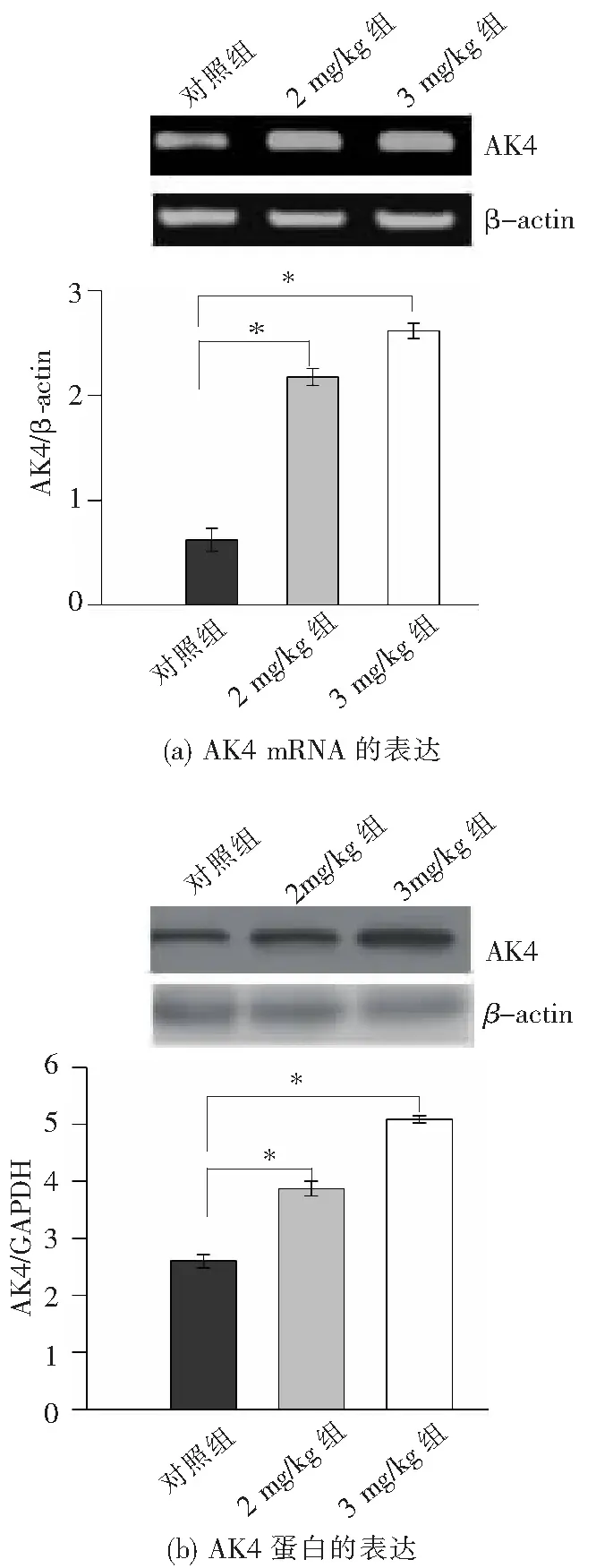
与对照组相比,*P<0.05。
3 讨 论
睾丸和附睾作为精子发生和成熟的场所,必须需要充足的能量来保证功能性精子的产生和正常的激素分泌。然而迄今为止,有关AK家族的成员在睾丸、附睾中的研究却很少有文献报道。因此系统地开展AK家族各成员在睾丸、附睾中的研究将有助于阐明其在精子发生和成熟过程中的生物学功能。本研究结果表明,AK4 mRNA和蛋白质在雄性成年大鼠各组织中呈泛在表达模式,推测AK4可能在各组织中起到一定的保护作用。AK4在大鼠睾丸与附睾中的表达水平随发育过程的进行呈现出规律性变化:在睾丸组织中,AK4 mRNA和蛋白质从2周龄开始表达,至5周龄后表达趋于稳定;在附睾组织中,AK4 mRNA和蛋白质从3周龄开始表达,至5周龄后表达趋于稳定,推测激素水平是影响发育进程中AK4表达趋势变化的主要因素,有待深入研究。
AK4作为应激调节蛋白可广泛参与应激反应过程。小鼠ATDC5细胞在缺氧条件下,AK4 mRNA的表达量上调[4]。另外通过cDNA阵列分析发现,AK4 mRNA的表达量上调的现象也同样存在于氧化应激状态下的血管平滑肌细胞中[14]。此外有文献报道四种肝脏毒性药物(扑热息痛、胺碘酮、四环素,氯仿)可导致AK4蛋白表达水平上调[3]。越来越多的数据表明,AK4在恶性肿瘤中过表达,虽然其表达特点与大多数肿瘤的分期尚无明确关系,但AK4的过表达可显著促进肿瘤的增殖、侵袭和迁移,并且改变肿瘤对治疗的敏感性,且过表达多提示预后不良和生存期较短。故AK4可以作为判断恶性肿瘤预后的指标并有望成为治疗肿瘤的潜在靶点,其临床价值值得深入研究[15]。
在雄性生殖系统中存在着众多严重影响精子质量的应激状态,如氧化应激、热应激等。在氧化应激条件下,高水平的自由基可以直接氧化损伤精子的质膜,大大降低精子的运动及精卵结合能力,并破坏精子头部DNA的完整性,引起遗传缺陷,最终将会导致雄性不育[16],而长期暴露于高温环境中可造成精子数目减少、活力降低且畸形精子数目增多[17-18]。为了确定AK4是否是雄性生殖系统中的应激状态下的标志蛋白,本研究选择高温和阿霉素作为引起生殖系统应激状态的诱导因素,分别建立了雄性大鼠睾丸和附睾的热应激模型和氧化应激模型。在热应激模型中,与对照组相比,AK4 mRNA和蛋白质表达量在睾丸和附睾组织中明显上调。阿霉素是一种蒽环类抗肿瘤类药物,在消灭肿瘤细胞的同时具有较强的细胞毒性,特别是对于睾丸组织,因其含有大量细胞分裂旺盛的精原细胞和各级精母细胞等。已有文献报道阿霉素造成生殖系统毒性主要是通过产生大量氧自由基导致,而大量的自由基可导致生殖系统严重的氧化损伤[19-20]。在氧化应激模型中,睾丸组织形态受到严重破坏,且随注射剂量的增加损伤程度增强。另外,脂质过氧化的产物MDA也可反映组织的氧化损伤程度。在模型中,睾丸和附睾组织中MDA水平均显著增加。与此同时,AK4 mRNA和蛋白在睾丸组织中的表达量随注射剂量的增加而明显上调。而附睾组织的形态和AK4的表达水平与对照组相比未发生明显变化。因此推测在大鼠雄性生殖系统中,热应激及氧化应激条件下AK4的过表达可降低外界不利因素对睾丸中生殖细胞的有害影响,对生殖细胞起到一定的保护作用。应激状态下AK4参与保护细胞的生物学机制有待于深入研究。
本研究对AK4在大鼠雄性生殖系统中的表达特点及应激反应中的表达变化进行了系统性研究,为阐明AK4在雄性生殖系统中功能以及在应激状态下参与的信号通路提供数据支持和理论依据。
