响应面法优化桑葚多糖纯化工艺及不同产物的抗运动疲劳活性比较
2022-04-24靳铁柱
靳铁柱
(西安财经大学行知学院,陕西 西安 710038)
桑葚为桑科植物桑树的成熟果穗,味甜多汁,富含多糖、黄酮、维生素、花色素和人体必需氨基酸等营养物质,具有滋阴补血、生津润燥的功效,长期食用可增强免疫力,并有助于降糖、降脂,促进血红细胞的生成[1-2]。有研究认为,以上功效的基础活性成分之一为桑葚多糖。王强等[3]发现,桑葚多糖有利于调节糖尿病大鼠的血糖水平,且对羟基自由基和超氧自由基具有较好的清除作用;韩伟等[4]指出,桑葚多糖对1,1-二苯基-2-苦基肼基(DPPH)自由基的半数抑制率优于常用抗氧化剂——抗坏血酸和芦丁;刘兵[5]利用动物疲劳模型研究发现,桑葚多糖可显著提高小鼠的力竭游泳时间,并降低其运动后体内血乳酸与尿素氮含量,具有较好的抗疲劳作用。
由于桑葚多糖的传统制法采用石油醚脱色,Sevag试剂(V氯仿∶V正丁醇=1∶4)去除蛋白质,不仅操作费时繁琐,且易破坏多糖结构,并可残留有毒溶剂,而大孔树脂具有稳定性高、吸附容量大、吸附速度快、选择性好、可重复使用等优点,已被广泛用于去除粗多糖中色素与蛋白质[6-7]。因此,本研究利用大孔树脂具有机械筛分与化学吸附的特性,吸附桑葚粗多糖溶液中色素与蛋白质杂质,探讨最佳纯化工艺条件,并通过动物试验比较纯化前后多糖化合物的抗运动疲劳活性,从而为桑葚多糖的开发与利用提供参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
桑葚,购于西安农副产品批发市场;苯酚、浓硫酸、无水乙醇、无水乙醚、三氯醋酸(均为分析纯),国药集团化学试剂有限公司;D-无水葡萄糖对照品,中国食品药品检定研究院;H103、D101型大孔树脂,粘津浩聚树脂科技有限公司;HPD300、DA201、DM301、S-8、NKA-9型大孔树脂,河北沧州宝恩化工有限公司;血乳酸(BLA)、乳酸脱氢酶(LDH)检测试剂盒,厦门仑昌硕生物科技有限公司;考马斯亮蓝试验试剂盒,南京建成生物工程研究所;试验用水为纯化水。
SPF级雄性昆明小鼠(2月龄,体重16~24 g,饲养环境温度和相对湿度分别为20~25℃和50%~70%),购于西安益丰达生物科技有限公司。
1.1.2 仪器与设备
L9型紫外可见分光光度计,上海仪电分析仪器有限公司;ME204型电子分析天平,梅特勒-拖利多有限公司;XC-600C型超声波器,济宁鑫欣超声电子设备有限公司;RE-3000A型旋转蒸发仪,上海越众仪器设备有限公司;TD5AWS型低速离心机,湖南湘仪实验室仪器开发有限公司。
1.2 方法
1.2.1 桑葚粗多糖制备
称取500 g桑葚,于60℃烘箱干燥后粉碎,过80目筛,加入95%乙醇溶液1 000 mL浸泡12 h,旋转蒸发干溶剂,收集桑葚渣于60℃烘干。精密称取100 g桑葚渣,按照料液比1∶27(g/mL)加入纯化水,于72℃、320 W功率下超声处理25 min,离心回收上清液,将提取液减压蒸馏浓缩至浸膏后,加入95%乙醇溶液500 mL,4℃下静置2 h后过滤,重复2次,合并沉淀物,经冷冻干燥后,即得桑葚粗多糖[8]。
1.2.2 树脂纯化效果指标测定
1.2.2.1 脱色率
不同样品溶液分别于450 nm波长测定吸光度值A,计算脱色率[9]。
脱色率(%)=(A脱色前-A脱色后)/A脱色前×100
1.2.2.2 蛋白质脱除率
采用考马斯亮蓝染色法测定不同样品的蛋白质含量[10],计算蛋白质脱除率。
蛋白质脱除率(%)=纯化后的蛋白质含量/纯化前的蛋白质含量×100
1.2.2.3 多糖回收率
采用苯酚-硫酸法测定不同样品的多糖含量,计算多糖回收率[11]。
多糖回收率(%)=纯化后的多糖含量/纯化前的多糖含量×100
1.2.2.4 综合评价指数
参考刘冲英等[12]评价大孔树脂纯化地黄粗多糖的方法,对纯化前、后样品的脱色率、蛋白质脱除率及多糖回收率加权求和计算综合评价指数,以评价桑葚粗多糖不同条件下的纯化效果,综合评价指数计算公式如下:
综合评价指数=0.3×脱色率+0.3×蛋白质脱除率+0.4×多糖回收率
1.2.3 静态吸附-解吸试验
将经过预处理的2 g不同型号树脂分别置于100 mL锥形瓶内,加入5 mg/mL桑葚粗多糖水溶液20 mL,于25℃振荡吸附12 h后过滤,分别向过滤后的树脂中加入50 mL去离子水,于相同条件振荡解吸12 h后过滤,按照“1.2.2”中所述方法测定处理前、后样品溶液中色素值、蛋白质含量与多糖含量,比较不同类型树脂的纯化能力[13]。
1.2.4 动态吸附-洗脱试验
1.2.4.1 试验步骤
准确称取10 g静态吸附筛选的最佳型号树脂,湿法装柱(Ф2 cm×50 cm)后,加入一定质量浓度的桑葚粗多糖溶液,控制流速为1.0 mL/min上样后,静置吸附30 min,采用去离子水作为洗脱液,按照一定流速洗脱目标化合物后,测定收集液中脱色率、蛋白质去除率及多糖回收率。
1.2.4.2 上样液浓度考察
固定上样液体积60 mL,洗脱流速1.0 mL/min,洗脱液体积130 mL,按照“1.2.4.1”试验步骤,考察不同上样浓度(5、10、15、20、25 mg/mL)对脱色率、蛋白质去除率和多糖回收率的影响。
1.2.4.3 上样液体积考察
固定上样液浓度15 mg/mL,洗脱流速1.0 mL/min,洗脱液体积130 mL,按照“1.2.4.1”方法,考察不同上样液体积(20、40、60、80、100、120 mL)对脱色率、蛋白质去除率和多糖回收率的影响。
1.2.4.4 洗脱流速考察
固定上样液浓度15 mg/mL,上样液体积60 mL,洗脱液体积130 mL,按照“1.2.4.1”方法,考察不同洗脱流速(0.5、1.0、2.0、3.0、4.0 mL/min)对脱色率、蛋白质去除率和多糖回收率的影响。
1.2.4.5 洗脱液体积考察
固定上样液浓度15 mg/mL,上样液体积60 mL,洗脱流速1.0 mL/min,按照“1.2.4.1”方法,考察不同洗脱液体积(100、110、120、130、140、150 mL)对脱色率、蛋白质去除率和多糖回收率的影响。
1.2.5 响应面试验设计
根据单因素试验结果,采用Box-Behnken试验设计原理,以综合评价指数为考察指标,上样液浓度、洗脱流速与洗脱液体积为考察因素,进行响应面优化试验,以确定桑葚粗多糖的最佳纯化工艺,具体因素水平见表1。

表1 响应面试验设计因素与水平表Table 1 Factorsand levels of response surface experiment
1.2.6 抗运动疲劳活性测定
1.2.6.1 动物试验设计
60只健康雄性小鼠经适应性喂养7 d后,随机分为对照组、提取组和纯化组,每组各20只。对照组给予0.85%生理盐水,而提取组和纯化组小鼠每日分别灌胃纯化前和纯化后的桑葚多糖0.30 mg/g BW,灌胃体积均为0.2 mL/10 g BW,每天经口灌胃1次,连续灌胃30 d[14]。
1.2.6.2 力竭游泳时间
末次灌胃后,各组随机选择10只小鼠,于鼠尾绑定重物后,置于泳池内,记录小鼠入水至沉没15 s无法浮出水面的时间。
1.2.6.3 血液生化指标测定
末次灌胃后,将各组剩余小鼠置于泳池内游泳30 min后,取出擦净,休息10 min,于眼眶处取血离心,利用BLA、LDH检测试剂盒测定运动后小鼠血清中BLA含量和LDH活力[15]。
1.2.7 数据处理
采用Origin 8.0软件进行数据处理并作图,动物试验采用SPSS19.0软件进行方差分析。试验数据均为3次重复试验结果的平均值,结果以±s表示。
2 结果与分析
2.1 静态吸附-解吸试验结果
表2为不同型号大孔树脂对桑葚粗多糖的静态吸附-解吸试验结果。由表2可见,不同型号大孔树脂对桑葚粗多糖的静态吸附-解吸试验结果差异较大。与其他类型树脂相比,非极性类树脂对桑葚粗多糖中色素与蛋白的去除效果较好,且回收率较高。这归因于色素和多数蛋白质的极性低,与该类型树脂具有较好的吸附作用,而H103树脂的比表面积≥900 m2/g,提供的吸附活性位点较多[16]。因此确定采用该树脂进行后续桑葚多糖纯化工艺研究。

表2 不同型号大孔树脂对桑葚粗多糖的纯化效果Table 2 Purification effect of different models of macroporousresin on mulberry crudepolysaccharide
2.2 不同上样浓度对纯化效果的影响
由图1可知,H103树脂对桑葚多糖的回收率初期较高,可维持在80%左右,但当上样浓度超过15 mg/mL时回收率开始下降,这源于上样浓度过高,使得树脂过饱和吸附,易发生多糖化合物的泄漏。另外,其对蛋白质与色素杂质的吸附量也随着上样浓度的增大,而缓慢减少至达到饱和吸附平衡。因此选择10、15、20 mg/mL上样浓度作为后续响应面试验的考察水平。

图1 不同上样浓度对脱色率、蛋白质脱除率及多糖回收率的影响Fig.1 Effect of different sample concentrations on decolorization,protein removal and polysaccharide recovery rates
2.3 不同上样液体积对纯化效果的影响
由图2可知,随着上样液体积的增大,脱色率与蛋白质脱除率均逐渐下降,这与张迪等[17]利用大孔树脂吸附纯化双孢菇多糖研究结果一致。多糖回收率则在上样液体积为60 mL时快速下降,表明上样量达到一定体积时,H103树脂对多糖化合物的吸附达到饱和,继续增大上样量,不利于提高树脂的吸附效率。因此最佳上样液体积应为60 mL。
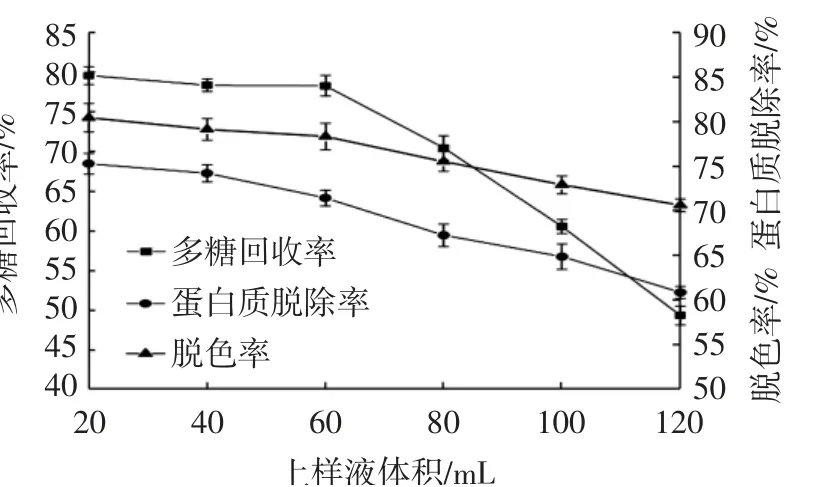
图2 不同上样液体积对脱色率、蛋白质脱除率及多糖回收率的影响Fig.2 Effect of different sample volumeson decolorization,protein removal and polysacchariderecovery rates
2.4 不同洗脱流速对纯化效果的影响
由图3可知,随着洗脱流速的增大,脱色率与蛋白质脱除率均不断减小,而多糖回收率呈先增大后减小的趋势。由于洗脱流速过慢,使得洗脱时间过长,而流速过快,使得多糖洗脱不充分,同时导致吸附在树脂内的杂质易被洗脱。综合考虑,选择0.5、1.0、2.0mL/min洗脱流速作为后续响应面试验因素考察水平。

图3 不同洗脱流速对脱色率、蛋白质脱除率及多糖回收率的影响Fig.3 Effect of different elution velocitieson decolorization,protein removal and polysacchariderecovery rates
2.5 不同洗脱液体积对纯化效果的影响
由图4可见,随着洗脱液体积的增大,多糖回收率逐渐升高至平衡,当洗脱液体积为130 mL时,回收率基本稳定,表明吸附在树脂内的桑葚多糖基本流出柱床,而脱色率与蛋白质脱除率均缓慢下降,表明有部分蛋白质或色素被洗脱。因此选择洗脱液体积120、130、140 mL作为后续响应面试验因素考察水平。

图4 不同洗脱液体积对脱色率、蛋白质脱除率及多糖回收率的影响Fig.4 Effect of different eluent volumes on decolorization,protein removal and polysacchariderecovery rates
2.6 响应面试验结果与方差分析
根据单因素试验结果,采用Box-Behnken中心组合设计原理,以上样液浓度(A)、洗脱流速(B)和洗脱液体积(C)为自变量,以桑葚多糖纯化效果的综合评价指数为响应值,进行三因素三水平响应面优化试验,试验设计及结果见表3。
采用多元回归拟合表3中的结果,得到以综合评价指数为目标函数的二次多项回归模型:Y=74.34-0.66A+0.14B+0.015C-0.25AB-0.38AC-0.47BC-3.67A2-2.57B2-1.30C2,对其进行显著性检验与方差分析,结果见表4。

表3 响应面试验设计方案及结果Table 3 Design and results of response surface experiments
由表4可知,通过响应面试验结果拟合的回归模型为极显著(P<0.01),失拟项不显著(P>0.05)。模型R2=0.989 4,接近于1,表明模型可靠程度高。另外模型变异系数CV=0.79%<1%,可知模型外因素对结果的影响较小,该模型可用于实际结果的预测。在所有一次项中,上样液浓度的影响显著(P<0.05),所有二次项影响均为极显著(P<0.01)。由F值可知,各因素对桑葚多糖纯化效果的影响大小顺序为:上样液浓度(A)>洗脱流速(B)>洗脱液体积(C)。
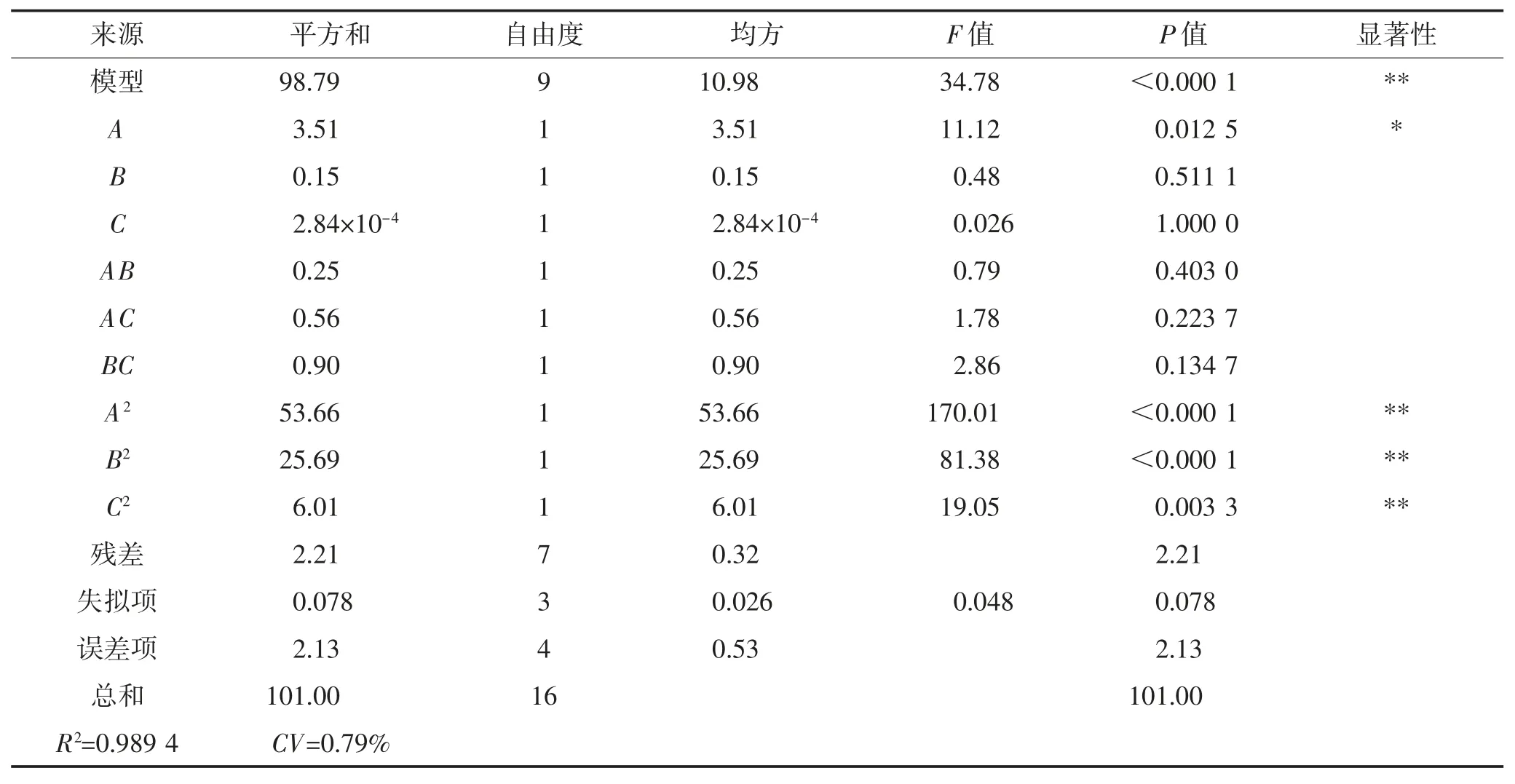
表4 响应面方差分析Table4 Variance analysisof response surface experiment
2.7 响应面分析与最佳纯化工艺验证
由图5可见,所有交互曲面,随着各因素水平的增加,综合评价指数均升高缓慢,各因素之间交互作用不显著。对上述回归方程采用一阶偏导,预测最佳工艺条件为:上样浓度14.5 mg/mL,洗脱流速1.3 mL/min,洗脱液体积130 mL,预测综合评价指数为76.2。

图5 各因素交互作用对桑葚多糖纯化综合评价指数影响的响应面图Fig.5 Responsesurfacemap of interaction of different factorson purificationcomprehensive evaluation index of mulberry polysaccharide
为了验证模型预测的最佳工艺,采用上样液浓度14.5 mg/mL,上样液体积60 mL,洗脱流速1.3 mL/min和洗脱液体积130 mL对桑葚多糖粗提物进行纯化,测得样品中脱色率为78.2%±1.4%,蛋白质脱除率为67.3%±2.2%,多糖回收率为81.5%±1.2%,综合评价指数76.4±1.5,试验值与预测值差异较小,表明拟合得到的二次多项回归模型可较好地预测考察因素与响应值间的关系。
2.8 桑葚多糖纯化前后抗运动疲劳活性比较结果
2.8.1 小鼠力竭游泳时间比较
由表5可知,与对照组相比,提取组小鼠的力竭游泳时间延长了2.6 min,而纯化组小鼠的力竭游泳时间延长了6.1 min,均具有极显著性差异(P<0.01),同时纯化组小鼠的力竭游泳时间较对照组明显延长,具有极显著性差异(P<0.01)。动物的力竭游泳时间反映其运动耐力,在高强度运动过程中,肌肉的快速收缩诱导活性氧与NO的水平升高,相关肌蛋白S-亚硝基化,促使体内自由基数量增多,导致各组织、器官供氧不足,机体生理环境发生改变,不能维持预定的运动强度,从而产生疲劳感[18]。纯化产物中桑葚多糖含量增大,致使抗氧化能力增强,有助于进一步提高动物的运动耐力,因此抗运动疲劳作用较好,这与张涛涛[14]考察不同杜仲多糖产物对小鼠的抗运动疲劳影响结果相同。

表5 桑葚多糖纯化前后对小鼠力竭游泳时间的影响Table5 Effect of mulberry polysaccharidesbeforeand after purification on exhaustive swimming time in mice
2.8.2 小鼠血液生化指标比较
由于运动过量导致肌肉收缩加剧,使得供氧不足生成乳酸,四肢开始出现“酸痛”,乳酸脱氢酶可加快体内乳酸转化为丙酮酸,缓解运动后的机体不适感[19],桑葚多糖对运动后小鼠相关血液生化指标的影响见表6。由表6可知,与对照组相比,提取组小鼠的BLA含量降低了1.2 mmol/L,差异具显著性(P<0.05),LDH活力提高了46.3 U/L,差异具极显著性(P<0.01),而纯化组小鼠的BLA含量降低了2.3 mmol/L,LDH活力提高了124.1 U/L,差异均具极显著性(P<0.01)。灌胃不同纯度多糖的两组动物体内BLA含量和LDH活力的差异分别为显著性和极显著性,表明纯化后的桑葚多糖有助于进一步提高体内乳酸脱氢酶活力,加快运动时生成的乳酸代谢。

表6 桑葚多糖纯化前后对小鼠的BLA含量与LDH活力的影响Table6 Effect of mulberry polysaccharidesbefore and after purification on BLA content and LDH activity in mice
3 结论
色素和蛋白质作为桑葚粗多糖的主要杂质,会影响其结构分析与活性,而采用双氧水法、Sevage法在去除色素与蛋白质的过程中,多糖保留率较低。因此,本研究采用大孔树脂对桑葚粗多糖进行纯化,并考察桑葚多糖纯化前后对小鼠抗运动疲劳效果的影响。通过对7种大孔树脂的静态吸附与解吸性能考察,确定采用H103树脂纯化桑葚多糖粗提物,在单因素试验结果基础上,根据响应面试验确定最佳纯化工艺为:上样液浓度为14.5 mg/mL,上样液体积为60 mL,上样流速为1.0 mL/min,洗脱流速为1.3 mL/min和洗脱液体积为130 mL。经该工艺纯化后的桑葚多糖样品脱色率为78.2%±1.4%,蛋白质脱除率为67.3%±2.2%,多糖回收率为81.5%±1.2%,综合评价指数76.4±1.5。与粗提物相比,纯化后的桑葚多糖可进一步延长小鼠的力竭游泳时间,增强其乳酸脱氢酶的活力,并加快小鼠运动时体内生成的乳酸代谢,具有较好的抗运动疲劳活性,有利于其在营养领域的深度开发。
