环状RNA:胃癌诊治的新星*
2022-04-24马亦波马东南郭俊明
马亦波 马东南 郭俊明**
(1)宁波大学医学院附属医院消化科,宁波 315020;2)宁波大学医学院生物化学与分子生物学研究所,浙江省病理生理学技术研究重点实验室,宁波 315211)
胃癌是世界上最常见的消化道恶性肿瘤之一[1]。2020 年胃癌新发病例108.9 万例,死亡76.9万例,分别占全部癌症病例和死亡人数的5.6%和7.7%;胃癌发病率居世界各类肿瘤第5位,死亡率居各类肿瘤第4 位[2]。东亚是胃癌的高发地区,2020 年胃癌新发病例占全球新发病例总数的60.3%[2]。早期胃癌(early gastric cancer,EGC)通常没有特定的症状,并且经常与其他消化系统疾病的症状相混淆。当症状明显时,胃癌已进入后期阶段。因此,寻找EGC标志物显得很有必要。
1979 年,Hsu 等[3]使用电子显微镜观察到真核生物细胞质中的环状RNA (circular RNA,circRNA)。circRNA最初被认为是mRNA剪接错误的副产品[4]。近年来,研究人员已经证明了circRNA不是简单的错误剪接产生的,而是在人类细胞中广泛存在的具有生物学功能的RNA分子[5]。此外,许多研究表明,circRNA在肿瘤的发生和发展中起着至关重要的作用[6-8]。与传统标志物不同,circRNA 作为一种潜在的诊断、预后或预测标志物,因其高度特异性而备受关注。近些年来,circRNA 的合成机制与功能已逐渐被阐明,关于circRNA 与胃癌关系的研究也已展开,许多circRNA被发现在胃癌患者组织和正常组织间存在较大差异,一些胃癌相关circRNA在胃癌发生、发展过程中发挥重要的调控作用[7-8]。因此,circRNA可能成为胃癌的潜在诊断标志物和治疗新靶点。
1 circRNA生物合成的机制
目前,大多数circRNA 是通过对前体mRNA(pre-mRNA)进行反向剪接而产生的,它们没有3'端和5'端[9]。根据其组成,circRNA可分为外显子-内 含 子 circRNA (exon-intron circular RNA,EIciRNA)[10]、外 显 子circRNA (exonic circular RNA,ecircRNA)[9,11]和内含子circRNA(circular intronic RNA,ciRNA)[12]。ecircRNA 和EIciRNA的形成方式包括(图1):a.内含子配对驱动的环化[11]:pre-mRNA上游和下游的内含子通过互补的碱基序列形成包含外显子的ecircRNA 或包含外显子与内含子的EIciRNA;b.套索驱动的环化或外显子跳跃[13]:pre-mRNA被剪接时,下游外显子的3'剪接受体和上游5'剪接供体之间形成反向共价连接的套索结构,其中包含外显子和内含子,通过进一步移除内含子后外显子通过磷酸二酯键形成ecircRNA; c. RNA 结 合 蛋 白(RNA binding protein,RBP)依赖的环化[14]:pre-mRNA 外显子两端的上下游内含子通过可供RBP 识别的序列来与RBP 特异性结合形成二聚体,环化形成EIciRNA;若移除内含子后,则最终可形成ecircRNA。d. ciRNA 不同于ecircRNA,它包含一个独特的2'-5'链接,它的形成与内含子两端7 nt的GU 丰富元件和11 nt 的C 丰富元件相关。内含子GU 丰富元件和C 丰富元件的两端环化形成一个不包含外显子的、拥有不同长度尾巴的套索RNA 结构,去除尾部分支后生成ciRNA。另外,Schmidt等[15]最近在后生动物中发现了一种古老、保守的RNA环化机制,涉及tRNA内含子的剪接。这种剪接机制完全独立于前述mRNA的剪接机制。
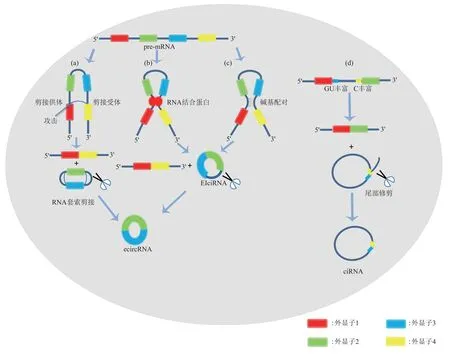
Fig.1 The models of circRNAs’circularization图1 circRNA的环化模型
2 circRNA的生物学功能
随着研究的深入,circRNA的生物学功能逐渐被揭示,以下分5个方面分别阐述(图2)。
2.1 circRNA充当miRNA海绵
大部分的circRNA主要存在于细胞质中。已有大量的研究发现,定位于细胞质中的circRNA可以与mRNA竞争微RNA(microRNA,miRNA)的靶向结合位点,充当miRNA 海绵,从而调控mRNA的表达[9,16]。在可充当miRNA海绵的circRNA中,最典型的是ciRS-7 (circular RNA sponge for miR-7)[16]。ciRS-7 含有超过70 个保守的miR-7 结合位点;并且在细胞中高丰度表达,在每个细胞中大概能吸附两万多个miR-7,因此可以与mRNA竞争miR-7的结合位点,从而影响其表达水平[9]。另一个作为miRNA 海绵的circRNA 是雄性性别决定基因(sex-determining region Y,Sry)的睾丸特异性转录物,它含有miR-138 的16 个保守结合位点[16]。胃癌相关circRNA 和miRNA 之间的相互作用是近年来的研究热点,不过由于大多数circRNA在体内表达较低,所以它们作为miRNA 分子海绵的影响有限。
2.2 circRNA与RBP结合
许多circRNA可以与RBP形成复合物,从而调节特定的蛋白质发挥功能[17-20]。研究表明,circFoxo3 能够与多种RBP(如缺氧诱导因子和局部黏着斑激酶等)结合影响细胞应激和衰老进程[17]。circFoxo3 可以通过与周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)和P21 相互作用来抑制细胞周期,将细胞阻滞在G1/S 期[18]。另外, 研究人员发现, 胃癌相关circRNA circAGO2 表达上调,与患者预后不良有关。circAGO2 与人类抗原R(human antigen R,Hur)蛋白相互作用,促进Hur mRNA 3'端非翻译区的激活和富集,从而减少与AGO2的结合,抑制AGO2/miRNA介导的与胃癌进展相关基因的沉默[19]。相关circRNA表达的增强会促进胃癌的发生发展。例如,Wang 等[20]实验证明,在胃癌细胞核中circ_SMAD4 可以与T 细胞因子4(T cell factor 4,TCF4)相互作用,然后将TCF4 募集到β1 连环素(catenin beta 1,CTNNB1)基因的启动子上,增强CTNNB1 的转录,而β1 连环素具有调节细胞生长和细胞黏附的作用,该基因突变可能是导致胃癌的重要原因之一。
2.3 circRNA参与调控转录
定位于细胞核的一些circRNA 可以调控转录。例如,circ-EIF3J 和circ-PAIP2 与U1 小核核糖核蛋白(small nuclear ribonucleoprotein,snRNP) 结合,进一步与RNA 聚合酶Ⅱ相互作用,促进亲本基 因 的 转 录[10]。另 外,Zhang 等[12]发 现 有 些ciRNA 可反馈调控其亲本基因的表达,如:ci-ankrd52 堆积到其转录位点,激活RNA 聚合酶II发挥正调控转录作用。这表明ciRNA 对其亲本编码基因具有顺式调控作用。最近还有研究发现,胃癌相关circRNA也具有调控转录的作用,如:Ding等[21]发现沉默circ-DONSON 抑制胃癌细胞的增殖、迁移和侵袭。具体机制是circ-DONSON 通过与核小体重塑因子(nucleosome-remodeling factor,NURF)复合物相互作用,将复合物募集到SRY框转录因子4(SRY-box transcription factor 4,SOX4)基因启动子上,并启动其转录,而SOX 4能促进胃癌的增殖和转移。
2.4 circRNA影响同源线性mRNA的形成
Ashwal-Fluss等[22]发现在pre-mRNA的剪接过程中,有些circRNA 通常是通过剪接竞争即circRNA的反向剪接机制和mRNA的常规线性剪接的互相竞争,以牺牲典型的mRNA为代价产生的,从而降低同源线性mRNA的表达。这表明circRNA的生物发生可能是mRNA 产生的重要调节因素之一。
2.5 circRNA发挥翻译作用
Yang等[23]研究发现,N-6-腺苷甲基修饰(指在RNA 分子的A 碱基的第6 位N 上加上一个甲基基团,m6A)作为RNA 最丰富的碱基修饰,可启动人体细胞中一些circRNA翻译成蛋白质。在深入研究后发现,这种m6A驱动的翻译需要真核翻译启起因子4G2(eukaryotic translation initiation factor 4 gamma 2,eIF4G2)和m6A 读码器——含YTH 结构 域 蛋 白3 (YTH domain-containing protein 3,YTHDF3), 并 被 甲 基 转 移 酶 样 3 和 14(methyltransferase-like 3 and 14,METTL3/14) 增强;而被去甲基化酶——肥胖相关蛋白(fat mass and obesity-associated protein,FTO)抑制。另外,有研究发现,参与肌肉发生过程中的circ-ZNF609也可直接翻译成蛋白质[24]。circ-ZNF609通过内部核糖体插入元件、以帽子非依赖方式翻译成蛋白质。这些最近的发现不仅拓展了人们对circRNA功能的认识,而且为circRNA在疾病诊治中的应用提供了新思路。因此,根据是否具有翻译功能,circRNA 可分为编码 circRNA 和非编码circRNA[25]。
3 circRNA在胃癌诊治中的价值
目前胃癌研究的首要目标是建立早期诊断和有效治疗的新方法以提高胃癌患者的生存率。circRNA在胃癌发生发展中发挥重要作用,已被证明其是胃癌的潜在诊断标志物、治疗靶点,以及与胃癌耐药有关。
3.1 circRNA作为胃癌诊断的生物标志物
circRNA具有稳定性和半衰期长等特点,可作为胃癌诊断的分子标志物[26]。现已发现许多circRNA在胃癌组织、患者血浆和外泌体中的水平异 常 变 化(表1)。 Ma 等[27]研 究 发 现,circPTPN22 在胃癌组织、胃癌细胞和胃癌患者血浆中表达上调,并与肿瘤转移呈正相关,可作为胃癌诊断的生物标志物。Xu 等[28]研究证明,血浆circ_0004771在胃癌患者和复发患者中均有不同程度的上调,提示血浆circ_0004771可作为胃癌诊断的一种新的生物标志物。最近还有研究进一步发现了包括hsa_circ_0007766[29]、hsa_circ_0141633[30]、hsa_circ_102958[31]、 hsa_circ_0067582[32]和hsa_circ_0065149[33]在内的一些circRNA在胃癌组织和患者血液中都有不同程度的变化,且受试者操作特性曲线(receiver operating curve,ROC)下面积(area under ROC, AUC) 值 较 大, 其 中hsa_circ_0141633 的AUC 值达到0.835,且灵敏度(0.845)和特异度(0.936)较高,明显高于临床上常用的癌胚抗原(carcinoembryonic antigen,CEA)和 糖 类 抗 原19-9 (carbohydrate antigen 19-9,CA19-9)[34];hsa_circ_0007766 和hsa_circ_102958的AUC 值分别为0.704 和0.74,均高于CEA 和CA19-9 的AUC 值[29,31];另外hsa_circ_0067582 的AUC 值为0.694,且其灵敏度(0.667)和特异度(0.613)高于CA19-9 的灵敏度和特异度[32]。这些实验数据提示,circRNA可能是潜在的胃癌诊断标志物。另外,本课题组首次研究发现,hsa_circ_0065149 的表达在胃癌中显著下调,与肿瘤直径、神经侵袭和胃癌患者总生存期显著相关[33]。更重要的是,早期胃癌患者血浆外泌体中hsa_circ_0065149比传统的胃癌标志物具有更高的敏感性和特异性,提示可作为早期胃癌的筛查标志物。Zhang 等[35]的 研 究 结 果 显 示,胃 癌 组 织 中hsa_circ_0026344 水平与肿瘤大小、淋巴结转移和肿瘤-淋巴结-转移(tumor node metastasis,TNM)分期等临床病理因素显著相关;此外,hsa_circ_0026344低表达患者的总体生存率明显低于高表达患者,是胃癌预后的一个潜在的生物标志物。

Table 1 circRNAs may be used in the diagnosis of gastric cancer表1 有希望用于诊断胃癌的circRNA
3.2 circRNA作为胃癌治疗新靶点
circRNA与胃癌细胞增殖、分化、侵袭和迁移相关,有希望成为胃癌治疗的潜在新靶点(表2)。例如:胃癌组织中过表达的hsa_circ_0000467 通过miR-326-3p 海绵作用在胃癌的发生、发展中起调控 作 用[36]。Wang 等[37]研 究 发 现,hsa_circ_0001772(circRBM33)通过miR-149/IL-6 轴上调白介素-6(interleukin-6,IL-6)的水平,进而调控胃癌细胞的增殖。转录因子特异性蛋白1(specificity protein 1,Sp1)参与调节肿瘤进展相关信号通路相关基因的表达,在胃癌中过表达,其表达与胃癌的转移潜能和预后不良有关。Zhang等[38]发现,miR-527 可与Sp1 mRNA 相互作用,抑制Sp1 表达;而作为miR-527 海绵的hsa_circ_0005529 在胃癌组织中上调,通过miR-527/Sp1 信号轴上调Sp1的水平,促进胃癌的生长和转移。Li等[39]研究发现,泛素特异性蛋白酶3(ubiquitinspecific protease 3,USP3)过表达促进了胃癌细胞的迁移和增殖,miR-224-5p与USP3 mRNA相互作用可降低USP3 的表达,而胃癌细胞中hsa_circ_0017639 表达上调,通过miR-224-5p/USP3 轴调节USP3 表达水平,参与胃癌的进展。另外,有一些研究发现,hsa_circ_0001947、hsa_circ_0004104、circCYFIP2、 circPIP5K1A、 circ-RanGAP1、 circ-MAT2B 和hsa_circ_0001829 均 可 通 过circRNAmiRNA-mRNA 轴来调控胃癌的发生、发展[40-46]。这说明,如果有效抑制这些致癌性circRNA的高表达,可能是未来胃癌分子治疗一种新的方法。
另外,一些胃癌相关的抑癌性circRNA也被发现。例如,肿瘤转移抑制因子1 (metastasis suppressor 1,MTSS1)在许多癌症中起抑癌作用,Li等[47]实验发现沉默MTSS1基因促进胃癌细胞增殖和迁移,而hsa_circ_002059通过抑制miR-182和诱导MTSS1 表达抑制胃癌细胞增殖和迁移。Hu 等[48]发现miR-3200-5p 可以直接与磷脂酰乙醇胺结合蛋白1 (phosphatidylethanolamine binding protein 1,PEBP1)mRNA 结合,而PEBP1 已被认为是参与胃癌增殖和侵袭的主要调控因子之一;circMTO1 通过miR-3200-5p/PEBP1 轴调控PEBP1水平发挥抗癌作用。P21活化激酶3(P21-activated kinase 3,PAK3)作为一种丝氨酸/苏氨酸激酶,是小Rho GTP 酶 的 主 要 下 游 效 应 因 子[49]。Wang等[50]发现,PAK3 的表达增加会导致胃癌细胞增殖和转移能力下降,并证实了hsa_circ_0000190 通过miR-1252海绵作用,上调PAK3水平从而抑制胃癌的进展。
有趣的是,国际上关于circRNA调控胃癌的发生发展也有广泛的研究。例如,最近美国的一项研究利用酶连接步骤合成了第一个抗核酸酶酶解的含有多个miR-21 结合位点的人工circRNA 海绵[51]。miR-21 有多个下游靶分子,其中死亡域相关蛋白(death domain associated protein,DAXX)是关键的肿瘤抑制蛋白,可以抑制胃癌细胞增殖;这些人工circRNA 海绵通过抑制miR-21 对其下游靶蛋白的活性从而抑制胃癌细胞增殖。另外,有研究发现,沉默circNF1 可抑制胃癌细胞增殖和迁移[52]。circNF1与miR-16结合,从而调节其下游的目标蛋白——微管相关蛋白7 (microtubule-associated protein 7,MAP7)和AKT 丝氨酸/苏氨酸激酶3(AKT serine/threonine kinase 3,AKT3)的翻译水平[52]。MAP7 是一种微管相关蛋白,主要在上皮细胞中表达,是细胞分裂、增殖和分化所必需的;磷酸化AKT3 信号途径参与细胞增殖和分化等过程,所以,circNF1可以通过miR-16海绵作用调控胃癌细胞的增殖和分化[52]。上述这些研究强调了circRNA作为胃癌治疗靶点的潜力。
3.3 circRNA影响胃癌细胞的耐药性
顺铂(cisplatin)是临床应用最为广泛的一种抗癌药物,但近年来顺铂耐药性的产生降低了顺铂的实际疗效,甚至导致胃癌化疗的失败[53-54]。因此研究顺铂耐药机制是目前胃癌研究领域的重点之一。现已发现,有多种circRNA调控胃癌细胞对顺铂的耐药性(表3)。Yes 相关蛋白1 (Yesassociated protein,YAP1)的高表达与胃癌的不良预后和胃癌顺铂耐药有关,而Yao 等[55]发现,降低YAP1表达可抑制胃癌细胞对顺铂的抗性,顺铂耐药的胃癌患者血清和胃癌细胞的外泌体circ-PVT1 通过miR-30a-5p/YAP1 轴调节胃癌细胞的自噬、侵袭和凋亡,促进胃癌细胞对顺铂耐药。Peng等[56]通过基因敲除和过表达实验发现,胃癌细胞对顺铂耐药与circCUL2调控miR-142-3p/ROCK2轴有关。Rho 相关激酶2(Rho-associated kinase 2,ROCK2)与胃癌细胞增殖和迁移有关,而ROCK2过表达抑制胃癌细胞自噬可增强胃癌细胞对顺铂的敏感性。Zhang 等[57]通过体内和体外实验发现,hsa_circ_0001313 在胃癌细胞对顺铂耐药中的机制是调控miR-618/BCL2 影响细胞凋亡。另有研究发现,circ_0110805 影响胃癌细胞对顺铂敏感与其通过miR-299-3p 调控内皮蛋白-二硫键异构酶(endothelial protein-disulfide isomerase,ENDOPDI)表达有关[58]。ENDOPDI在胃癌组织和细胞中高表达,具有抑制胃癌细胞凋亡并促进细胞增殖、迁移和侵袭等作用,此外还可抑制胃癌细胞对顺铂的敏感性。Deng 等[59]最新研究发现,胃癌组织中circVAPA 的表达较正常组织明显上调,circVAPA缺失抑制了胃癌细胞的增殖、迁移和侵袭,增加了细胞凋亡。在顺铂耐药SGC-7901/DDP 细胞株中circVAPA、STAT3 和STAT3 下游基因的表达上调。STAT3 基因敲除可阻断circVAPA 过表达诱导的顺铂处理SGC-7901/DDP 细胞的增殖,而circVAPA基因敲除可减弱胃癌细胞对顺铂的耐药性。从机制上来说,circVAPA能够通过miR-125b-5p/STAT3信号通路促进胃癌的化疗耐药和恶性进展。上述这些研究结果为今后胃癌顺铂耐药的研究提供了新方向。

Table 3 circRNAs associated with drug resistance in gastric cancer表3 与胃癌耐药相关的circRNA
4 总结和展望
如上所述,circRNA具有稳定性好、半衰期长等特点,作为miRNA 海绵、亲本基因转录调控作用以及与RBP 结合等参与胃癌的发生、发展和转移等过程,已展现出作为胃癌标志物和治疗靶点的潜力。目前,临床中使用的胃癌标志物的诊断效率不够理想。如果将circRNA作为胃癌的标志物用于临床,可能有助于解决现有标志物的灵敏度低、不稳定和低特异性等问题。但是,circRNA在胃癌诊断上也具有一些缺点。首先,检测circRNA比现有检测方法更昂贵,这限制了circRNA作为生物标志物的广泛使用;其次,使用circRNA进行胃癌诊断的可靠性仍然需要被大样本实验验证。同时,circRNA作为胃癌治疗靶点也存在一些问题。在探索circRNA与胃癌的关系中,大部分研究关注的还是相关circRNA的海绵作用上。然而,并不是所有circRNA 都具有海绵作用,只有少数circRNA 对某些miRNA 具有丰富的结合位点,而且其调控胃癌的可靠性还亟需更多的实验数据来验证。另外,目前发现的关于胃癌相关circRNA的转录调控作用和翻译作用还较少。
虽然目前对circRNA功能有了初步的了解,但仍需要深入地研究其分子机制,特别是有关circRNA应用于胃癌治疗的临床前研究的结果非常少见。未来还需要明确circRNA与胃癌发生发展的联系,进一步阐明circRNA 与miRNA 或RBP 的调控网络,深入挖掘circRNA的作用机制。显然,要做到真正地把circRNA应用于临床,还有很长的路要走。但是,相信在不久的将来,随着研究的深入,无论是胃癌的早期诊断、治疗还是预后评估,circRNA将会得到广泛的应用。