阿尔茨海默病发生发展中关键E3泛素连接酶的筛选*
2022-04-24路亚岚石桂英王克维
路亚岚 石桂英 王克维 白 琳
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,国家卫生健康委员会人类疾病比较医学重点实验室,北京市人类重大疾病实验动物模型工程技术研究中心,北京 100021)
泛素-蛋白酶体系统(ubiquitin-proteasome system,UPS)是存在于真核细胞内的一种高度选择性的蛋白质降解途径,精确调控超过80%的错误折叠蛋白的降解[1]。泛素化过程需要3种泛素酶的协同作用,经过E1泛素活化酶和E2泛素结合酶激活泛素,形成E2-泛素复合物,最后E3泛素连接酶识别特定靶蛋白,并催化泛素分子转移到靶蛋白上[2]。E3 泛素连接酶在特异性靶标识别以及泛素化系统活性调控中起着关键的作用[3]。
阿尔茨海默病(Alzheimer’s disease,AD)是一种起病缓慢隐匿、呈进行性进展的神经退行性疾病,后期患者会陷入僵木并丧失独立生活能力[4-5]。中国在快速进入老龄化社会,AD的发病呈现爆发式增长,给患者、家庭及社会带来沉重的负担和严峻的挑战[6]。目前,AD 的发病机制尚不十分明确,极大限制了有效治疗技术的开发。因此,进一步探索AD 的分子病理机制及其基础上的防治措施,是亟需解决的重要科学问题。
AD 的发生与淀粉样蛋白的合成和清除障碍以及Tau蛋白的过度磷酸化密切相关,它们的异常沉积形成细胞外斑块和胞内的神经纤维缠结,干扰神经 元 功 能[4]。早 在1987 年,Mori 等[7]和Perry等[8]发现在老年斑和神经纤维缠结上有泛素的存在。之后研究报道发现,UPS 功能下降可以抑制Aβ 蛋白降解、增加前体蛋白水解、提高β 位淀粉样前体蛋白裂解酶1(BACE1)的表达量和增强γ分泌酶的活性,进而导致淀粉样蛋白沉降[9-10]。UPS受损会导致Tau聚集,引起过度磷酸化,而过度磷酸化的Tau蛋白又可以抑制UPS功能[10-11]。到目前为止,AD的可用药物数量十分有限,新近研究的直接靶向Aβ 的药物临床实验相继宣告失败[12]。因此,寻找其他有效靶点是AD防治的瓶颈问题[12]。UPS 的功能障碍与β 淀粉样蛋白聚集、Tau 蛋白过度磷酸化、突触功能抑制和载脂蛋白E功能异常密切关。靶向针对泛素蛋白酶体途径有望防止神经元异常聚集,进而防止AD 的发生发展[13]。
本文通过生物信息学方法结合高通量基因芯片和统计学对生物数据进行系统处理和分析,进而揭示其中关键的生物学过程和信号通路,通过PPI蛋白互作筛选关键节点蛋白,通过公用数据库查询其定位和表达信息,进而通过AD小鼠模型验证,为AD 的深入机理的探索提供重要线索,以期为AD的预防和治疗提供方案依据。
1 材料与方法
1.1 实验材料
1.1.1 AD患者数据集
基因表达数据集从NCBI 的GEO 数据库(http://www.nci.nlm.nih.gov/geo)中检索获取。纳入数据集的标准如下:a.样本来自确诊的AD患者和非痴呆对照组的脑组织;b.数据集中病例和对照组的可用样本数≥50个。最终选择分析表达数据集GSE15222(共363 例样本,其中对照186 例,AD 176 例)和GSE36980(共80 例样本,其中对照47例,AD 33例)。
1.1.2 实验动物
本研究使用的AD 模型小鼠(APP/PS1 和5×FAD及其对照)为SPF级别,饲养于中国医学科学院医学实验动物研究所的二层屏障环境动物房。饲养期间小鼠自由饮水取食,环境温度24~26℃,光照12 h,黑暗12 h 常规饲养。选取8 月龄APP/PS1和6月龄5×FAD及其对照小鼠各3对,取大脑组织进行后续检测。本实验中涉及的所有动物操作均得到中国医学科学院医学实验动物研究所动物使用与管理委员会的批准(IACUC 编号:WKW19001),并遵守3R原则人道主义地使用实验动物。
1.1.3 实验试剂
TRIzol试剂购买自美国ThermoFisher Scientific公 司;PrimeScript RT Master Mix (Perfect Real Time)(RR036A)和TB Green Premix Ex Taq TM II (TliRNaseH Plus)(RR82WR) 购 买 自 日 本TaKaRa公司。
1.1.4 实验仪器
-80℃超低温冰箱购自中国海尔公司;Nanodrop 2000 购买自美国ThermoFisher Scientific公司; StepOnePlusTM购买自美国 Applied Biosystems公司。
1.2 实验方法
1.2.1 DEGs的筛选和分析
采用GEO2R(http://www.nci.nlm.nih.gov/geo/GEO2R/)在线工具筛选差异表达基因(DEGs),筛选条件为padj<0.05,|log2FC|>1.0(FC即变化倍数fold change)。两组数据集(GSE15222 和GSE36980)共同的DEGs行后续分析。
1.2.2 功能富集分析和蛋白质相互作用
获得差异表达基因后,通过FunRich软件进行GO(gene ontology)分析,其用于描述及注释基因功能。GO 将基因功能分为细胞组分(cellular component)、生物学过程(biological process)、分子功能(molocular function) 和蛋白质结构域(protein domain)4部分,用于发现在AD发生发展中的关键生物学过程。并对以上DEGs 通过STRING 数据库(http://STRING-db.org/)构建PPI网络(protein-protein interaction network),利用CytoHuba 评估蛋白质网络及各节点的拓扑特性并筛选出关键节点蛋白分子。
1.2.3 关键基因的大数据库总结整理分析
通过The Human Protein Atlas 数据库(http://www.proteinatlas.org/)总结整理E3 泛素连接酶蛋白在脑组织中的细胞定位;对特异性表达于神经元中的E3 连接酶,通过Pubmed 数据库(https://pubmed.ncbi.nlm.nih.gov/)查找目前在AD 领域中的研究报道,通过Alzdata 数据库(http://www.alzdata.org/)查询E3连接酶在AD患者与对照在内嗅皮层、海马、颞叶皮层和额皮质中的表达量及其统计学差异。
1.2.4 总RNA提取和实时定量PCR(qPCR)检测
按照TRIzol 试剂说明书的操作流程提取3 对APP/PS1 和5×FAD 及对照小鼠整个大脑组织的总RNA,溶解于DEPC 水中。经过Nanodrop 2000 测量样品总RNA 浓度后,将同批次样品调节至相同浓度。按照PrimeScript RT Master Mix (Perfect Real Time)cDNA 逆转录试剂盒说明书流程将总RNA 反转录成cDNA,其反应体系包含2 μl 5×PrimeScript RT Master Mix,500 ng Total RNA,在37℃反应15 min,85℃5 s 失活反转录酶后-20℃保存备用。使用TB Green Premix Ex Taq TM II(TliRNaseH Plus) 试 剂 盒 进 行E3 泛 素 连 接 酶(MKRN2、NEDD4L、LNX1、RNF41、TRIM36、RNF8、DTX4)和内参基因β-actin 的qPCR 检测,每个样本设置3 个复孔。其反应体系包含20 ng cDNA,正反向引物各400 nmol/L,0.4 μl ROX(50×) 和10 μl SYBR Premix Ex Taq (2×),共20 μl。反应程序为95℃30 s,随后95℃5 s,60℃30 s,进行40次循环,使用Step One Plus实时PCR系统完成实验后,采用2△△Ct法计算各个基因的相对表达量,检测用引物见表1。

Table 1 The qPCR primers of mouse E3 ligases
1.3 统计学方法
实验数据用平均数±标准差()表示,通过GraphPad Prism 8.0 软件统计作图,两组间数据比较采用t-test 检验,P<0.05 认为差异存在统计学意义,标识如下:ns,无显著性差异。
2 结 果
2.1 AD患者中差异表达基因筛选
DEGs 是在AD 的发生发展过程中发生统计学改变的基因,它们与AD 的进程密切相关。因此,首先将比较AD 组与对照组数据,分析DEGs,结果如下:在GSE15222 数据集中筛选到8 093 个DEGs,在GSE36980 数据集中筛选到3 671 个DEGs,其中共同DEGs 1 935个,分别占两个数据集总DEGs 的23.91%和52.71%(图1)。共同的差异基因代表在两个独立数据分析中这些基因均在AD的进程中有显著改变,将这些基因进行后续分析可以减少系统偏移误差,提供更准确的分析结果。

Fig.1 The DEGs in GSE15222 and GSE36980 databases
2.2 差异表达基因GO功能富集
对1 935 个共同DEGs 进行GO 分析,结果发现:上述共同差异基因的蛋白质产物主要位于细胞浆、线粒体、细胞液、溶酶体和外泌体等细胞组成部分,细胞核与细胞膜定位蛋白并不多;主要的生物学通路涉及能量代谢、神经递质通路和突触生成,其中位于前3 名的分别是糖代谢三羧酸循环、谷氨酰能神经递质和5-羟色胺能神经递质的释放;主要的分子功能涉及泛素化、能量代谢和离子通道等,其中前3 名分别为泛素-蛋白酶体系统、GTP酶活性和ATP 活性;在进一步结构域分析中发现UBCc、WD40、C2、UBQ 等被富集到,其中排名第1 的UBCc 具有统计学差异,该结构域具有高度保守性,在泛素化的生物学过程中具有关键作用。这些结果指向泛素化过程在AD病程的调控中具有重要功能,可能参与调控能量代谢和神经递质合成(图2)。
2.3 差异表达基因编码蛋白的PPI网络分析
为了进一步筛选AD发生发展中的关键调控分子,进行DEGs 基因的PPI 蛋白互作网络分析,结果发现大部分基因之间有紧密关联,少数蛋白质只有2~3 个相互作用蛋白,位于核心网络之外(图3)。排名前50的蛋白质分子如表2所示,它们涉及信号通路转导、蛋白泛素化、能量代谢和离子通道等生物学过程。

Fig.2 GO analysis(cellular component,biological process,molecular function and protein domain)of DEGs

Fig.3 PPI analysis of DEGs
2.4 E3泛素连接酶在脑组织中细胞定位
前期分析结果指向泛素化过程在AD的发生发展中的关键作用,E3 泛素连接酶在底物识别和泛素化过程调控中具有关键作用。因此,通过The Human Protein Atlas 和Pubmed 公用数据库,整理DEGs 中的22 个E3 连接酶在脑组织中的细胞学定位(内皮细胞、胶质细胞和神经元)以及是否有与AD相关的文献报道(表3)。

Table 2 The top 50 proteins in PPI analysis
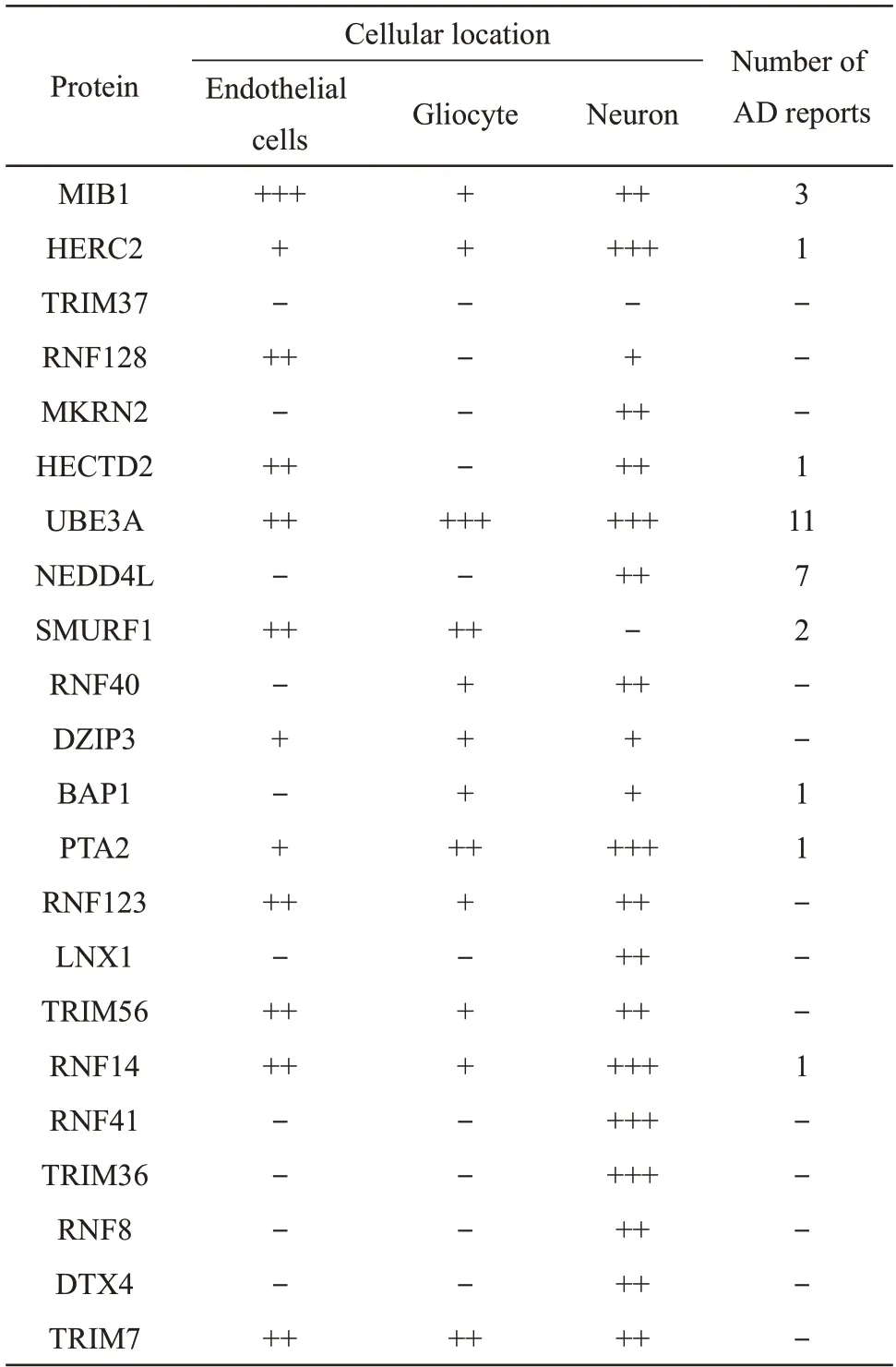
Table 3 The cellular location of E3 ligases in human brain
2.5 神经元特异表达E3泛素连接酶蛋白分子在Alzdata数据库中表达分析
AD患者神经元的水解功能异常,导致淀粉样蛋白和神经纤维缠结异常沉积,进而引起神经元功能障碍。因此,选取神经元特异高表达的E3 泛素连接酶蛋白分子(包括MKRN2、NEDD4L、LNX1、RNF41、TRIM36、RNF8 和DTX4)通过Alzdata数据库查找这些蛋白质分子在AD患者和对照人群不同脑区(包括内嗅皮层、海马、颞叶皮层和额叶皮层)中的表达量和统计学差异。经过整理具体结果如下:绝大部分蛋白质分子在AD患者中表达量下调,大部分具有统计学差异。例外包括:RNF8 和DTX4 在海马,NEDD4L 在额皮质中略微上调,但均无统计学差异;DTX4在内嗅皮层和额叶皮层,以及LNX1 在额皮质中缺失数据(图4)。它们的下调与促进泛素化降解功能的发挥,进而导致AD患者脑组织中异常蛋白堆积的现象一致,提示可能作为AD进展的驱动基因发挥作用。
2.6 神经元特异表达E3泛素连接酶蛋白分子在AD小鼠脑组织中表达验证
为了进一步验证从AD 患者组织中筛选的E3泛素连接酶蛋白分子表达特征,选择具有明显AD病理学和行为学特征的8月龄APP/PS1和6月龄5×FAD的AD小鼠模型[14-15],将它们整个大脑组织匀浆后进行qPCR表达验证,结果发现这7个E3泛素连接酶在APP/PS1 和5×FAD 小鼠脑组织中表达量均有不同程度的下调趋势,其中NEDD4L、LNX1和TRIM36 在两种AD 小鼠模型中表达量有统计学意义的降低。在APP/PS1 和对照小鼠脑组织中DTX4没有统计学差异,其他蛋白质均有统计学差异的下调;在5×FAD 小鼠脑组织中,MKRN2、RNF41和RNF8尚无统计学差异,其他蛋白均有统计学差异的下调(图5)。该结果与AlzData数据库中AD 患者的结果趋势是一致的,这提示在AD 的不同物种间这些基因可能发挥相似的重要作用,也提示AD小鼠可作为重要的模型工具研究这些基因功能。

Fig.4 Neuron-specific expression of E3 ligases in entorhinal cortex,hippocampus,temporal cortex and frontal cortex between control and AD patients

Fig.5 Neuron-specific expression of E3 ligase in cerebrum tissues between control and AD mouse model
3 讨 论
随着医疗卫生技术的发展和人们的寿命延长,AD 成为21 世纪危害最大的神经退行性疾病之一[16]。AD是一种原因不明的变性疾病,目前分子机制尚不明朗,需要进一步深入探索。高通量的数据(测序、基因芯片等)能同时对大量基因的表达水平进行检测和分析。为了减少误差,选择了样本量大于50的两组数据,两者均包括正常和AD组织的基因表达数据。从两组数据中选择共有基因进行功能富集分析,增加了分析数据的可靠性。
AD患者脑组织含有大量的异常表达基因,泛素-蛋白酶体过程和泛素结合酶结构域UBCc 分别在参与AD发生进程的生物学功能和结构域中位居首列,这与差异蛋白主要定位于胞浆和溶酶体的分析结论一致。而糖脂代谢和多巴胺能神经递质代谢是最显著改变的生物学通路,由此推测,泛素蛋白酶体功能的异常可能通过能量代谢和神经递质代谢紊乱促进AD 的发生和发展。在PPI 蛋白相互作用网络中,节点得分越高代表与其他蛋白质相互关联越强,得分前50 名蛋白质中包含大量与泛素化相关以及能量代谢相关的蛋白质分子,与GO分析结果一致。
E3 泛素连接酶在蛋白质的识别标记中起着核心作用,在进一步分析中对富集到的22个E3泛素连接酶行组织细胞学定位和AD大数据细致分析以及文献整理。由于AD的典型病理特征是淀粉样蛋白的沉积和神经元纤维缠结,前者是在神经元中形成,后转运至细胞外沉积形成老年斑;后者主要在神经元胞内聚集沉降[17]。因此,神经元内的泛素化过程异常是我们关注的重点之一[18]。针对其中特异性高表达于神经元的7 个E3 泛素连接酶(MKRN2、NEDD4L、LNX1、RNF41、TRIM36、RNF8 和DTX4)查阅Alzdata 数据库,对其在4 个不同脑区中的表达量和统计学差异进行整理。我们发现它们在AD组中表达量均低于对照组。它们的异常低表达会促进异常蛋白的累积,与AD发生发展呈正相关,推测它们可能是AD发生发展的驱动基因。这些E3 泛素连接酶在不同脑区的统计学差异有些许不同,可能与大脑不同区域的特化功能相关,例如大脑不同分区负责运动、视觉、听觉等神经转导,而记忆功能主要在海马区。
通过qPCR 方法验证AD 小鼠中7 个E3 泛素连接酶的表达趋势与AD患者基本是一致的,表明这些基因在不同物种间的功能比较保守,也提示AD小鼠可作为重要的模型工具研究这些基因功能。同时,AD 动物模型和AD 患者样本结果也存在小量差异,例如:RNF8 和DTX4 在AD 患者组在海马组织、NEDD4L 在额叶皮层中是相对高表达的,尽管尚未有统计学差异。这其中可能原因为物种差异,本文检测的是AD小鼠组织,而且动物模型的模拟程度是有限的。目前除NEDD4L1 在AD 中有少量报道,其他6 个E3 连接酶在AD 中尚无报道。这些相关信息给AD机制研究提供了线索,可以考虑构建它们的基因编辑动物模型和细胞模型,深入探索这些基因与AD疾病的关系。此外,值得注意的是,TRIM36 蛋白在AD 患者、APP/PS1 小鼠模型和5×FAD 小鼠模型中表达量都是显著降低的,在以后的研究中可作为重点研究对象进行探索。
4 结 论
本研究通过生物信息学方法分析发现泛素蛋白酶体途径异常是AD 患者最突出的生物学过程改变。神经元特异性表达的7 个E3 泛素连接酶(MKRN2、NEDD4L、LNX1、RNF41、TRIM36、RNF8 和DTX4)在AD 患者脑组织中显著低表达。这7 个E3 泛素连接酶在AD 中的功能几乎无报道(NEDD4L有少量报告),在进一步探讨AD病因机制时可以考虑构建敲除/转基因动物和细胞模型,深入研究其内在的分子原因,为AD的诊疗提供新的靶标。