黄瓜细菌性角斑病拮抗细菌的筛选及其防治效果
2022-04-22苑宝洁张红杰石延霞柴阿丽谢学文李宝聚
苑宝洁,李 磊,张红杰,石延霞,柴阿丽,谢学文*,李宝聚*
(1. 中国农业科学院蔬菜花卉研究所,北京 100081;2. 河北北方学院,张家口 075000)
黄瓜细菌性角斑病是由扁桃假单胞流泪致病变种Pseudomonas amygdalipv.Lachrymans侵染引起的一种细菌性病害[1,2],该病在苗期和成株期均可发生,苗期以子叶危害为主,成株期以叶片、叶柄以及卷须危害为主,发生严重时还可造成茎蔓和果实的危害[3-5],严重影响黄瓜产量。黄瓜细菌性角斑病菌主要在种子内或随病残体残留在土壤中存活,也可从伤口或气孔侵入对黄瓜造成危害[6]。目前,黄瓜细菌性角斑病的防治主要依靠铜制剂及农用抗生素等,与杀真菌的药剂相比种类单一,且长期使用单一药剂易造成抗药性增强[7]。因此,有针对性地筛选黄瓜细菌性角斑病菌拮抗菌株,开发可以防治黄瓜细菌性角斑病的微生物杀菌剂是病害生物防治研究的重要方向。
芽胞杆菌具有强大的繁殖能力、对营养要求不高、在各种复杂的环境下都能够生存等优点,在生物防治中有巨大的开发潜力。已经报道的能防治植物病害的芽胞杆菌主要有枯草芽胞杆菌Bacillus subtilis、多粘类芽胞杆菌Paenibacillus polymyxa、苏云金芽胞杆菌Bacillus thuringiensis、地衣芽胞杆菌Bacillus licheniformis、蜡样芽胞杆菌Bacillus cereus、侧孢芽胞杆菌Bacillus laterosporus、短小芽胞杆菌Bacillus pumilus和贝莱斯芽胞杆菌Bacillus velezensis等[8,9]。
本试验旨在从黄瓜根际土壤中筛选出高效的生防细菌,并对其抑菌效果进行初步研究,以期为黄瓜细菌性角斑病的生物药剂开发提供依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 胡萝卜果胶杆菌胡萝卜亚种Pectobacterium carotovorumsubsp. carotovorum、扁桃假单胞流泪致病变种Pseudomonas amygdalipv. lachrymans、丁香假单胞番茄致病变种Pseudomonas syringaepv.tomato、西瓜嗜酸菌Acidovorax citrulli、野油菜黄单胞野油菜致病变种Xanthomonas campestrispv.campestris、密执安棒杆菌马铃薯环腐致病变种Clavibacter michiganensesubsp.sepedonicums、茄匍柄霉Stemphylium solaniWeber、多主棒孢菌Corynespora cassiicola、炭疽菌Colletotrichumsp.、辣椒疫霉菌Phytophthora capsici、尖孢镰孢菌Fusarium oxysporum、灰葡萄孢菌Botrytis cinerea、西瓜壳二孢菌Ascochyta cittulinaSmith、茄链格孢菌Alternaria solani,以上菌株均由中国农业科学院蔬菜花卉研究所保存。
1.1.2 供试培养基 LB培养基:胰蛋白胨10 g、氯化钠10 g、酵母提取物5 g、琼脂18 g,1 L蒸馏水,用于拮抗菌株的分离和培养;NA固体培养基:牛肉膏 3 g、蛋白胨 10 g、氯化钠5 g、琼脂 18 g,1 L蒸馏水,用于病原细菌的培养及拮抗试验;NB液体培养基:牛肉膏 3 g、蛋白胨 10 g、氯化钠5 g,1 L蒸馏水,用于病原细菌菌悬液的摇培;PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂粉15 g,1 L蒸馏水,用于病原真菌的培养及拮抗试验。
1.1.3 供试黄瓜品种 黄瓜品种“中农6号”,由中国农业科学院蔬菜花卉研究所选育。
1.2 拮抗细菌的分离及纯化
先将从河北沧州,山东潍坊、寿光,北京通州、大兴等地区采集的黄瓜根际土壤样品中称取10 g土样放入装有90 mL无菌水的三角瓶中,置于28 ℃、180 r/min的摇床上震荡30 min,土壤样品充分悬浮后取出置于80 ℃的水浴锅中水浴10 min,然后将土壤样品按10-4、10-5、10-6进行梯度稀释,每个梯度吸取100 μL于LB平板上涂布,置于28 ℃培养箱中倒置培养,菌落长出后选取不同形态经平板划线法进行纯化后保存编号,备用[10-12]。
1.3 黄瓜细菌性角斑病拮抗细菌的筛选
以黄瓜细菌性角斑病为靶标菌,采用双层培养法[12]对1.2分离的拮抗细菌进行筛选。首先将活化好的拮抗细菌和病原菌用无菌接种针挑取单菌落分别转接到LB和NB液体培养基中,置于28 ℃、180 r/min摇床上振荡培养24 h,制成菌悬液备用。在90 mm的LB固体培养皿中央点入5 μL待测拮抗细菌菌悬液,于28 ℃培养箱中倒置培养24 h。待测拮抗细菌长出后取出培养皿倒置放入通风橱中,在每个培养皿的盖子里加入3 mL氯仿,放置12 h取出。在4 mL 5%水琼脂中加入100 μL黄瓜细菌性角斑病菌悬液,混匀后倒入LB平板中,作为上层。置于28 ℃培养箱中培养48 h后取出观察抑菌圈,并采用十字交叉法对抑菌圈的直径进行测量,计算抑制率。抑菌率(%)=抑菌直径/对照菌落直径×100。
1.4 拮抗细菌ZF145的鉴定
1.4.1 菌株ZF145形态观察和生理特性测定 采用三线法用接种环挑取活化好的单菌落在 LB固体平板培养基上进行划线,置于28 ℃培养箱中培养24 h后取出观察其菌落的颜色、形态和大小。依据《伯杰细菌鉴定手册》第八版及《常见细菌系统鉴定手册》,28 ℃培养 24~48 h后,对生理生化特征进行鉴定[13]。
1.4.2 Biolog测定 挑取菌株ZF145单菌落接种至LB培养基试管斜面上,28 ℃培养24 h。由中国农业微生物菌种保藏中心使用BIOLOG GENⅢ试剂盒(按照试剂盒说明书操作)对菌株ZF145进行唯一碳源利用的测定。
1.4.3 多基因扩增及序列分析 采用细菌基因组 DNA 提取试剂盒(试剂盒购北京自天根生化科技有限公司)提取菌株ZF145的总DNA,利用细菌16S rDNA的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和 1492R(5′-ACGGCTACCTTGTTACGACTT-3′),针对目标基因设计引物gyrB-F(5′-GCAGCAAAACAGT TATGATGAA-3′)和 R(5′-AGTCTTCTCCGATACCTGTGC-3′)、atpD-F(5′-ACAAGTTTGTCTTCCTC GCC-3′)和R(5′-TGAGGTCGCTCTTCATTTAGG-3′),菌株ZF145进行PCR扩增[11,15]。反应总体系为50 μL,PCR 扩增程序设置为:94 ℃预变性3 min,94 ℃变性30 s,60 ℃退火1 min,72 ℃延伸45 s,35个循环;72 ℃补充延伸10 min。扩增产物选用1%琼脂糖凝胶电泳检测,PCR产物直接采用双向测序方法进行测序。测序工作由北京博迈德生物技术有限公司完成。将所测得的菌株ZF145的16S rDNA序列分析上传NCBI,利用NCBI的Blast数据库中进行比对[14],比对不同菌株的16S rDNA、atpD、gyrB基因,采用最大似然法构建系统发育树,分析其亲缘关系。
1.5 菌株ZF145抑菌谱的测定
1.5.1 细菌抑菌谱测定 菌株ZF145对病原细菌的抑菌谱测定采取双层培养的方法。方法参照1.3黄瓜细菌性角斑病拮抗细菌的筛选。
1.5.2 真菌抑菌谱测定 采用平板对峙法[15]检测拮抗细菌对病原真菌的抑制效果。PDA平板中央接种直径5 mm的待测病原菌菌饼,28 ℃培养2 d后,在距平板中央3.5 cm处接种5 μL OD600为0.8的拮抗菌株,以不接拮抗菌株为对照,28 ℃培养5 d。每个处理重复3 次。测量靶标菌的对照菌落半径和处理菌落直径,用抑菌率表示。抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100。
1.6 拮抗菌株ZF145对黄瓜细菌性角斑病的防治效果
1.6.1 盆栽防效 将病原菌和拮抗细菌在NA/LB固体平板上活化。28 ℃培养箱中培养24 h后挑取单菌落转接到NB/LB液体培养基,置于28 ℃、180 r/min摇床上培养36 h后制备成菌悬液待用。盆栽黄瓜长至2片真叶时,喷施1×108cfu/mL黄瓜细菌性角斑病菌悬浮液。接种病菌24 h后,采用喷雾接种法接种菌株ZF145菌悬液(1×108cfu/mL),以5%中生菌素可湿性粉剂为药剂对照,清水对照只接致病菌不接生防菌。接菌后将黄瓜苗放入相对湿度 95%、温度26 ℃~28 ℃保湿柜中保湿培养24 h,之后转入相对湿度50%、温度15 ℃~20 ℃的育苗温室培养,重复3次。清水对照充分发病后计算病情指数与防治效果。黄瓜细菌性角斑病:按角斑病斑所占叶片表面积进行分级。0级:无病斑;1级:0~5%;3级:6%~25%;5级:26%~50%;7级:51%~75%;9级:75%以上。病情指数=100×∑(各级病叶数×相对级数值)/(调查总叶数×9),防治效果(%)=100×(对照病情指数-处理病情指数)/对照病情指数。
1.6.2 田间防效 本试验于2019年1月在中国农业科学院寿光蔬菜研发中心日光温室内检测贝莱斯芽胞杆菌对黄瓜细菌性角斑病的田间防治效果。试验期间温室内按同一标准进行管理,在温室内设置3个独立的隔离拱棚,每个拱棚长为10 m,宽为3 m,共计30 m2,每个拱棚内种植2垄黄瓜,每垄种植33株,待黄瓜植株长至10片真叶时,采用喷雾接种法将1×108cfu/mL的黄瓜细菌性角斑病菌悬液接种于黄瓜植株上,每株黄瓜接种25 mL菌悬液,24 h后分别接种1×108cfu/mL贝莱斯芽胞杆菌ZF145菌悬液100倍液喷雾处理,5%中生菌素可湿性粉剂1000倍喷雾处理和清水对照。清水对照只接致病菌,待清水对照发病后,开始调查其他处理的病情指数,计算防治效果。
2 结果与分析
2.1 拮抗细菌的分离筛选
采用平板稀释法,对采集的7份黄瓜根际土壤样品中的拮抗细菌进行分离。最终获得384株拮抗细菌,并对其进行保存、编号。通过双层培养法测定对黄瓜细菌性角斑病的抑制效果,筛选到8株对黄瓜细菌性角斑病抑制效果较好的拮抗菌株,其中菌株ZF145抑菌圈直径最大(图1),显著高于其他菌株的抑菌直径,为5.60 cm,抑制效果为62.22%(表1)。

图1 菌株ZF145对黄瓜细菌性角斑病的抑制效果Fig. 1 The inhibitory effect of antagonistic strain ZF145 on bacterial angular leaf spot of cucumber

表1 拮抗细菌菌株对黄瓜细菌性角斑病的防效Table 1 Control effect of antagonistic bacterial strains on bacterial angular leaf spot of cucumber
2.2 拮抗细菌ZF145的鉴定
菌株ZF145在28 ℃培养箱中培养24 h后,在LB固体培养皿上菌落为乳白色,边缘不规则,有褶皱(图2)。生理生化测定结果表明,菌株ZF145为革兰氏阳性菌,在NaCl含量1%~8%的培养基上均能生长,柠檬酸盐利用、明胶液化为阴性;Biolog检测结果表明,菌株ZF145可以利用α-D-葡萄糖、氯化锂、亚碲酸钾、1%乳酸钠,但不能利用 D-山梨醇、D-甘露醇、丙三醇、L-谷氨酸、D-天冬氨酸、D-丝氨酸,初步鉴定菌株 ZF145属于芽胞杆菌属(表2)。菌株 ZF145全基因组长 3929800 bp (登录号GCA-014622705.1),分析菌株ZF145的多基因系统发育树,该菌株与贝莱斯芽胞杆菌Bacillus velezensisCP055160.聚在一簇,确定菌株ZF145为贝莱斯芽胞杆菌。

图2 贝莱斯芽胞杆菌ZF145在LB培养基的菌落形态Fig. 2 The colony morphology ofBacillus velezensisZF145 on LB medium

表2 ZF145生理生化特征Table 2 Physiological and biochemical characteristics of ZF145

图3 菌株ZF145基于多基因序列构建系统发育树Fig. 3 Phylogenetic tree based on the multigene sequences of strain ZF145
2.3 菌株ZF145抑菌谱的测定
拮抗菌株ZF145可以明显抑制胡萝卜软腐果胶杆菌、丁香假单胞番茄致病变种、马铃薯环腐病菌、野油菜黄单胞野油菜致病变种和西瓜嗜酸菌5种病原细菌的生长,且对病原真菌也有明显的抑制效果,可以抑制番茄匍柄霉病、灰葡萄孢、西瓜壳二孢、尖孢镰孢菌、茄链格孢、辣椒炭疽病菌、多主棒孢菌、辣椒疫霉菌8种病原真菌的生长,表明拮抗菌株ZF145具有较为广谱的抑菌能力(表3)。
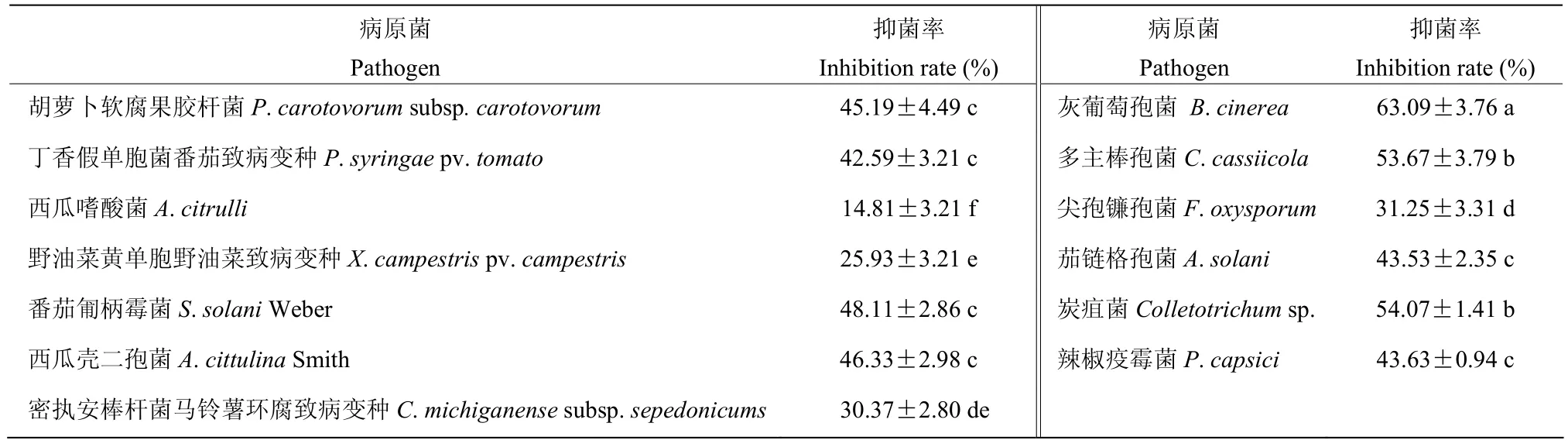
表3 菌株ZF145对病原菌的抑菌效果Table 3 The inhibitory effect of ZF145 on 14 different pathogenic fungi
2.4 拮抗菌株ZF145对黄瓜细菌性角斑病防治效果
2.4.1 盆栽防效 采用喷雾接种法对两叶一心的黄瓜植株接种黄瓜细菌性角斑病菌4 d后,清水对照开始发病,其病情指数21.09,而接种拮抗菌株ZF145菌悬液(1×108cfu/mL)后,黄瓜植株的病情指数为6.10,防治效果为71.10%,与对照药剂中生菌素的防治效果无明显差异(表4)。研究表明从土壤样品中分离出来的贝莱斯芽胞杆菌ZF145在温室条件下对黄瓜细菌性角斑病具有良好的防治效果。

表4 菌株ZF145对黄瓜细菌性角斑病的盆栽防治效果Table 4 Control effect of strain ZF145 on bacterial angular leaf spot of cucumber
2.4.2 田间防效 贝莱斯芽胞杆菌 ZF145按 108CFU/mL浓度施用时对黄瓜细菌性角斑病的防治效果为61.30%,对照药剂5%中生菌素可湿性粉剂按1000倍施用时对黄瓜细菌性角斑病的防治效果为54.48%(表5),同等条件下,贝莱斯芽胞杆菌ZF145的防治效果高于对照药剂中生菌素的防治效果,表明菌株ZF145在田间也具有较强的抑菌活性。

表5 菌株ZF145对黄瓜细菌性角斑病的田间防治效果Table 5 Control efficacy of antagonistic bacteria strain ZF145 on bacterial angular leaf spot of cucumber
3 讨论
近年来,黄瓜细菌性角斑病发生严重,对黄瓜产量造成严重的威胁。目前,对黄瓜细菌性角斑病的防治方法主要采用化学防治,但化学药剂存在种类单一、抗药性等问题[15]。而生物防治能有效地避免这些问题,并且可以达到一菌多防的效果[16,17]。大量研究发现,土壤中存在大量的拮抗细菌,可以抑制多种病原菌的生长。从马铃薯根际土壤中筛选到一株解淀粉芽胞杆菌 Z17-2,对马铃薯立枯丝核菌具有明显的抑制作用[18]。因此,本试验以筛选黄瓜细菌性角斑病的高效生防菌株为出发点,从黄瓜根际土壤中分离出384株细菌菌株,并成功筛选获得了1株对黄瓜细菌性角斑病具有良好拮抗能力的贝莱斯芽胞杆菌ZF145。其离体抑菌率为62.22%,盆栽防治效果为71.10%,田间防治效果为61.30%。
大量研究表明,对1种病原菌具有明显抑制作用的拮抗菌株可能会对多种病原菌具有抑制效果,研究发现贝莱斯芽胞杆菌可以有效的抑制多主棒孢病菌[19]、小麦赤霉病、立枯丝核菌[20]等病原菌的生长,李新宇[21]研究发现解淀粉芽胞杆菌ZF 57可以有效抑制密执安棒杆菌番茄溃疡致病型、丁香假单胞菌番茄致病变种、胡萝卜软腐果胶杆菌、青枯雷尔氏菌、茄匍柄霉菌、多主棒孢菌的生长。本研究结果发现贝莱斯芽胞杆菌ZF145可以有效抑制胡萝卜软腐果胶杆菌、丁香假单胞菌流泪致病变种、丁香假单胞菌番茄致病变种、密执安棒杆菌马铃薯环腐致病变种、茄匍柄霉菌、灰葡萄孢菌、尖孢镰孢菌等多种病原菌的发生,表明贝莱斯芽胞杆菌ZF145应用空间较为广泛。因此,以生防菌的独特优势可作为防治真菌病害及细菌病害的有效拮抗菌株,这表明贝莱斯芽胞杆菌ZF145在黄瓜细菌性角斑病防治方面具有广阔的应用前景。
