橡胶树两种叶部病害拮抗木霉T008的筛选、鉴定及室内防效评价
2022-04-22邢梦玉侯巨梅
薛 鸣,战 鑫,王 睿,邢梦玉,刘 铜*,侯巨梅
(1.海南大学热带农林生物灾害教育部重点实验室,海口 570228;2.海南省农用生物制剂创制工程研究中心,海口 570228)
巴西橡胶树Heveabrasiliensis是属于大戟科橡胶树属的植物,原产于亚马逊森林。在中国,橡胶树主要分布于海南、广东、广西、福建、云南等地区[1]。天然橡胶广泛运用于工业、国防、交通等方面,是重要的战略储备资源,同时橡胶林也属于热带森林生态系统,对环境调节及农业可持续发展有重要意义。在橡胶种植过程中,由多主棒孢菌Corynesporacassiicola引起的橡胶树棒孢霉落叶病是橡胶树的毁灭性病害之一,该病害可造成胶乳减产,严重时可造成植株生长迟缓,整株死亡[2,3]。由胶孢炭疽菌Colletotrichum gloeosporioides引起的橡胶炭疽病是一种重要的叶部病害,在橡胶种植区普遍发生[4-6]。目前生产上主要采用化学药剂来防治这两种病害,但是化学药剂对土壤和生态环境有较大的影响,所以开发一种安全、绿色的防治方法将有助于橡胶产业的绿色发展[7-9]。
木霉是一种广泛存在于土壤中的生防微生物,通过产生一些代谢产物和细胞壁降解酶等抑制病原菌的生长[11,12],同时可以诱导植物产生抗病性。目前,国内外开发的木霉制剂已经应用于各类植物病害的防治,但对于橡胶树胶孢炭疽病和棒孢霉落叶病的防治作用却鲜有报道[13]。本文拟从橡胶园根际土壤中分离,以期获得拮抗两种病原菌的木霉,为防治这两种橡胶树病害提供具有生防潜力的菌株。
1 材料与方法
1.1 供试菌株及培养基
引起橡胶炭疽病的胶孢炭疽菌由海南大学植物保护学院林春花教授赠惠,引起橡胶棒孢霉落叶病的多主棒孢霉由海南大学木霉菌课题组保存。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,水定容至1 L。PD培养基:马铃薯200 g,葡萄糖20 g,水定容至1 L。PDAm培养基:马铃薯200 g,葡萄糖18 g,琼脂15 g,玫瑰红0.02 g,定容到1 L,121 ℃灭菌冷却后加入氯霉素0.1 g,链霉素0.3 g。CMD培养基:玉米粉30 g,葡萄糖18 g,琼脂18 g,水定容至1 L。SNA培养基:KH2PO41.0 g,KCl 10.5 g,KNO31.0 g,MgSO40.5 g,葡萄糖0.2 g,蔗糖0.2 g,琼脂18 g,水定容至1 L。木霉几丁质酶产酶培养基:称取粉末状几丁质0.5 g,FeSO4·7H2O 0.01 g,MgSO4·7H2O 0.06 g,KH2PO40.2 g,NH4NO30.3 g,蒸馏水定容至100 mL。DNS溶液:酒石酸钾钠18.2 g,溶于50 mL蒸馏水中,加热后在溶液中依次加入3,5-二硝基水杨酸0.63 g,NaOH 2.1 g,苯酚0.5 g,搅拌至溶解,冷却后用蒸馏水定容至100 mL,室温避光保存。
1.2 拮抗木霉分离
2020年9月12日,在海南儋州那大橡胶园(19°25′53″ N,109°34′11″ E)采集橡胶树根际土壤 16份,分别保存在塑封袋并置于冰盒中,当天转运实验室保存于4 ℃备用。木霉分离采用稀释平板法进行,具体操作如下:取10 g根际土样放入无菌三角瓶中,加入90 mL ddH2O,于28 ℃、180 r/min振荡培养30 min后静置,取上清液稀释100倍,然后取稀释液0.2 mL均匀涂布PDAm平板,于28 ℃黑暗培养2 d后,观察是否有菌落长出,挑选单一菌落进行形态学观察,将疑似木霉挑出与纯化,保存4 ℃冰箱备用。
1.3 对峙培养与拮抗系数测定
将木霉菌株、胶孢炭疽菌和多主棒孢菌转接于PDA培养基上,置于28 ℃恒温培养5 d后,用打孔器(φ=5 mm)沿菌丝边缘切下菌饼,分别将木霉菌饼与病原菌菌饼对称接种到平板PDA培养基两侧,中间相距5 cm,以只接病原菌为对照,于28 ℃培养10 d后,测量病原菌菌落半径,计算抑制率,抑制率(%)=(对照菌落半径-处理菌落半径)/对照菌落半径×100。拮抗系数分级标准[14]:Ⅰ级,木霉菌丝占平皿的100%;Ⅱ级,木霉菌丝占平皿的 2/3 以上;Ⅲ级,木霉菌丝占平皿的 1/3~2/3;Ⅳ级,木霉菌丝占平皿的1/3以下;Ⅴ级,病原菌丝占平皿的100%。试验重复3次。
1.4 非挥发性物质及挥发性物质对病原菌的抑制作用
将木霉菌株活化5 d后,利用无菌水稀释成含量为1×108孢子/mL的分生孢子悬浮液,取100 μL分生孢子悬浮液接种在100 mL PD培养基中,28 ℃、180 r/min振荡培养4 d,发酵液8000 r/min离心2 min。取上清液用0.22 μm无菌滤膜过滤,收集过滤液,取10 mL木霉过滤液与40 mL熔化的PDA培养基混合倒平板,以10 mL无菌水和40 mL熔化的PDA培养基混合倒平板为对照。待平板凝固后,分别在含过滤液培养基和对照平板中央接种病原菌,待菌落生长4 d后用十字交叉法测量病原菌的菌落半径,计算木霉非挥发性物质对病原菌的拮抗作用,抑制率计算公式同1.2.1,试验重复3次。
采用对扣培养法测定挥发性物质对病原菌的抑制作用[15]。将木霉接种在PDA培养基中,28 ℃黑暗培养3 d后,揭去皿盖,在上方覆盖一张无菌玻璃纸(直径大于培养皿),将另一个大小一致中心接种病原菌的平板(去盖)对扣在木霉培养基上方,用封口膜封闭,以不接种木霉的对扣为空白对照。培养4 d后,用十字交叉法测量病原菌的菌落半径,计算抑制率。试验重复3次。
1.5 几丁质酶活测定
胶态几丁质制备及几丁质酶活测定参照Berger和Rynolds[16]描述的方法,将10 g粉末状几丁质置于研钵中,少量多次加入4 ℃预冷浓盐酸,研磨呈糊状,置于4 ℃静置24 h。将静置好的几丁质用纱布过滤,滤液用蒸馏水搅拌稀释,3000 r/min离心10 min后去上清,如此反复至溶液pH呈中性,然后用蒸馏水定容至1000 mL。将摇培4 d的木霉发酵液经三层纱布过滤,取5.0 mL滤液加入2.0 mL胶态几丁质,置于37 ℃保温3 h后,取2.0 mL滤液加入1.5 mL DNS、1.0 mL缓冲液,沸水浴10 min,冷水冷却至室温,用540 nm比色测定OD值。以100 ℃灭活10 min的酶液为空白对照,试验重复3次。以1.0 mL粗酶液每1 h分解胶态几丁质产生l μmol还原糖(N-乙酰氨基葡萄糖)的酶量定义为一个酶单位(U)。
1.6 木霉形态特征观察
将木霉分别转接于PDA、CMD、SNA培养基上,于26 ℃下黑暗培养,每隔24 h观察菌株在3种培养基上的菌落形态、生长速度、颜色和色素等特征,进行拍照记录。
1.7 木霉分子鉴定
采用CTAB法提取木霉菌丝DNA,以引物EF-1728F 5′-GAAGTCATCATGACCGTTCTGCA-3′和TEFRg 5′-GCCATCCTTGGGAGATACCAGC-3′扩增基因tef-1α(translation elongation factor 1 alpha)片段;以引物rpb2-5f:5′-GAYGAYMGWGATCAYTTYGG-3′和 rpb2-7cr:5′-CCCATRGCTTGYTTRCCCAT-3′扩增基因rpb2(RNA polymerase B subunit II)片段[17,18]。PCR产物通过1%琼脂糖凝胶电泳检测后,切胶回收目的条带后连接至T载体,送至上海生工公司进行测序。将获得tef-1α以及rpb2序列采Snapgene软件切除质量较低序列,通过Blast在线(http://blast.ncbi.nlm.nih.gov/Blast.cgi)与在GenBank中的基因序列进行对比分析,从GenBank中获取不同木霉菌的tef-1α和rpb2序列,采用MEGA10对tef-1α-rpb2序列拼接后,以邻接法(neighbor-joining method)构建系统发育进化树,用 Bootstrap 对系统树进行检验,1000次重复[19]。
1.8 室内防效测定
将胶孢炭疽菌和多主棒孢菌分别在PDA培养基上,于28 ℃培养3 d后,从菌落边缘取直径5 mm的菌饼5块,接种在含有100 mL PD的250 mL三角瓶中,在28 ℃光照250 r/min振荡培养7 d后, 用灭菌擦镜纸过滤菌丝,获得病原菌孢子悬浮液,调整孢子浓度为1×108孢子/mL。
选取大小一致的橡胶感病品种文昌 11的古铜色嫩叶,用湿润棉球擦拭干净表面,采用灭菌的针头在橡胶叶片表面划出轻微伤口,用木霉孢子悬浮液对叶片表面均匀喷洒,待叶片自然晾干0.5 h后,在伤口处接种10 μL病原菌孢子悬浮液(1×108孢子/mL),将叶片放入铺有润湿纱布的保鲜盒内,于28 ℃保湿培养72 h后,观察发病情况并拍照记录。以未经木霉处理,只接种病原菌为对照。使用软件IMAGE J(Wayne Rasband,National Institute of Health,USA),测量病斑面积,与对照相比,计算抑制率。抑制率(%)=(对照组面积—处理组面积)/对照组面积×100。每个处理选取30个病斑,试验重复3次。
1.9 数据统计与分析
采用EXCEL和SPSS 20.0 Graph PadsPrism 8软件对数据统计分析,采用Adobe PhotoShop CS 6进行图片处理。
2 结果与分析
2.1 拮抗木霉的分离与拮抗
经形态学观察,从16份橡胶根际土壤中分离获得6株拮抗木霉。通过对峙培养试验,发现所有木霉对胶孢炭疽菌和多主棒孢菌病原菌有一定的抑制作用,其抑制率分别为 76.73%~86.16%和 58.33%~76.67%;其中T139和T008分别对胶孢炭疽菌和多主棒孢菌抑制率最高,为86.16%和76.67%;T139对多主棒孢菌抑制率最低,仅为58.33%;通过拮抗系数测定,T008、T023、T139和T235对两种病原菌的拮抗系统为Ⅰ级,表明具有较强的拮抗作用(表1,图1)。
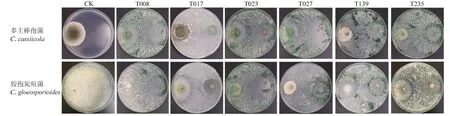
图1 6株木霉对橡胶树两种病原菌拮抗效果Fig.1 Antagonistic effect of 6 isolates of Trichoderma on two pathogens of rubber tree

表1 6株木霉对橡胶树两种病原菌生长抑制率及拮抗系数Table 1 Growth inhibition rates of 6 isolates of Trichoderma against two pathogens of rubber tree
2.2 非挥发性物质和挥发性物质对两种病原菌的抑制作用
6株木霉的非挥发性物质对2种病原菌均有一定抑制作用,但同株木霉对不同病原菌的抑制作用有明显差异。所有木霉的发酵液对胶孢炭疽菌的抑制率为30.30%~57.58%,对多主棒孢菌抑制率为33.33%~61.54%;其中菌株T017和T139的发酵液分别对胶孢炭疽菌和多主棒孢菌抑制作用最强,分别为57.58%和61.54%;通过对扣培养法测定6株木霉所产生的挥发性物质对2种病原菌的生长有一定的抑制作用,其抑制率为4.08%~35.71%;其中菌株T008对2种病原菌的抑制率最高,分别为16.33%和30.77%; 菌株T139对两种病原菌的抑制率最低,分别为4.08%和11.54%(表2)。

表2 6株木霉非挥发性物质和挥发性物质对两种病原菌的抑制率(%)Table 2 Inhibitory rate of non-volatile substance and volatile substances from 6 isolates of Trichoderma on two pathogens (%)
2.3 几丁质酶活性
6株木霉几丁质酶活性测定的结果表明,6株木霉的几丁质酶介于0.85~1.85 U,不同木霉之间产几丁质酶活差异较大,其中菌株T235、T023、T027和T008有较高的几丁质酶活性,分别为1.84、1.51、1.41和1.39 U;菌株T017产几丁质酶活最低,仅为0.85 U(图2)。结合抑制结果,选菌株T008进行后续试验。

图2 6株木霉几丁质酶活性Fig.2 Chitinase bioactivity from 6 isolates of Trichoderma
2.4 拮抗木霉T008的鉴定
木霉T008在PDA培养基可以生长迅速,3 d后可长满整个培养皿,菌落呈放射状,气生菌丝丰富,分生孢子大量形成;菌株初期呈白色,后期呈黄绿色至绿色。在CMD培养基上产生产孢簇,分生孢子形成于同心圆内,颜色呈深绿色;在SNA培养基上分生孢子较少,并聚集在同心圆上,浅绿色;在3种培养基上均无色素和特殊气味产生,菌丝分支常常对生,偶尔单生,呈塔状,瓶梗单生或2~4个轮生,孢子梗呈烧瓶形,分生孢子近圆形、光滑、深绿色(图3)。综上可知,木霉T008形态特征与棘孢木霉一致[20]。
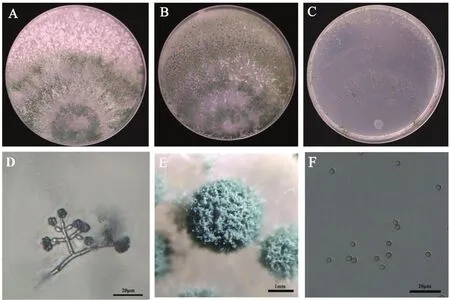
图3 木霉T008形态学特征Fig.3 Morphological charcterization of Trichoderma T008
木霉T008 基因tef-1α和rpb2经PCR扩增分别获得563和1024 bp的片段,GenBank登录号分别为MW813956和MZ361841;通过Blast与GenBank中已有的序列进行比对和系统发育树构建,结果显示菌株T008与已知棘孢木霉TRS705、TRS741、TRS742、TRS744和TRS746同属一分支(图4)。结合形态特征结果,木霉T008被鉴定为棘孢木霉。

图4 基于基因tef-1α和rpb2构建的木霉T008系统发育树Fig.4 The phylogenetic tree of Trichoderma T008 based on gene tef-1α and rpb2
2.5 棘孢木霉T008对两种病原菌的室内防效
棘孢木霉 T008的室内防效试验结果表明,通过棘孢木霉 T008孢子悬浮液预处理橡胶叶片后,分别接种胶孢炭疽菌和多主棒孢菌后,其病斑面积分别为 0.28和 0.13 cm2,而对照发病面积分别为0.44(只接种胶孢炭疽菌)和0.22 cm2(只接种多主棒孢菌)(图5a,b),抑制率分别为61.02%和58.60%,表明棘孢木霉 T008对两种病害有较好的预防作用(表3)。

表3 棘孢木霉T008对橡胶树两种病害室内防效测定Table 3 Indoor control effect of T.asperellum T008 on two diseases of rubber tree

图5 棘孢木霉T008对橡胶树两种病害叶片发病情况Fig.5 Incidence of T.asperellum T008 on two diseases of rubber tree
3 讨论
木霉生长速度快,在其生长过程中可产生一些抗生物质抑制病原菌的生长[21]。吴利民等[22]通过平板对峙试验,筛选出对黄瓜褐斑病菌具有较好抑制效果的木霉TR-12。通过对峙培养法,可以直接、有效地筛选出对靶标菌具有较好拮抗效果的菌株。李纪顺等[23]通过平板对峙试验筛选出对西洋参立枯病菌抑制率达99.33%的木霉,罗红霞等[24]筛选出9株对柑橘青霉病菌有较好的抑制效果的木霉。本试验通过平板对峙培养法从6株木霉中获得了对橡胶树两种病原菌都有较强抑制作用的菌株T139和T008。
研究报道木霉还可以产生多种次级代谢产物,可以抑制病原菌生长。赵玳琳等[25]测定了棘孢木霉GYSW-6m1发酵液对草莓炭疽病菌的抑制效果,发现草莓炭疽病菌在木霉代谢产物平板上培养3、5和7 d时,生长受到明显抑制。杨帅等[26]通过棘孢木霉的发酵液处理番茄早疫病病原菌,发现发酵液降低了番茄防御酶的量,并且增加氧化产物丙二醛(MDA)的产生,从而抑制了番茄早疫病病原菌的生长,本研究通过发酵液抑菌活性测定,发现6株木霉的发酵液对两种病原菌同样有一定的抑制作用,其中T017对胶孢炭疽菌的抑制率达到57.58%,说明该菌株可能产生高活性的抑制胶孢炭疽菌的次生代谢产物,但具体是哪些代谢产物发挥作用尚不清楚,还有待于进一步的研究。木霉同时能够产生丰富的易挥发性物质,对病原菌产生一定的抑制作用。本研究发现木霉T008产生的挥发性物质对两种病原菌有较高的的抑制作用,但是菌株 T139对两种病原菌的抑制效果较差。这也说明了不同种木霉产生的挥发性抑菌物质种类与数量有不同,从而导致对病原体菌丝抑制效果相差较大。
木霉可以产生一些细胞壁降解酶,如几丁质酶可以裂解真菌的几丁质和几丁寡聚物等物质,溶解真菌细胞壁,抑制病原菌的生长[27]。本试验通过几丁质酶活测定,发现T235可以产生较高的几丁质酶活性,但在对峙培养中没有表现出最好的抑菌效果,这可能由于木霉 T235的生长速率较慢所导致。通过以上研究表明,不同木霉对不同病原菌的抑菌活性存在差异,因此在橡胶病害综合防治中可考虑使用木霉菌混合菌剂,弥补单一木霉制剂的不足。
真菌传统鉴定方法主要以菌株在不同培养基上菌落形态、分生孢子及孢子梗等形态特征为依据,但由于培养环境的不同,一些真菌的菌落形态和某一些微观特征发生变化,因此完全从形态学特征进行鉴定会导致不准确[28]。随着分子生物学的发展,利用分子手段鉴定真菌越来越普遍,如林春花等[29]通过多基因序列法,鉴定了海南省橡胶树不同植胶地点的 16株炭疽菌,分析了海南橡胶炭疽病病原菌遗传种群,并分析出引起橡胶炭疽病的病原菌主要类群暹罗炭疽菌Colletotrichumsiamense。木霉属包括330多种,种与种之间的形态差异较小,很难从形态上完全区分不同的种,研究报道以tef-1α和rpb2保守基因可较好鉴定不同木霉种[30]。因此,本研究通过形态学特征,结合分子生物学技术,鉴定了T008为棘孢木霉。
经室内离体防效测定,发现棘孢木霉T008孢子悬浮液处理后的橡胶叶片,显著减少了叶片病斑面积,表明木霉可能在橡胶叶片上萌发,对橡胶炭疽菌和多主棒孢菌产生竞争,重寄生及诱导抗病性的作用,从而抑制了病害的发生。Pujade-Renaud等[31]从橡胶树中分离出内生真菌康氏木霉,证明了该菌株能够定殖于橡胶树内,并且对多主棒孢菌有较强的抑制效果。
