苦皮藤提取物对佐剂性关节炎大鼠的治疗作用
2022-04-21赵婷婷陈彦伶胡成刚陈桃香胡家震
赵婷婷,陈彦伶,胡成刚,唐 娟,陈桃香,胡家震
(贵州中医药大学 药学院,贵州 贵阳550025)
类风湿性关节炎(Rheumatoid arthritis,RA)是一种以关节滑膜炎及对称性、破坏性关节病变为主要特征的慢性、全身性自身免疫疾病,发病率及致残率较高[1-2]。近年来虽在RA发病机制及病理变化等研究领域取得了显著进展,但是在治疗方面,尽管西药应用广泛、疗效好,但依旧有一定的毒副作用,部分患者使用药物后可能存在心血管不良反应和感染等风险。因此,寻找安全有效的治疗药物,明确其作用机制,对RA的临床治疗有着重要的意义。
苦皮藤CelastrusangulatusMaxim.是一种多年生藤状灌木,为卫矛科Celastraceae南蛇藤属CelastrusL.植物,别名有吊干麻、老虎麻、苦树皮等[3-4]。据《贵州省中药、民族药质量标准》(2003年版)及《中药大辞典·上册》(2006年版)中记载,苦皮藤(吊干麻)具有祛风除湿、活血通经、解毒杀虫的功效,可用于治疗风湿痹痛、骨折伤痛、闭经、疮疡溃烂、头癣、阴痒等疾病[5-6]。在民间,苦皮藤单用或配方,可用于改善类风湿性关节炎的症状体征,具有一定的研究价值。据《贵州草药》记载,苦皮藤、藤萝根、白金条各30 g,泡酒服用可以治疗风湿、劳伤、关节疼痛[7],为苦皮藤的应用提供了文献参考。苦皮藤在苗族民间常用于治疗风湿类疾病,疗效较好,但是关于苦皮藤抗RA作用方面的研究在国内外尚无具体报道。本课题组前期通过体外培养人类风湿性关节炎成纤维滑膜细胞(HFLS-RA),明确苦皮藤石油醚及二氯甲烷部位均有治疗抗类风湿关节炎的作用[8]。因此,本研究进一步观察苦皮藤对佐剂关节炎(AA)大鼠足趾部炎症反应病理学变化的改善作用。
1 实验材料
1.1 实验动物
SD大鼠(SPF级),雄性,体质量180~220 g,购自长沙市天勤生物技术有限公司,合格证号:SCXK(湘)2019-0014,大鼠适应性喂养一周后用于实验。动物饲养于贵州中医药大学动物实验室,实验室温度为21~25 ℃,湿度为40%~60%,12 h/12 h明暗周期(8:00-20:00)条件下饲养,食用正规鼠用饲料及灭菌自来水。
1.2 实验药物
苦皮藤(CelastrusangulatusMaxim.)于2019年5月采自贵州省安顺市镇宁布依族苗族自治县,经贵州中医药大学中药标本馆胡成刚教授鉴定为卫矛科南蛇藤属植物苦皮藤的根,凭证标本存放于贵州中医药大学中药标本馆。苦皮藤提取物的制备:称取1 kg苦皮藤根粗粉,依次加入8倍、6倍、6倍75%乙醇75 ℃下回流提取2 h,过滤,除去药渣,合并滤液,减压浓缩至浸膏。得到150.60 g醇提物干浸膏,得膏率为15.06%。取适量干浸膏加纯水溶解制成混悬液,根据极性大小采用石油醚、二氯甲烷等比例反复萃取饱和水溶液三次,萃取至有机层无色,减压回收溶剂,剩余层挥干水分保存。最后得到苦皮藤石油醚(Petroleum ether,PE)部位、二氯甲烷(Dichloromethane,DCM)部位萃取物,称重,备用。雷公藤多苷片(贵州汉方药业有限公司,批号:1450003)。灌胃前用0.5% CMC-Na溶液配成一定浓度的溶液。
1.3 试剂及仪器
弗氏完全佐剂(Sigma,批号:J180035)、羧甲基纤维素钠(天津市大茂化学试剂厂,批号:20170724)、多聚甲醛溶液(4% PFA)(Leagene,批号:0728A20)、二甲苯(天津市致远化学试剂有限公司,批号:20200601)、EDTA脱钙液(Solarbio,批号:20200728)、苏木素染液(武汉塞维尔生物科技有限公司,批号:ZH193907)、伊红染液(珠海贝索生物技术有限公司,批号:C200403)、中性树胶(Biosharp生物公司,批号:69120060 BL704A)、自动组织脱水机(武汉俊杰电子有限公司,批号:JT-12S)、全自动染色机(常州派斯杰医疗设备有限公司,批号:RS36型)、包埋机(常州郊区中威电子仪器厂,批号:BMJ-A型)。
2 实验方法
2.1 佐剂性关节炎大鼠模型建立[9-10]
造模前用酒精对大鼠左侧后足垫消毒,皮内注射0.1 mL弗氏完全佐剂(Freund’s complete adjuvant,CFA),针头往前注射一半后,调转针头注射全部CFA,拔出针头后按压一定时间,防止溢出。正常组大鼠用生理盐水同法处理。
2.2 分组及给药
采取随机区组设计方法,将大鼠体质量分为180~190 g、190~200 g、200~210 g、210~220 g四个区组,组内编号,利用Excel获取随机数字后进行排序分组。具体分为正常对照组、模型对照组、阳性对照组(雷公藤多苷片)、石油醚部位低中高剂量组、二氯甲烷部位低中高剂量组,每组8只,共72只。
当造模后第7天,开始定时灌胃治疗,每日2次,给药体积为1 mL·100 g-1,连续给药21 d。雷公藤多苷片给药剂量为7.88 mg·kg-1;石油醚部位低、中、高给药剂量分别为2.75 g·kg-1、5.50 g·kg-1、10.99 g·kg-1;二氯甲烷部位低、中、高给药剂量分别为22.580 g·kg-1、45.15 g·kg-1、90.30 g·kg-1;正常对照组和模型组给予等体积生理盐水。
2.3 各组大鼠的状态观察及体重、足肿胀体积、脏器指数测定
造模后,每4天测定各组大鼠体质量、足肿胀体积。末次给药后,分离其脾脏和胸腺组织,称重,计算脏器指数。
2.4 关节炎指数评分
造模后,每7d对各组大鼠关节肿胀程度进行评价。按大鼠多发性关节炎全身病变5级评分法(0~4级),对大鼠4只肢体的病变程度累计积分[9]。五级评分法:0分:脚爪正常,无红肿;1分:足小趾关节轻度红肿;2分:趾关节、足趾中度红肿;3分:踝关节严重红肿或踝关节以下全部红肿;4分:整个脚爪严重红肿,甚至关节严重变形。
2.5 足踝关节病理切片
末次给药后,处死大鼠,取大鼠踝、膝关节在内的整个左后肢,放置于4%多聚甲醛溶液中浸渍固定48 h。然后将组织放入EDTA脱钙液中脱钙,每隔3天观察脱钙效果,并更换新鲜脱钙液,直至脱钙完成。脱钙组织固定组织经全自动脱水机脱水,包埋,切片脱蜡至水,苏木精染色10~20 min,自来水冲洗1~3 min,盐酸酒精分化5~10 s,自来水冲洗1~3 min,放入50 ℃的温水中或弱碱性水溶液返蓝,直到出现蓝色为止,自来水冲洗1~3 min,放入85%酒精3~5 min,伊红染色3~5 min,水洗3~5 s,梯度酒精脱水,二甲苯透明,中性树胶封固。以上标本均按病理检验SOP程序进行。切片进行镜检,采集切片图像,每张切片先于40倍下观察全部组织。
2.6 数据分析

3 结果
3.1 一般情况
正常组大鼠精神状态良好,饮食正常,皮毛有光泽。模型组大鼠精神状态较差,饮食情况及活动能力有所降低,甚至出现爬行困难,部分大鼠出现便溏。治疗3周后,阳性对照组、PE部位给药组与DCM部位给药组大鼠的上述症状均有所缓解。
3.2 苦皮藤提取物对类风湿关节炎大鼠模型体质量的影响
治疗3周后,阳性对照组、PE部位给药组与DCM部位给药组大鼠的体质量均持续增加,结果见表1。
3.3 苦皮藤对大鼠足跖肿胀度的影响
给药前,与正常对照组比较,各组造模大鼠左侧足跖肿胀度明显(P<0.01),且各造模组组间大鼠的足跖肿胀度无统计学意义,表明造模成功。在第14天左右,出现继发性关节炎。与正常组相比,模型组大鼠的左后足跖肿胀度显著增大(P<0.01)。与模型组相比较,阳性对照组、DCM中、高剂量组大鼠足踝关节肿胀度有显著性降低(P<0.05或P<0.01),结果见表2。

表1 苦皮藤提取物对类风湿关节炎大鼠模型体质量的影响
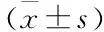
表2 苦皮藤提取物对AA大鼠足踝关节肿胀度的影响
3.4 免疫器官指数
实验结果如表3所示,模型组大鼠的胸腺指数较正常组显著增加(P<0.01)。与模型组相比,阳性对照组及DCM高剂量组能显著降低胸腺指数(P<0.05);PE低、中、高剂量组与DCM低、中剂量组能不同程度降低胸腺指数,但差异不显著(P>0.05)。
与正常组相比,模型组大鼠的脾指数升高,无统计学差异(P>0.05);与模型组相比,给药组脾指数均无统计学意义(P>0.05)。结果见表3。
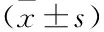
表3 苦皮藤提取物对AA大鼠免疫器官指数的影响
3.5 关节炎指数评分结果
与正常对照组相比较,各组大鼠注射CFA后,致炎局部即出现肿胀,2 h左右出现红肿充血的现象,24 h肿胀程度达到高峰,随后肿胀逐渐减轻,部分大鼠足垫注射部位出现溃烂,5~6天逐渐结痂。第14天左右模型组大鼠四只肢体出现不同程度肿胀,部分大鼠有活动障碍,经统计评分发现,与模型组相比,阳性对照组与PE高剂量组与DCM高、中、低剂量组的大鼠关节炎评分有显著性降低(P<0.05或P<0.01)。结果见表4。
3.6 苦皮藤提取物对类风湿关节炎大鼠模型关节组织病理组织学的影响
各组大鼠踝关节病理学见图1,正常组大鼠关节软骨结构完整,表面被覆薄层透明软骨,关节面光滑,软骨细胞分布均匀,软骨内无血管和神经;滑膜结构清晰完整,滑膜组织无炎性细胞浸润及纤维组织增生。
AA模型组关节软骨表面轻微侵蚀,见软骨层厚薄不一,表面有纤维组织增生;滑膜结构较清晰,少量脱落于关节腔内,滑膜衬里层不同程度的炎性细胞浸润,以核呈圆形深染的淋巴细胞为主,滑膜细胞增生,见核呈长椭圆形的成纤维样滑膜细胞增多,滑膜局部见多量毛细血管增生形成血管翳。
阳性对照组有滑膜结构较清晰,少量脱落于关节腔内,有少量滑膜细胞增生,滑膜组织有少量炎性细胞浸润。

表4 苦皮藤提取物对类风湿关节炎模型关节评分的影响 分)
PE低、中、高剂量组滑膜衬里层少量炎性细胞浸润,以淋巴细胞为主,滑膜细胞增生减少,少量滑膜细胞坏死,见胞核固缩、碎裂,胞质溶解,细胞结构不清晰,血管翳减少,无明显软骨及骨组织破坏。
4 讨论
本实验选择AA模型为动物模型,AA模型发病机制为结核杆菌通过分子模拟和交叉反应,激活处于静止状态的针对Ⅱ型胶原为主的淋巴细胞克隆,从而引起自身免疫反应[11]。AA大鼠表现为多发性外周关节炎,关节局部红肿,严重致关节畸形,病理变化为滑膜增生,关节软骨破坏、骨侵蚀,伴有炎性细胞浸润,形成血管翳[12]。AA模型在临床表现、病理学、免疫学改变和病理机制等方面与人RA有许多相似特征,是筛选和研究治疗RA药物的较理想模型。据文献[13]报道,用于RA模型的大鼠有SD大鼠、Wistar大鼠及Lewis大鼠,SD大鼠综合发病率与发病程度高于Wistar大鼠、Lewis大鼠两个品系。本实验选用弗氏完全佐剂诱导SD大鼠,成功建立了AA模型。
在AA动物模型中,评价RA药物疗效的重要指标是足肿胀体积和关节病理变化[14]。本实验研究发现,苦皮藤的提取物可不同程度降低AA大鼠足肿胀度,降低关节评分。同时减轻踝关节组织病理改变,使炎症细胞浸润减少,血管翳形成减少。其中以二氯甲烷中、高剂量组效果较突出。石油醚低、中剂量组对AA大鼠症状改善效果不明显,高剂量组有一定效果。表明,苦皮藤对类风湿关节炎具有潜在防治作用。

注:滑膜细胞增生()滑膜细胞坏死(▲)淋巴细胞()浆细胞() A:空白组;B:模型组;C:阳性对照组;D:PE低剂量组;E:PE中剂量组;F:PE高剂量组;G:DCM低剂量组;H:DCM中剂量组;I:DCM高剂量组。
RA是一种自身免疫性疾病,可造成免疫器官如胸腺和脾脏发生肿大,甚至病理性损伤[15]。本实验研究发现,模型组大鼠的胸腺指数较正常组显著增加。与模型对照组比较,DCM高剂量组能显著降低胸腺指数,PE低、中、高剂量组与DCM低、中剂量组能不同程度降低胸腺指数。表明,苦皮藤提取物对类风湿关节炎的治疗作用与恢复免疫器官功能有关。综上所述,苦皮藤具有抗类风湿关节炎的作用,可作为良好的抗RA药物继续研究。
本实验大鼠给药剂量的确定来自本课题组前期的工作,本课题组选用KM小鼠进行急性毒性实验,结果显示,按照含有苦皮藤原生药材含量计算,石油醚部位的半数致死量为157.04 g·kg-1·d-1,其95%的可信区间为133.66~184.50 g·kg-1·d-1,二氯甲烷部位的最大耐受量为258 g·kg-1·d-1。根据大鼠的给药剂量是小鼠给药剂量的0.7倍,折算得到大鼠的给药剂量。再设置高中低剂量时,石油醚部位取1/10、1/20、1/40,二氯甲烷部位取1/2、1/4、1/8。
