程序性死亡受体1抑制剂联合血管内皮生长因子受体抑制剂治疗晚期卵巢癌临床观察
2022-04-21李冬荟张钟月娄世同张伟杰
李冬荟,张钟月,娄世同,张伟杰
(郑州大学第一附属医院肿瘤科,河南 郑州 450052)
卵巢癌是女性生殖系统常见的恶性肿瘤之一,其死亡率高,且具有发病率逐年上升[1]、起病隐匿、早期诊断困难、病情进展迅速、5 a生存率低等特点[2]。卵巢癌治疗以手术联合化疗为主,但多数患者术后2~3 a内复发,且部分患者出现耐药[3],因此需要迫切寻找新的有效治疗药物。
程序性死亡受体1(programmed death-1,PD-1)抑制剂可阻断PD-1与程序性死亡配体-1(programmed death ligand-1,PD-L1)的结合从而重新激活T细胞,并产生较强、持久的抗肿瘤效应,抑制肿瘤生长。目前已在晚期肝细胞恶性肿瘤[4]、霍奇金淋巴瘤[5]等肿瘤中显示出不错的抗肿瘤活性。
血管生成是一个复杂的多步骤过程,主要有血管内皮生长因子(vascular endothelial growth factor,VEGF)途径、血小板源生长因子途径、成纤维细胞生长因子途径等[6],其中VEGF是至关重要的途径之一。卵巢上皮性癌显著表达VEGF,包括别浆液性癌、黏液性囊腺癌[7]。阿帕替尼是一种口服血管内皮生长因子受体-2(vascular endothelial growth factor receptor 2,VEGFR-2)抑制剂,通过阻断下游信号,抑制内皮细胞迁移和增殖,从而有效阻断肿瘤血管形成[8]。安罗替尼是一种口服多靶点酪氨酸激酶抑制剂,其作用靶点包括VEGFR、血小板源性生长因子受体、成纤维细胞生长因子受体。小剂量抗血管生成类靶向药物联合PD-1抑制剂使肿瘤环境倾向于免疫支持的表型:有效降低转录生长因子-β水平、逆转免疫抑制的状态、阻碍免疫抑制性髓细胞的募集、有效增加肿瘤组织中淋巴细胞的浸润、显著改善组织缺氧,有效抑制肿瘤、诱导瘤内异常血管正常化,两者联合可能具有协同作用[9-11]。本研究回顾性分析郑州大学第一附属医院收治的66例使用PD-1抑制剂联合VEGFR抑制剂治疗二线及以上治疗失败的晚期卵巢癌患者的临床资料,探讨PD-1抑制剂联合VEGFR抑制剂治疗晚期卵巢癌患者的临床效果,现报道如下。
1 资料与方法
1.1 一般资料收集2019年1月至2021年12月期间在郑州大学第一附属医院肿瘤科就诊并经病理学确诊的66例晚期卵巢癌患者,患者年龄为58(21~77)岁(表1)。纳入标准:1)经病理组织学和免疫组化检查确诊的卵巢癌。至少有一个可客观测量病灶(螺旋计算机断层扫描长径≥10 mm,符合实体瘤疗效评定标准1.1的要求);2)晚期卵巢癌至少经过针对晚期病变进行的二线化疗失败的患者;距离上次治疗至少大于4周;3)ECOG评分:0~1分;4)预计生存期≥12周;5)主要器官功能正常,即符合下列标准:血常规检查示(14 d内未输血)血红蛋白≥90 g/L、中性粒细胞≥1.5×109个/L、血小板≥80×109个/L,血清生化检查示(14 d内未输白蛋白)白蛋白≥30 g/L、谷丙转氨酶和谷草转氨酶<2个正常值上限(upper limit of normal,ULN)、总胆红素≤1.5个ULN、血浆肌酐≤1.5个ULN。排除标准:1)有严重肝功能损害、严重肾功能损害、严重心脏疾病、骨髓造血功能异常的患者;2)患有其他恶性肿瘤的患者;3)4周内接受过重大外科手术、有未愈合的伤口、溃疡或骨折等身体不能耐受的患者;4)存在自身免疫性疾病或既往2 a内的该病病史(2 a内不需系统治疗、仅需甲状腺激素替代治疗的甲状腺功能减退或仅需胰岛素替代治疗的I型糖尿病除外)。

表1 66例晚期卵巢癌患者的临床资料
注:1)部分患者存在多处转移
1.2 治疗方法PD-1抑制剂:信迪利单抗[信达生物制药(苏州)有限公司,国药准字S20180016)]、特瑞普利单抗(苏州众合生物医药科技有限公司,国药准字S20191003)、雷替利珠单抗[百济神州(上海)生物科技有限公司,国药准字S20190045]、卡瑞利珠单抗(江苏恒瑞医药股份有限公司,国药准字S20190027)。VEGFR抑制剂:甲磺酸阿帕替尼片(江苏恒瑞医药股份有限公司,国药准字H20140104)、盐酸安罗替尼胶囊(正大天晴药业集团股份有限公司,国药准字H20180002)。所有患者均接受PD-1抑制剂联合VEGFR抑制剂方案治疗:卡瑞利珠单抗联合阿帕替尼19例;卡瑞利珠单抗联合安罗替尼24例;特瑞普利单抗联合阿帕替尼7例;特瑞普利单抗联合安罗替尼1例;雷替利珠单抗联合安罗替尼4例;信迪利单抗联合阿帕替尼5例;信迪利单抗联合安罗替尼6例。用药前评估患者血常规、肝功能、肾功能、心功能、血凝状态等。若患者在治疗过程中出现疾病进展或不可耐受的不良反应时需停药。
1.3 观察指标所有患者在用药前和每2个周期后复查计算机断层扫描及肿瘤标志物(糖类抗原125、糖类抗原199、糖类抗原153、糖类抗原72-4),每个周期需监测血、尿常规及肝、肾功能,同时详细记录用药期间出现的不良反应、患者生活质量。每2个周期后进行疗效评价。
1.4 疗效评价所有患者在治疗2个周期后开始疗效评价,若考虑疾病进展可提前评价。近期疗效参考实体瘤疗效评定标准1.1评价,包括完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease, SD)、疾病进展(disease progression, PD)。以CR+PR计算客观有效率,以CR+PR+SD计算疾病控制率。疾病无进展生存时间是指从治疗开始到疾病进展或因其他原因导致患者死亡的时间。不良反应的严重程度根据美国国家癌症研究所不良事件通用术语标准4.0进行评价,分为0~V度,其中V度为死亡。
1.5 随访自开始使用PD-1抑制剂联合VEGFR抑制剂时起,随访截至2021年12月1日,观察患者的疾病无进展生存时间。随访终点为PD或因任何原因停止治疗(不良反应不可耐受、死亡等)。
1.6 统计学处理采用SPSS 26.0进行统计分析。采用Kaplan-Meier生存曲线和log rank检验分析疾病无进展生存时间。采用COX比例风险回归模型对疾病无进展生存时间的影响因素进行单因素和多因素分析。检验水准α=0.05。
2 结果
2.1 近期疗效66例可评价患者中,CR 0例、PR 16例、SD 26例、PD 24例,客观有效率为24.2%(16/66),疾病控制率为63.6%(42/66)。
2.2 疾病无进展生存时间及其影响因素分析结果66例可评价患者的中位疾病无进展生存时间为4.3(2.1~6.6)个月(图1)。Log rank检验结果显示,ECOG评分(P=0.004)、既往有无手术治疗(P<0.001)影响患者疾病无进展生存时间(表2)。将单因素C0X回归分析差异有统计学意义的因素ECOG评分(P=0.007)、疲劳(P=0.043)、既往有无手术治疗(P<0.001)纳入多因素COX回归分析,结果显示ECOG评分(HR=2.694,P=0.045)、既往有无手术(HR=0.093,P<0.001)是影响患者疾病无进展生存时间的独立预后因素(表3)。
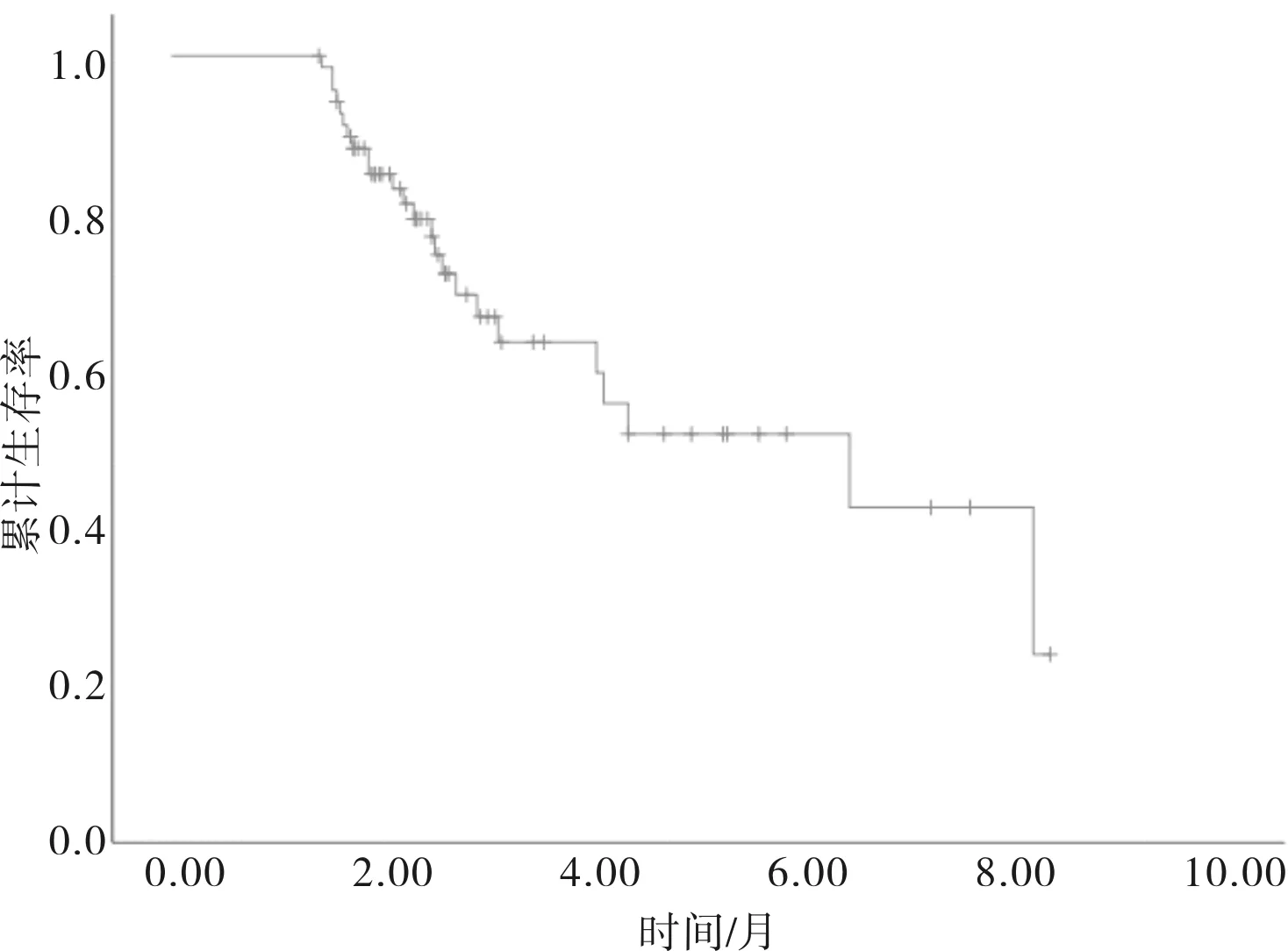
图1 66例晚期卵巢癌患者的疾病无进展生存曲线
2.3 不良反应治疗期间常见的不良反应为疲劳、食欲减退、反应性毛细血管增生症、手足综合征、腹泻等,均可耐受,大多为轻中度。见表4。
3 讨论
1992年有学者在凋亡T细胞上发现了PD-1基因[12]。T细胞表面的PD-1与正常细胞表面的PD-L1结合是机体的一种正常自我保护机制,避免过度免疫。肿瘤细胞通过自我生成的PD-L1与T细胞表面的PD-1结合,抑制T细胞增殖与活化,从而实现免疫逃逸[13]。
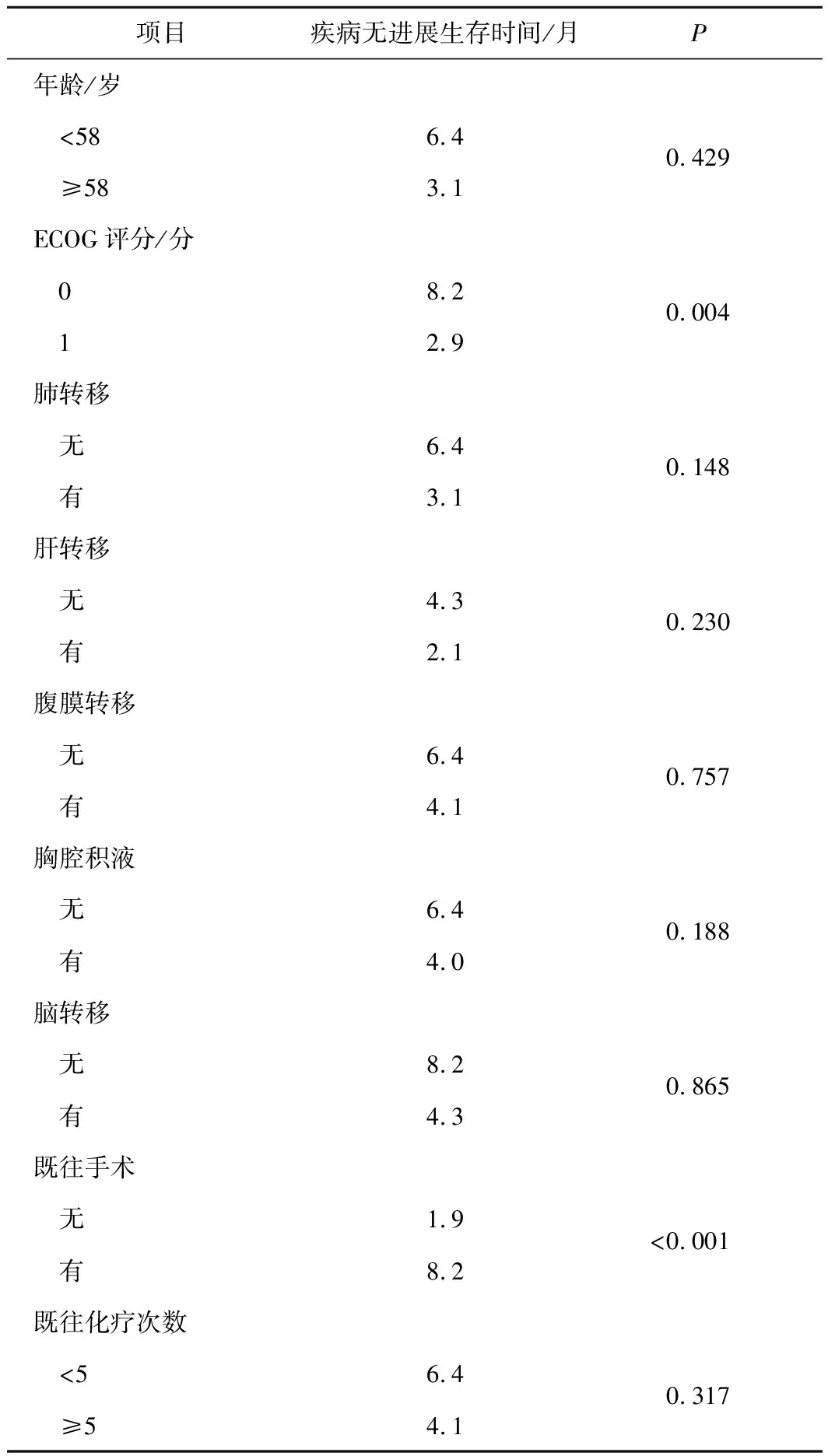
表2 66例晚期卵巢癌患者疾病无进展生存时间的log rank检验结果
有研究[14-15]证实PD-L1于卵巢肿瘤中高表达且与预后呈负相关,肿瘤上面表达的PD-L1可能会抑制肿瘤浸润淋巴细胞的浸润,使得肿瘤局部的免疫处于抑制状态。肿瘤免疫治疗是指利用机体天然存在的免疫系统,通过给予免疫调节剂、抗体、免疫细胞等,产生更强的抗肿瘤效应的一种治疗方法[16]。免疫检查点PD-1/PD-L1抑制剂通过阻断PD-1/PD-L1的结合进而重新激活T细胞,产生抗肿瘤效应,抑制肿瘤生长。目前已获批用于肿瘤治疗的PD-1/PD-L1抑制剂(如纳武利尤单抗、帕博利珠单抗等)已被证实在非小细胞肺癌、霍奇金淋巴瘤、黑色素瘤等多种肿瘤中具有较好
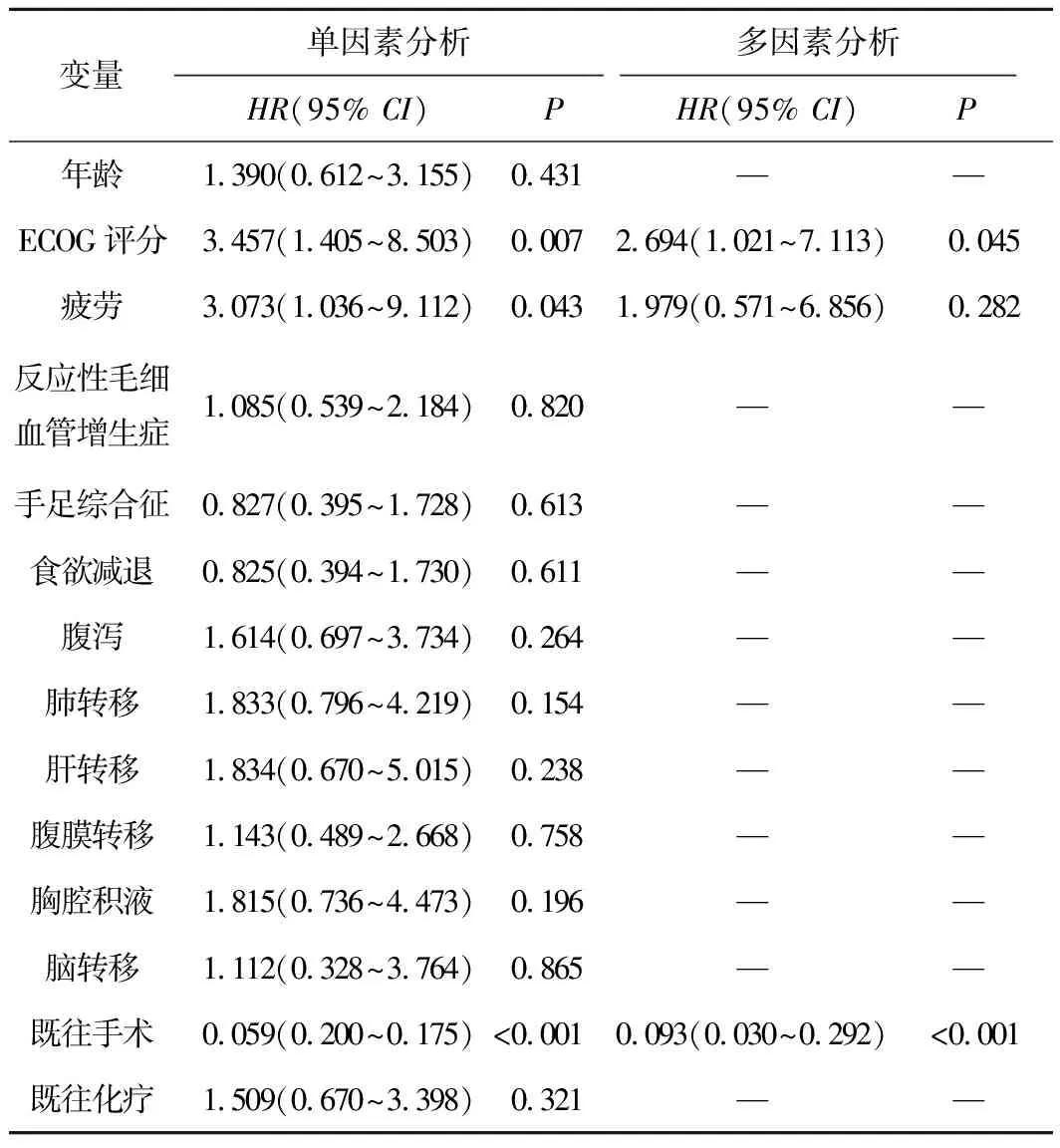
表3 66例晚期卵巢癌患者疾病无进展生存时间的COX回归分析结果
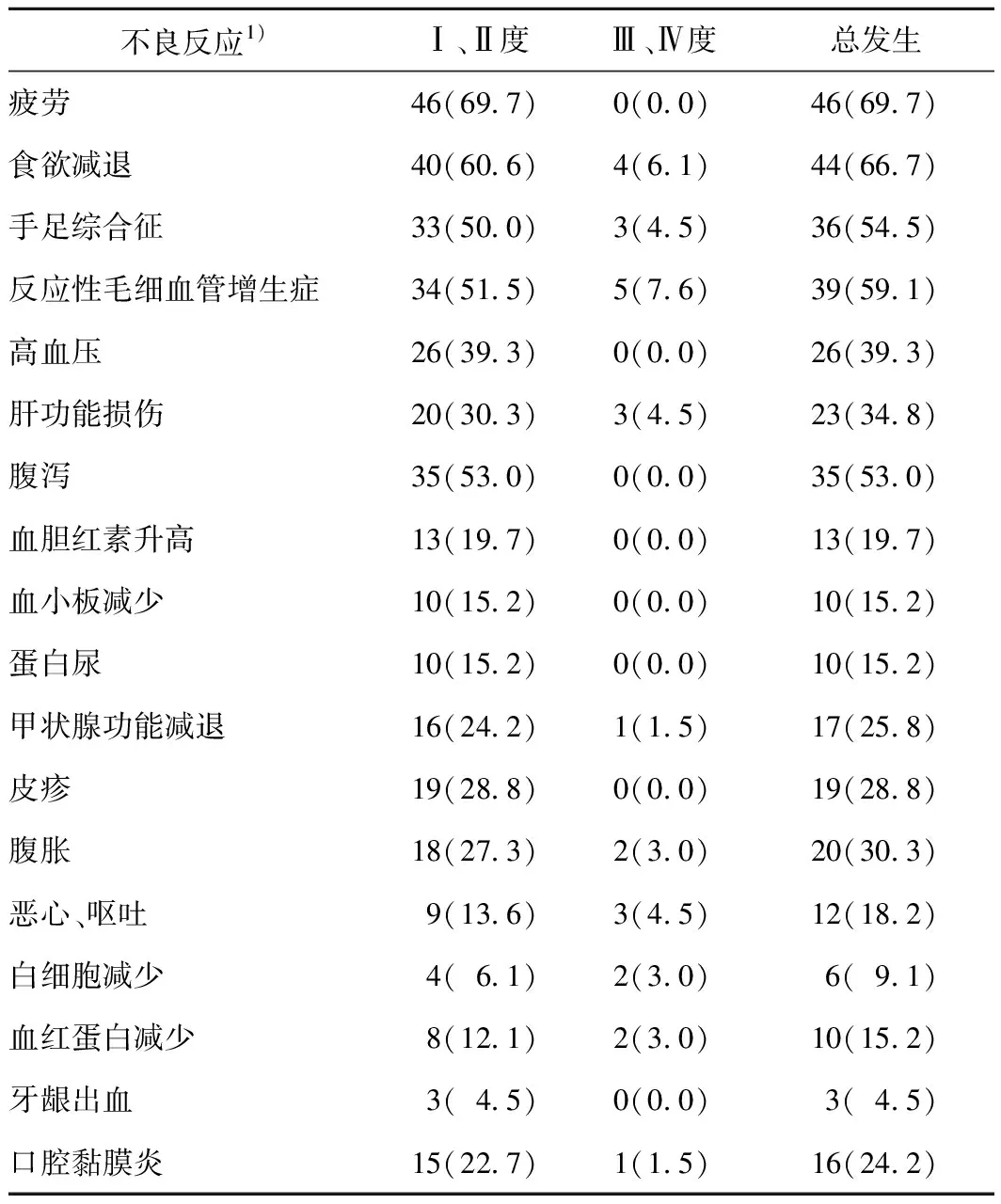
表4 66例晚期卵巢癌患者治疗相关不良反应 n(%)
注:1)部分患者出现多种不良反应
的抗肿瘤作用[17]。免疫治疗的效果受肿瘤细胞、肿瘤微环境、宿主等多种因素影响,PD-1/PD-L1抑制剂仅在效应T细胞识别肿瘤细胞这一环节发挥了作用[18]。肿瘤的异常血管系统会在肿瘤微环境引起免疫抑制,肿瘤微环境中的多种免疫抑制因素会导致免疫细胞的功能紊乱或限制其进入肿瘤内部[19]。抗血管生成类药物与PD-1/PD-L1抑制剂联合应用时,抗血管生成药物不仅可以抑制肿瘤血管的生成,还可通过诱导血管正常化降低免疫抑制,增强效应免疫细胞浸润,增强抗肿瘤免疫的效果[20]。
在肿瘤治疗中免疫治疗与抗血管生成治疗组合是常用的方法,已在一些肿瘤中取得可喜的研究结果。阿帕替尼联合卡瑞利珠单抗治疗晚期肝细胞癌,结果显示16例可评价患者客观有效率达50%,疾病控制率达93.8%[21]。阿帕替尼联合卡瑞利珠单抗治疗既往接受化疗的晚期非鳞细胞癌的研究,结果显示94例可评价患者客观有效率达30.9%[22]。阿帕替尼、卡瑞利珠单抗联合化疗治疗晚期食管癌患者的Ⅱ期研究结果显示30例可评价患者客观有效率达80.0%,疾病控制率达96.7%[23]。PD-1抑制剂联合安罗替尼用于晚期神经内分泌癌的研究结果显示45例可评价患者客观有效率达11.1%,疾病控制率达53.5%[24]。帕博利珠单抗治疗晚期卵巢癌患者的Ⅱ期研究结果显示26例PD-L1阳性可评价患者客观有效率达11.5%,中位疾病无进展生存时间和中位总生存时间分别为1.9个月和13.8个月[25]。纳武单抗治疗晚期铂耐药复发性卵巢癌患者的结果显示20例可评价患者疾病控制率达45.0%,中位疾病无进展生存时间和中位总生存时间分别为3个月和20个月[26]。本研究结果显示,66例可评价患者的客观有效率为24.2%,疾病控制率为63.6%,疾病无进展生存时间为4.3个月。患者按照临床病理特征分组后行log rank检验分析的结果显示:ECOG评分(P=0.004)、既往有无手术治疗(P<0.001)影响患者疾病无进展生存时间。将单因素C0X回归分析差异有统计学意义的因素ECOG评分(P=0.007)、疲劳(P=0.043)、既往有无手术治疗(P<0.001)纳入多因素COX回归分析,结果显示ECOG评分(HR=2.694,P=0.045)、既往有无手术(HR=0.093,P<0.001)是影响患者疾病无进展生存时间的独立预后因素。本研究中ECOG评分0分者优于ECOG评分1分者,中位疾病无进展生存时间分别为8.2个月和2.9个月;行手术治疗者疗效优于未行手术治疗者,中位疾病无进展生存时间分别为 8.2 个月和1.9个月,这可能是由于行手术治疗者肿瘤体积小,抗肿瘤药物更容易进入肿瘤内部、机体肿瘤负荷小,一般情况较好等因素有关,这与余冬青等[27]的报道相近。治疗期间常见的不良反应为疲劳、食欲减退、反应性毛细血管增生症、手足综合征、腹泻等,均可耐受,大多为轻中度,无治疗相关死亡。
综上所述,PD-1抑制剂联合VEGFR抑制剂用于二线及以上治疗失败的晚期卵巢癌患者有一定疗效,且安全性良好。本研究的主要局限性是未设立对照组及样本量较小,未来需进一步设置如接受常见晚期卵巢癌的三线治疗方案对照组并适当扩大样本量等,目前此治疗方法仍处于临床探索阶段,仍需进一步观察探索。
