壳聚糖导电自修复凝胶的构建
2022-04-21楚陈晨张丽颖王文进明德梅卢麒麟
楚陈晨,张丽颖,王文进,明德梅,卢麒麟
(闽江学院福建省新型功能性纺织纤维及材料重点实验室,福建 福州 350108)
纳米纤维素因其良好的生物相容性、高比表面积、高机械性能和韧性备受关注[1]。通过醛化改性,纳米纤维素可以很快地转化成高活性交联剂——双醛纳米纤维素,其大长径比和比表面积增加了水凝胶中大量的活性连接,这些连接很容易被破坏和重组,使水凝胶能够快速自我修复[2-3]。此外,双醛纳米纤维素可作为纳米增强填料来提高水凝胶的强度,这也限制了“软”水溶性羧甲基壳聚糖链在水溶液中的运动,赋予水凝胶高的流体吸收能力,保持水凝胶的完整性[4]。
壳聚糖是一种来源于可再生资源的天然多糖,由于它具有良好的生物降解性和生物相容性,所以在生物医学领域得到了广泛的应用[5]。壳聚糖及其衍生物的一个重要特点是伯胺基含量丰富[6]。其中的胺基可与聚合物的醛基反应,反应机理如图1所示:

图1 Schiff碱键反应Fig.1 Schiff base bond reaction
该反应形成动态可逆的Schiff碱键,这种键很容易被破坏和重新形成[7]。壳聚糖衍生物水凝胶具备自愈性,能够快速自我修复,但其吸水率低,在水溶液中易降解、强度弱。
导电水凝胶结合了水凝胶的柔性特征及导电材料的电学性能,在电子皮肤、柔性传感器、新能源电池等领域具有潜在的应用前景[8]。作为导电介质之一的导电聚合物由于其具有可调的导电性能而被深入研究和广泛应用[9-10],但其不可降解性和非环境友好性仍是其一大缺陷。因此,开发生物相容性好、可生物降解的导电水凝胶成为该领域的研究热点之一。
本研究以壳聚糖/双醛纳米纤维素制备复合自修复导电水凝胶,利用壳聚糖中大量的胺基和双醛纳米纤维素中的活性醛基之间的Schiff碱键作用实现凝胶的自修复性能。在壳聚糖和PVA协同支撑和保护凝胶网络的作用下,选择添加纳米金以强化凝胶的导电能力,同时提高凝胶的力学性能。本研究成功构建了可生物降解、生物相容性好、耐用性高、导电性强的自修复导电水凝胶,为天然高分子导电凝胶材料的开发提供了一种可行的策略。
1 实验部分
1.1 试剂与仪器
高碘酸钠购自上海展云化工有限公司,浓硫酸购自福州信荣化工有限公司,壳聚糖购自美仑生物有限责任公司,聚乙烯醇购自国药集团化学试剂有限公司。以上试剂均为化学纯。
SU8010型场发射扫描电镜,日本HITACHI 公司;Nicolet 380 傅里叶变换红外光谱仪,美国 Thermo electron 公司;HAAKE MARS III 旋转流变仪,德国Thermo Scientific 公司;DTC350 ETM 电子万能试验机,深圳万测试验机设备有限公司;HS-MPRT-4 金属四探头电阻率方阻测试仪,北京合能阳光新能源技术有限公司。
1.2 试验方法
1.2.1 双醛纳米纤维素的制备
取16 g棉絮状纤维素材料,平均放入4个相同质量的玛瑙球磨罐中,放入适量的硫酸和NaIO4后进行6 h的球磨,中途加入NaIO4继续氧化。之后加入25 mL乙二醇溶液,遮光搅拌5 h,处理后倒入转速为9 000 r·min-1的离心机,待离心成中性,进行2 h的超声处理;再倒入转速为5 000 r·min-1的离心机进行离心处理,取上层乳白悬浮液即为双醛纳米纤维素[11]。
1.2.2 羧甲基壳聚糖/双醛纳米纤维素复合凝胶的构建
首先取一定量的聚乙烯醇固体放入冷凝回流装置中并放入一定量的水,加热2 h后取出静置,制得4%聚乙烯醇溶液。之后取4.267 g的5.86%双醛纳米纤维素溶液、16.7 g的3%壳聚糖和18.75 g的4% PVA溶液,将PVA溶液在磁力搅拌下缓慢滴加到壳聚糖溶液中,滴加之后冷却溶液至室温,和纤维溶液混合静置,制得壳聚糖/双醛纳米纤维素复合凝胶。
1.3 表征手段
1.3.1 扫描电子显微镜(SEM)测试
对羧甲基壳聚糖/双醛纳米纤维素复合凝胶进行冷冻干燥处理后,采用扫描电子显微镜(SEM)进行测试,获得复合凝胶的SEM图,观察分析复合凝胶的微观形貌。
1.3.2 傅立叶变换红外光谱(FTIR)分析
采用傅里叶变换红外光谱对经过混合后制得的壳聚糖/双醛纳米纤维素复合凝胶样品进行化学结构的分析。以32次/s的频率在400~4 000 cm-1的范围内扫描,获得FTIR图谱。
1.3.3 流变性能分析
旋转流变仪是研究测量材料流变学特性的仪器之一。将壳聚糖/双醛纳米纤维素复合凝胶制成半径为30 mm、高为2 mm的圆柱形材料后对其进行流变性能测试。室温下,在此凝胶的线性黏弹区内以1~10 Hz的频率扫描,测得样品的储能模量G′与损耗模量G″。
1.3.4 力学性能分析
根据ISO标准(ISO527-2)的要求采用万能材料试验机进行壳聚糖/双醛纳米纤维素复合凝胶原料的力学表征,测试其样品的压缩强度。测试时默认室温为25 ℃,并控制压缩速度为3 mm·min-1,对每组不同样品进行两次测试。
1.3.5 自修复和可注射能力测试
通过宏观观测方法测试羧甲基壳聚糖/双醛纳米纤维素复合凝胶的自修复和可注射能力。在宏观自修复能力测试中,分别制作一个用罗丹明B和一个不用染色剂的复合凝胶,放入心形的模具当中。然后将其切成两半,在无外界刺激并且室温的状态下立即将每个切割界面交叉放置在一起,并拍摄照片记录其自修复过程。
为了测试其可注射能力,把复合凝胶的原材料制备好,分别吸入注射器中,之后在烧杯中同时注射,在1 h内即可制得羧甲基壳聚糖/双醛纳米纤维素复合凝胶。
1.3.6 导电性能测试
分别取含有纳米金溶液[12]和不含纳米金溶液的壳聚糖/双醛纳米纤维素复合凝胶。在其两端分别插入二极管和电池制作一个简单电路。观察其导电性能。可以通过ρ=RS/L方程计算,其中ρ为电阻率,L为材料的长度,S为面积,R是电阻值。使用金属四探头电阻率方阻测试仪测量水凝胶的电阻。
2 结果与讨论
2.1 形貌分析
根据羧甲基壳聚糖/双醛纳米纤维素复合膜的SEM谱图(图2)所示,四处散落的凝胶单体互相胶黏形成一个网状结构,表明基材PVA溶液的添加,能够使其充分均匀地发生反应。胶黏体间的空隙少,这表明羧甲基壳聚糖中的胺基和双醛纳米纤维素中的醛基之间有稳定的结构。图3为壳聚糖的SEM谱图,可以看出大部分壳聚糖单体由于团聚现象胶黏在一起形成块状结构,呈现出扁平状,从而导致单纯壳聚糖制备的凝胶,具有“软”这一大特点[13]。

图2 壳聚糖/纤维素复合膜SEMFig.2 SEM of chitosan/cellulose composite membrane
图3 壳聚糖SEMFig.3 SEM of chitosan
由形貌分析可得基材PVA可促进两种原料互相作用,并与羧甲基壳聚糖和双醛纳米纤维素有着较好的相容性。羧甲基壳聚糖和双醛纳米纤维素也会形成一个稳定的结构。
2.2 傅立叶变换红外光谱(FTIR)表征
采用傅立叶变换红外光谱表征论证纤维素通过机械法醛基化的过程和复合凝胶自修复后的差别。如图4所示,3个样品的吸收峰位置相同,没有太大的偏差,出现峰值的区域在400~3 500 cm-1之内。3个样品在3 440 cm-1左右均存在较强的吸收峰,这是-OH的伸缩振动导致的[14]。其中醛基化的纳米纤维素相对峰值最高,自修复材料次之,说明醛基化的纳米纤维素表露出的-OH基团最多,自修复后的材料次之。在2 933 cm-1的吸收峰为C-H的伸缩振动所导致的;1 630 cm-1和1 730 cm-1则对应C=O的伸缩振动;在1 030 cm-1、1 050 cm-1、1 060 cm-1位置的吸收峰均为C-O伸缩振动导致的[15]。图4中醛基化后的纳米纤维素在这3处波段的吸收峰有明显的变化,这是由于在球磨处理后纤维素中的羧基部分被醛化,破坏了内部氢氧键(-OH),减少了其氢键的自身作用。而自修复的样品只在1 650 cm-1处的波峰有明显的变化,说明其材料中有动态Schiff碱键的形成。

图4 原料、醛基纳米纤维素和自修复凝胶的红外光谱Fig.4 Infrared spectra of raw material, aldehyde-based nanocellulose and self-healing gel
2.3 自修复材料的流变性能测定
图5中(a)、(c)分别是壳聚糖复合纳米金导电凝胶关于PVA加入量不同时的储能模量(G′)和损耗模量(G″)与频率的关系曲线。图5中(b)、(d)分别是羧甲基壳聚糖/双醛纳米纤维素复合凝胶不同摩尔比投加时的储能模量(G′)和损耗模量(G″)与频率的关系曲线。
如图5中(a)、(b)所示,不同PVA和壳聚糖含量的羧甲基壳聚糖/双醛纳米纤维素复合凝胶样品大多都表现为非线性分布。随着频率的增大,每份样品的储能模量也会稍有增加。在扫描频率为8 Hz时,储能模量会有所降低。该壳聚糖复合凝胶的储能模量会随着PVA加入量的增多呈现出先增后减的趋势,而其随着其壳聚糖投加比例的增大亦呈现同样的趋势。这可能是由于壳聚糖中的胺基和双醛纳米纤维素中的醛基发生了相互作用,增强凝胶的机械性能,但是过量的壳聚糖会导致凝胶内部结构趋向于聚集和分散,使得其力学性能降低。同时,PVA的加入使得双醛纳米纤维素具有更高的相容性,提高了复合凝胶的稳定性。鉴于对凝胶的稳定性和机械强度的考量,本研究发现PVA加入量大约控制在0.75 g能达到效果最佳,双醛纳米纤维素和羧甲基壳聚糖的摩尔比为1∶2时,可以使材料获得最佳的稳定性,此时凝胶的储能模量达到了最高值923 Pa。
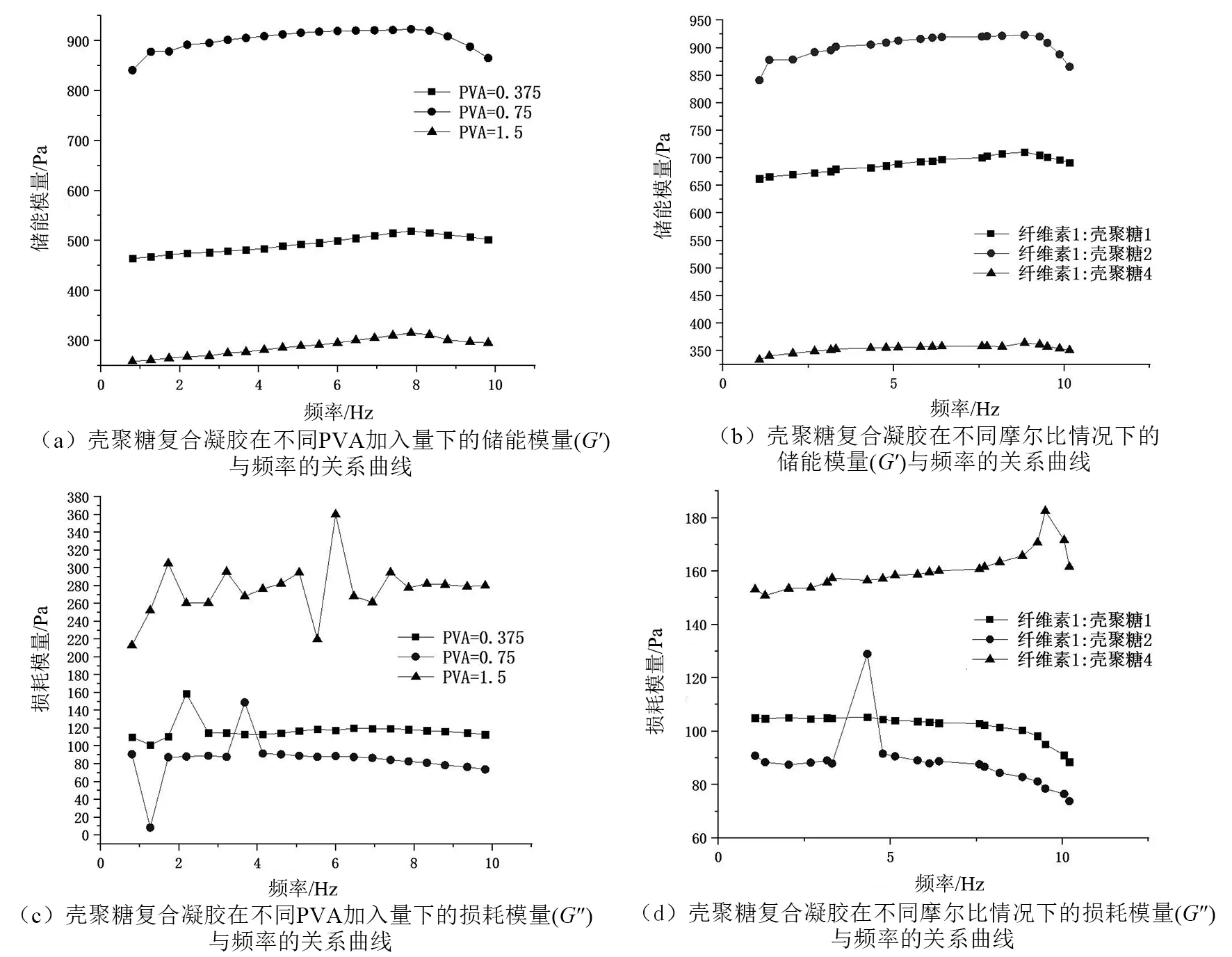
图5 壳聚糖复合凝胶的流变性能Fig.5 Rheological properties of chitosan composite gel
2.4 力学性能测试分析
壳聚糖复合纳米金导电凝胶材料的压缩强度-应变曲线如图6所示。由图6可知,所制备的自修复凝胶的应变屈服区间大约在40%~60%之间,这说明了此自修复材料都具有良好的弹性性能。复合凝胶的压缩强度随着基材PVA含量的增多和壳聚糖比例的增大而呈先增后减的趋势,当PVA含量为0.75 g,纤维素和壳聚糖的摩尔比为1∶2时,达到最大的压缩强度1.2 MPa。

图6 羧甲基壳聚糖/双醛纳米纤维素自修复材料的压缩强度-应变曲线Fig.6 Compressive strength strain curve of hydroxymethyl chitosan/dialdehyde nanocellulose self repairing material
图7和图8所示的是羧甲基壳聚糖/双醛纳米纤维素自修复复合凝胶在不同条件测得的杨氏模量的变化。随着基材PVA和壳聚糖含量的增多,杨氏模量也呈现出先增后减的状态,这与流变性能测试的结果是一致的。当纤维素和壳聚糖的摩尔比为1∶2和基材PVA的加入量为0.75 g时,样品的杨氏模量达到最大值。此时纳米纤维素中的醛基和羧甲基壳聚糖中的胺基会结合成良好的动态Schiff碱键交联,达到一定的交联作用。而PVA的存在使得此复合材料的结构更为紧密,克服了单纯壳聚糖或者纳米纤维素的软性和脆性特点。

图7 羧甲基壳聚糖/双醛纳米纤维素自修复材料测得杨氏模量随PVA的变化Fig.7 The change of Young’s modulus of hydroxymethyl chitosan/dialdehyde nano cellulose self repairing material with PVA
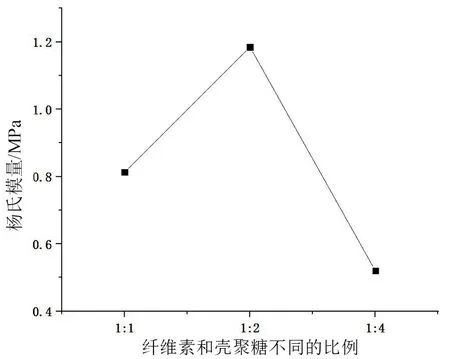
图8 羧甲基壳聚糖/双醛纳米纤维素自修复材料测得杨氏模量在不同比例的变化Fig.8 The change of Young’s modulus of hydroxymethyl chitosan/dialdehyde nano cellulose self-healing materials in different ratios was measured
2.5 自修复和可注射能力表征
为了测试壳聚糖复合纳米金导电凝胶材料的自修复能力,采用如下方法(图9):在常温状态下,制备两个完全形同的心形复合凝胶材料,在其成型后从心形中间切开,切开后拼接成两个完整的心形柱体复合凝胶材料,经过1 h,两个凝胶即可融合在一起达到自修复效果。这是由于羧甲基壳聚糖具有一个很重要的特点就是伯胺基含量丰富,可以与双醛纳米纤维素中的醛基反应,形成动态可逆的Schiff碱键,这种键很容易被破坏和重新形成,使复合凝胶能够快速自我修复。所以当其复合凝胶在受到外力破坏或者损毁时,通过将其损毁部分放置在一起,一段时间后便可恢复至原始状态。基于其良好的自修复能力、无毒性和可降解性,制备成的羧甲基壳聚糖/双醛纳米纤维素复合凝胶可在医药、生物、精细化工中扩展应用。

图9 自修复性能Fig.9 Self healing performance
以图10中展示的方法来测试复合材料的可注射能力:在常温状态下,准备两个注射器,分别在注射器内加入制备好的羧甲基壳聚糖溶液和双醛纳米纤维素溶液。之后在烧杯里同时注射,即可形成羧甲基壳聚糖/双醛纳米纤维素复合凝胶。

图10 可注射性能Fig.10 Injectability
2.6 自修复材料的导电性能
如图11所示,本研究使用一个简单的电路(由一个蓝色二极管和一个3 V的电池作为电源组成)测试自修复材料的导电性能。首先利用四探头电阻率仪测得了无添加导电离子凝胶的电阻率是114.18 Ω·m;之后往凝胶中添加导电离子纳米金溶液的方法来增加他的导电性,测得其电阻率为39.3 Ω·m;两相比较可知,纳米金的掺入显著提高了自修复复合凝胶的导电性能。

图11 导电水凝胶导电实验Fig.11 Conductive hydrogel conducting experiments
3 结论
利用机械力化学法制备双醛纳米纤维素,将其与羧甲基壳聚糖溶液和PVA溶液进行混合制得稳定性好的自修复导电凝胶。当壳聚糖和双醛纳米纤维素的摩尔比为1∶2,PVA加入量为0.75 g时,储能模量最大值是923 Pa,杨氏模量最高可达1.2 MPa。通过自修复和可注射能力分析可知,该凝胶切开1 h后基本可恢复原样,并且具有一定的可注射能力。纳米金的添加使此凝胶的电阻率从114.18 Ω·m降低至39.3 Ω·m,导电性能显著增加。
