双模板分子印迹电化学传感器的构建及同时检测磺胺类抗生素
2022-04-20孙俊永张利军司瑞茹
孙俊永,张利军,司瑞茹,刘 娴,余 聪,甘 甜*
(1.福建省农业科学院 农业质量标准与检测技术研究所/福建省农产品质量安全重点实验室,福建 福州 350003; 2. 信阳师范学院 化学化工学院,河南 信阳 464000)
0 引言
磺胺二甲嘧啶和甲氧苄啶等磺胺类抗生素除了用于人类疾病的预防和治疗,也常用于农业、水产业和畜牧养殖业,它们可通过食物链蓄积在人体中,对血液系统或者免疫系统造成损坏[1],甚至会引起各种组织器官病变[2]。因此,开发一种简单可靠的方法来检测环境和农产品中的磺胺二甲嘧啶和甲氧苄啶十分必要。
目前已报道的磺胺二甲嘧啶和甲氧苄啶的检测方法主要包括液相色谱-串联质谱法[3-4]、高效液相色谱[5]及紫外分光光度法[6]等。这些检测方法往往步骤复杂、耗时且难以实现实时在线监测。电化学传感器具有仪器设备简单、响应速度快、灵敏度高、成本低和易实现微型化自动化等优点,因而受到广泛关注。对于电化学传感器而言,构建新型识别元件以满足电化学传感器敏感元件的要求具有重要的研究意义。
分子印迹聚合物(MIPs)是一类内部具有固定形状和大小的孔穴并具有确定排列功能基团的交联高聚物,能够选择地识别模板分子或类似物,具有模拟天然受体的分子识别能力[7]。与生物敏感材料相比,MIPs有显著的耐高温、高压、酸、碱性,可以应用于有金属离子存在的环境以及有机溶剂中,可多次重复使用且易于保存,越来越成为一类重要的传感器识别元件[8]。ZHANG等[9]以3,4-乙烯二氧噻吩和甲基丙烯酸为功能单体,通过电聚合方法在电极表面制备了测定磺胺二甲嘧啶的分子印迹电化学传感器。WEI等[10]以吡咯为功能单体,在NiCo2O4纳米针和石墨烯修饰电极上制备了分子印迹电化学传感器用于食品中磺胺二甲嘧啶的分析。DA SILVA等[11]使用循环伏安法在玻碳电极表面制备了可特异性识别尿液中甲氧苄啶的聚吡咯膜,构建过程简单可控。韦贻春等[12]通过热聚合将N,N’-亚甲基双丙烯酰胺功能单体、Pd纳米粒子掺杂剂、马来松香丙烯酸乙二醇酯交联剂与甲氧苄啶模板分子进行聚合,洗去模板分子后制得了可识别和检测甲氧苄啶的电化学传感器,具有较好的选择性。然而,使用分子印迹电化学传感器对磺胺二甲嘧啶和甲氧苄啶进行同时检测的研究尚未见报道。
本文以磺胺二甲嘧啶和甲氧苄啶为双模板分子,利用溶胶-凝胶法制备了具有高识别性能的MIP,并基于此构建了分子印迹电化学传感平台。采用循环伏安法(CV)和电化学交流阻抗谱(EIS)对电极修饰过程进行了表征,用微分脉冲伏安法(DPV)研究了磺胺二甲嘧啶和甲氧苄啶的电化学行为,并对MIP制备和电化学测量参数进行优化,旨在实现该传感器对磺胺二甲嘧啶和甲氧苄啶的高灵敏同时测定。
1 实验部分
1.1 试剂和仪器
异丙醇、钛酸四丁酯(TBOT)、3-氨基丙基三乙氧基硅烷(APTES)、四氯化钛(TiCl4)、磺胺二甲嘧啶、甲氧苄啶均购自上海阿拉丁生化科技股份有限公司。所用试剂均为分析纯,未经处理直接使用。所用实验用水均为三重蒸馏水。
电化学测量在CHI 660D电化学工作站(上海辰华仪器有限公司)上完成,采用三电极体系:MIP修饰的玻碳电极(GCE)为工作电极,饱和甘汞电极(SCE)为参比电极,Pt丝为辅助电极。
1.2 MIP的合成
对文献方法稍加修改后合成MIP[13]。持续搅拌下,向4 mL异丙醇中依次加入200 μL TBOT、65 mg磺胺二甲嘧啶和75 mg甲氧苄啶,完全溶解后,再加入25 μL APTES和15 μL TiCl4。将混合液放置在水浴中,加热到60 ℃反应1 h。然后将混合液移出水浴,室温下继续剧烈搅拌8 h。最后将反应液在8000 r/min离心10 min,所得产物在60 ℃干燥得到未洗脱的MIP。
将10 mg未洗脱的MIP加入到10 mL甲醇中搅拌30 min以脱去基质中印迹的磺胺二甲嘧啶和甲氧苄啶,真空干燥后即得到MIP。将该MIP分散于水中制成2 mg/mL的分散液备用。作为对比,在不加模板分子磺胺二甲嘧啶和甲氧苄啶的情况下,用同样的方法制得非印迹聚合物(NIP)。
1.3 传感器的制备
将直径为3 mm的GCE在抛光板上用Al2O3浆打磨1 min,然后分别在体积比为1∶1的乙醇/水混合液和水中各超声1 min,最后用N2吹干。取10 μL上述MIP水分散液滴涂在处理好的GCE表面,并在红外线灯下烤干,即制得MIP/GCE。将MIP/GCE浸泡在含30 μmol/L磺胺二甲嘧啶和50 μmol/L甲氧苄啶的水溶液中4 h可进行两种物质的重吸附,并将其标记为MIP/GCE-重吸附。其他修饰电极采用相似的方法制备。
1.4 样品预处理
选择湖水、土壤、生菜、鸡肉、猪肉和鱼肉样品考察该传感器的实用性。环境样品取自信阳本地,农产品购自本地超市。湖水样品过滤后直接使用。风干且过筛后的土壤样品(10.0 g)与乙腈(50 mL)混合,分别震荡和超声萃取5 min后将分散液过滤,保留上清液并定容至50 mL备用。称量25 g切碎的生菜样品置于三角瓶中,加入50 mL乙腈后分别超声和震荡萃取30 min,过滤后取上清液定容至50 mL备用。参照文献[14-15]方法进行肉类样品的预处理:将5.0 g搅碎后的鸡肉、猪肉和鱼肉与15 mL乙腈混合并超声提取20 min,过滤后保留萃取液进行测定。
1.5 电化学测定
DPV是一种精确度较高的伏安测量法,具有高灵敏度和高分辨率的优点,适用于电化学定量分析。以pH5.0的HAc-NaAc缓冲液为测定电解质,记录0.60~1.35 V之间的DPV曲线,分别测量0.96和1.16 V电位处的氧化峰电流作为磺胺二甲嘧啶和甲氧苄啶的分析信号。所有电化学测量均在室温下进行。
2 结果与讨论
2.1 传感器的电化学表征
通过EIS研究了电极与电解液的界面特性(图1),并采用Randles等效电路(图1的内插图)对阻抗复平面图进行模拟以确定电极体系的电荷传递电阻Rct。由图1可知,裸GCE的Rct值较大,为1047 Ω(曲线a),表明电子转移速率较低。用未洗脱MIP修饰GCE后,致密且不导电的聚合物膜阻碍了探针分子向电极表面的扩散,导致Rct增加至3140 Ω(曲线b)。将聚合物中的模板分子去除后,形成了大量利于K3[Fe(CN)6]信号分子有效扩散的印迹空腔,在MIP/GCE上观察到EIS的半圆直径大幅下降,Rct值降至436 Ω(曲线c)。当MIP/GCE重吸附磺胺二甲嘧啶和甲氧苄啶后,部分印迹空穴被占据,再次阻碍了氧化还原探针向电极界面的扩散,致使Rct值增大至872 Ω(曲线d)。以上结果证实了分子印迹电化学传感器的成功制备以及良好的识别性能。
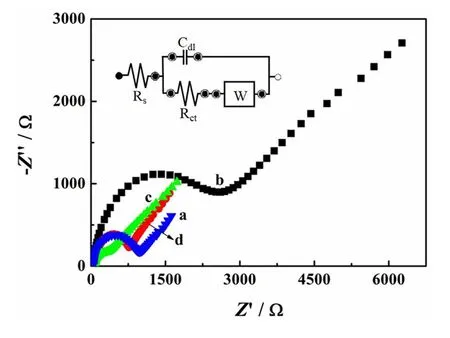
图1 裸GCE(a)、未洗脱MIP/GCE(b)、MIP/GCE(c)和 MIP/GCE-重吸附(d)在含5 mmol/L K3Fe(CN)6的 0.1 mol/L KCl溶液中的EIS曲线Fig. 1 EIS of bare GCE (a), uncoated MIP/GCE (b), MIP/GCE (c), and MIP/GCE-readsorption (d) in 0.1 mol/L KCl containing 5 mmol/L K3Fe(CN)6
在含10 mmol/L K3Fe(CN)6的1.0 mol/L KCl溶液中,采用CV法考察了不同修饰电极的电化学性能,结果如图2所示。可以看出,与裸电极(曲线a)相比,未洗脱MIP/GCE上K3Fe(CN)6的氧化还原峰电流明显减弱(曲线b),而洗脱后的MIP提供了大量印迹孔穴和扩散通道,探针分子在MIP/GCE上的氧化还原电流得到增强(曲线c)。此外,将MIP/GCE在含30 μmol/L磺胺二甲嘧啶和50 μmol/L甲氧苄啶的溶液中浸泡4 h后,被再次占据的印迹孔穴导致K3Fe(CN)6的氧化还原峰电流明显减小(曲线d),这些结果与图1中EIS结果相吻合,再次表明MIP对磺胺二甲嘧啶和甲氧苄啶具有良好的识别性能。
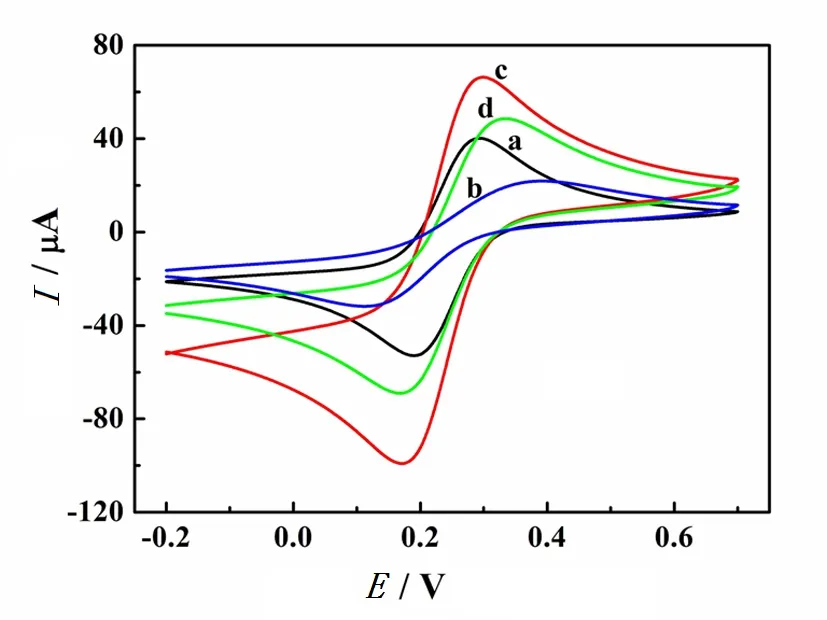
图2 1.0 mol/L KCl溶液中,10 mmol/L K3[Fe(CN)6]在 裸GCE(a)、未洗脱MIP/GCE(b)、MIP/GCE(c)和 MIP/GCE-重吸附(d)上的CV图(扫描速率为100 mV/s)Fig. 2 CVs of the bare GCE (a), uncoated MIP/GCE (b), MIP/GCE (c), and MIP/GCE-readsorption (d) in 1.0 mol/L KCl containing 10 mmol/L K3[Fe(CN)6](Scan rate is 100 mV/s)
采用DPV方法研究了不同电极在pH5.0 HAc-NaAc缓冲液中的电化学行为(图3A)。在未洗脱MIP/GCE上(曲线a),分别于0.96 V和1.16 V出现对应于磺胺二甲嘧啶和甲氧苄啶的氧化峰,它们的氧化峰电流分别为2.13和1.81 μA,氧化峰电位之差达200 mV,证明两种抗生素已成功地印迹在MIP中且可以实现同时检测。去除模板分子后,MIP/GCE在空白溶液中的DPV图观察不到磺胺二甲嘧啶和甲氧苄啶的氧化峰(曲线b),表明甲醇的洗脱可以有效解除模板分子和功能单体之前的结合,从而在MIP基质中留下特定的结合位点和特定结构的孔穴。然后,将MIP/GCE在磺胺二甲嘧啶和甲氧苄啶混合液中浸泡4 h后(曲线c),两者的氧化峰又恢复,说明MIP/GCE对磺胺二甲嘧啶和甲氧苄啶分子具有良好的亲和力。对于NIP/GCE而言,聚合物膜中没有模板分子,曲线d平滑无峰,因此这两处峰是属于磺胺二甲嘧啶和甲氧苄啶的。
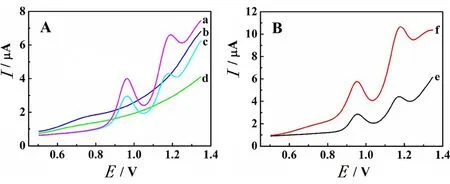
图3 (A)未洗脱MIP/GCE(a)、MIP/GCE(b)、 MIP/GCE-重吸附(c)和NIP/GCE(d) 在pH5.0 HAc-NaAc中的DPV比较图 (B)30 μmol/L磺胺二甲嘧啶和40 μmol/L甲氧苄啶 在裸GCE(e)和MIP/GCE(f)上的DPV比较图Fig. 3 (A) Differential pulse voltammograms of uncoated MIP/GCE (a), MIP/GCE (b), MIP/GCE-readsorption (c), and NIP/GCE (d) in pH5.0 HAc-NaAc (B) Differential pulse voltammograms of 30 μmol/L sulfadimidine and 40 μmol/L trimethoprim on the GCE (e) and MIP/GCE (f) in pH5.0 HAc-NaAc
同时,研究了pH5.0 HAc-NaAc缓冲液中30 μmol/L磺胺二甲嘧啶和40 μmol/L甲氧苄啶在裸GCE和MIP/GCE上的DPV行为(图3B)。在裸GCE上,磺胺二甲嘧啶和甲氧苄啶的氧化峰电流分别为1.15 μA和1.12 μA。与之相比,两者在MIP/GCE上的氧化峰电流显著增加,这是因为MIP膜上有大量的印迹位点,可有效增加磺胺二甲嘧啶和甲氧苄啶在电极表面的富集量。
2.2 条件优化
首先,研究了聚合过程中APTES功能单体的用量对传感器性能的影响。当APTES的量增加时,识别模板分子的功能基团数目增加,所以两种抗生素的氧化峰电流逐渐增大;当APTES的量为25 μL时,两种抗生素的氧化峰电流均达到最大;随着APTES量的继续增加,功能单体会自聚集且会形成复杂的印迹孔穴,反而使得两种抗生素的氧化峰电流减小。所以,APTES的最优量为25 μL。
对TBOT的用量也做了优化。分别向聚合液中加入不同量的TBOT,并对所得MIP修饰电极的电化学信号进行了比较,发现TBOT的体积为200 μL时两种抗生素的氧化峰电流最大。当TBOT的量过低时,所形成的聚合物密度太小,难以形成有效的印迹孔穴;当TBOT的量过大时,高密度的聚合物会阻碍模板分子与功能单体的结合。所以选择加入200 μL TBOT制备MIP。
印迹过程中模板分子的量对传感器的测定灵敏度也有影响。随着模板分子量的增加,MIP基质中识别位点的数目增加,两种抗生素在该传感器上的响应信号增强。而当模板分子的量过大时,MIP基质内部孔穴结构越发复杂,不利于模板分子的识别。最终,确定磺胺二甲嘧啶和甲氧苄啶的加入量分别为65和75 mg,此时可以得到两者最佳的电化学氧化信号。
然后,在制备MIP时加入5~20 μL的TiCl4,考察TiCl4对传感器性能的影响。发现当TiCl4的加入量为15 μL时磺胺二甲嘧啶和甲氧苄啶的氧化峰电流达到最大,表明TiCl4的最优体积为15 μL。
分别以乙腈、水、甲醇、乙醇和甲醇/水(1∶1,V/V)为洗脱剂,发现在甲醇中洗脱的最为彻底,在DPV曲线上几乎无法检测到两种抗生素的氧化峰。在1~50 min范围内继续考察甲醇中的浸泡时间对洗脱效果的影响。结果表明,当洗脱时间达到30 min时,磺胺二甲嘧啶和甲氧苄啶的氧化峰电流几乎为零,此时印迹位点已完全暴露,所以将聚合物浸泡在甲醇中30 min以洗脱磺胺二甲嘧啶和甲氧苄啶。
最后,对重吸附时间进行了优化。将MIP/GCE在30 μmol/L磺胺二甲嘧啶和50 μmol/L甲氧苄啶溶液中浸泡不同时间(1~6 h)后,发现磺胺二甲嘧啶和甲氧苄啶的氧化峰电流随着浸泡时间的增加而增大,当浸泡至4 h后,两者的峰电流基本保持不变,表明MIP膜中两种物质的吸附已达到饱和,故将MIP/GCE在模板分子溶液中浸泡4 h进行重吸附。
2.3 电化学氧化机理
研究了不同扫速下pH5.0 HAc-NaAc缓冲液中0.5 mmol/L磺胺二甲嘧啶(图4A)和甲氧苄啶(图4B)在MIP/GCE上的CV行为。如图4内插图所示,磺胺二甲嘧啶和甲氧苄啶的氧化峰电流(Ip)在50~200 mV/s的范围内随着扫速(ν)的增加而增大,线性回归方程分别为Ip=0.058 9ν +6.833(R=0.998)和Ip=0.125ν+18.315(R=0.996),说明磺胺二甲嘧啶和甲氧苄啶的氧化过程是受吸附控制的过程。同时,磺胺二甲嘧啶和甲氧苄啶的氧化峰电位(Ep)均随ν的增加而正移(图4内插图),Ep与lnν之间的线性关系分别为Ep=0.023 5lnν+0.889(R=0.995)和Ep=0.013 3lnν+1.157(R=0.996)。根据Laviron方程[16]:
(1)
式中:k0为表面反应的标准速率常数,E0是标准电极电位,n为反应中涉及到的电子数,α是电荷转移系数。对于受吸附控制的不可逆过程,α值通常取0.5,由此根据方程(1)的斜率计算出n分别为2和4。因此,磺胺二甲嘧啶和甲氧苄啶的电化学氧化过程分别为2电子和4电子参与的过程,电化学反应机理如方程(2)和(3)所示。
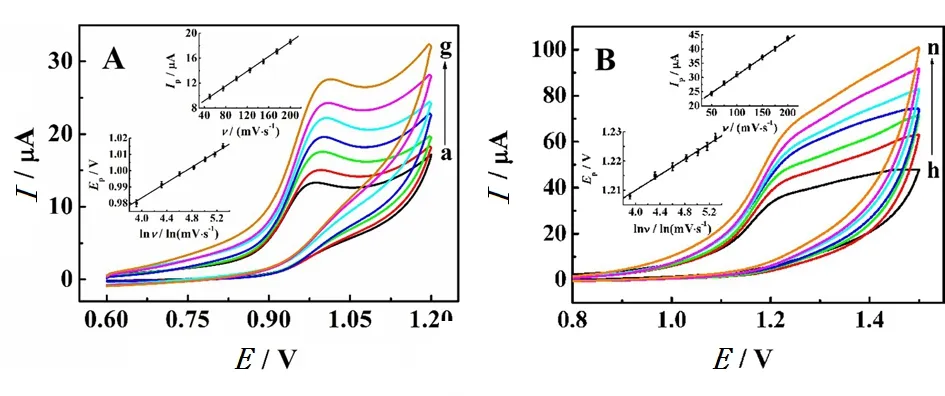
图4 在pH5.0 HAc-NaAc中,不同扫速下0.5 mmol/L 磺胺二甲嘧啶(A)和甲氧苄啶(B)在MIP/GCE上的CV曲线, 从下至上的扫速分别为50、75、100、125、150、175和200 mV/s 内插图为Ip与ν以及Ep与ln ν之间的线性关系Fig. 4 CV curves of 0.5 mmol/L sulfadimidine and trimethoprim on MIP/GCE in pH5.0 HAc-NaAc buffer with different scan rates of 50, 75, 100, 125, 150, 175, and 200 mV/s (from bottom to top) Insets: plots of Ip vs. ν and Ep vs. ln ν

磺胺二甲嘧啶 (2)
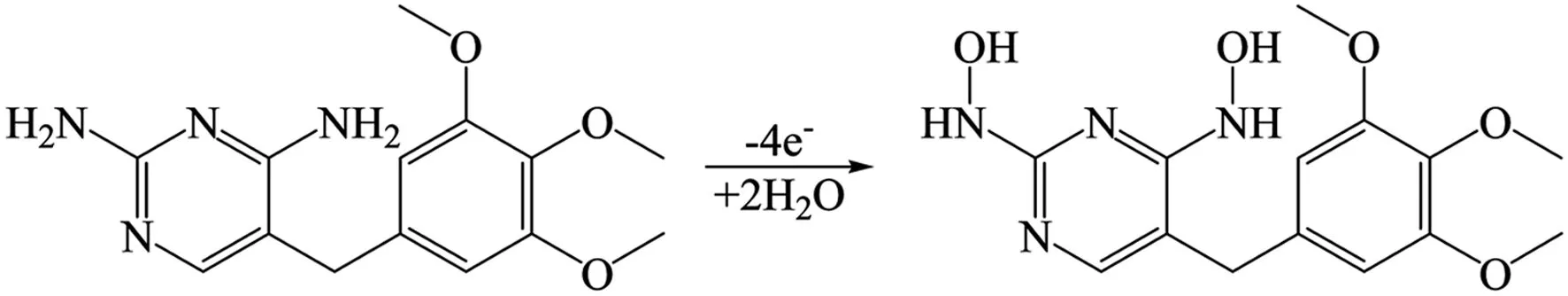
甲氧苄啶 (3)
2.4 分析性能
在优化条件下,研究了该传感器测定磺胺二甲嘧啶和甲氧苄啶的分析性能,结果如图5所示。
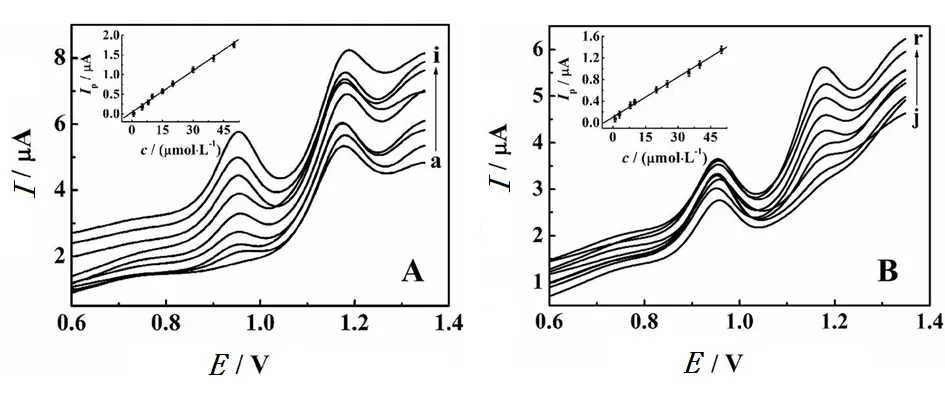
图5 pH5.0 HAc-NaAc中,50 μmol/L甲氧苄啶和 不同浓度的磺胺二甲嘧啶(A)、50 μmol/L磺胺二甲嘧啶和 不同浓度的甲氧苄啶(B)在MIP/GCE上的DPV曲线 内插图为相应的Ip与c的关系Fig. 5 DPVs of pH5.0 HAc-NaAc at MIP/GCE in 50 μmol/L trimethoprim and different concentrations of sulfadimidine (A), 50 μmol/L sulfadimidine and different concentrations of trimethoprim (B) Insets: plots of Ip vs. c
将甲氧苄啶的浓度固定为50.0 μmol/L,从0.8到50.0 μmol/L逐渐增加磺胺二甲嘧啶的浓度,从图5A中可以看出,磺胺二甲嘧啶的阳极峰电流逐渐增大,而甲氧苄啶的峰电流几乎没有变化。磺胺二甲嘧啶的峰电流与浓度成良好线性关系:Ip=0.035 3c+0.042 7(R=0.996),检出限为0.14 μmol/L(RSN=3)。然后,将磺胺二甲嘧啶的浓度固定为50.0 μmol/L,而甲氧苄啶的浓度从1.0 μmol/L增加到50.0 μmol/L,图5B显示甲氧苄啶的阳极峰电流逐渐增大(Ip=0.024 8c+0.104,R= 0.997),而磺胺二甲嘧啶的峰电流几乎没有变化,检测甲氧苄啶的检出限为0.26 μmol/L(RSN=3)。
接下来,考察结构类似物对1.0 μmol/L磺胺二甲嘧啶和甲氧苄啶测定的影响,结果如表1所示。
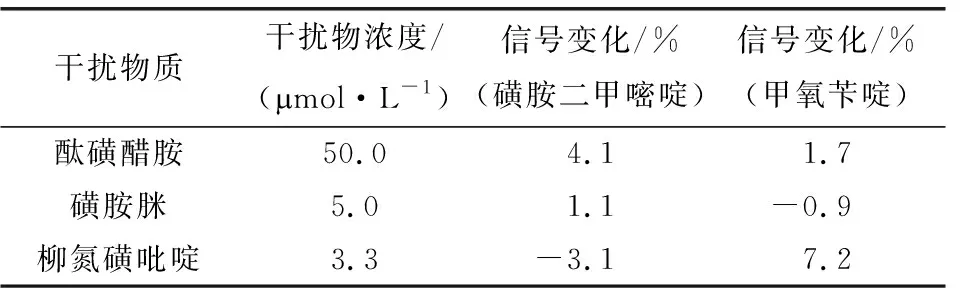
表1 该分子印迹电化学传感器的抗干扰性能Tab. 1 Anti-interference ability of the molecularly imprinted electrochemical sensor
由表1可以看出,50倍酞磺醋胺、5倍磺胺脒和3.3倍柳氮磺吡啶存在时,两种分析物的电化学氧化信号变化均小于8%,说明它们对磺胺二甲嘧啶和甲氧苄啶的测定基本没有影响。还考察了样品中可能存在的无机离子和有机物对测定的干扰,结果表明,2000倍的Na+、Fe3+、Zn2+、Cl-、葡萄糖、果酸,1500倍的Ca2+、Al3+,1000倍的K+、Mg2+、Cu2+、NO3-、SO42-、蔗糖,以及100倍的柠檬酸共存时,都不会干扰两种抗生素的测定信号,证明该分子印迹电化学传感器具有良好的抗干扰能力。
将MIP/GCE在含30.0 μmol/L磺胺二甲嘧啶和50.0 μmol/L甲氧苄啶的溶液中重吸附后测定pH5.0 HAc-NaAc中两种抗生素的氧化信号,并于每次测定后洗脱除去模板分子。如此重复10次所得响应信号的相对标准偏差(RSD)分别为2.8%和3.8%,表明该传感器至少可以重复使用10次。将单根MIP/GCE在室温干燥环境中储存28 d,每隔4 d检测1次,观察到两种抗生素的氧化峰电流没有明显改变。28 d后磺胺二甲嘧啶和甲氧苄啶的氧化峰电流仍能保留其原始响应信号的97.8%和96.9%,表明该传感器具有长期稳定性。而且,磺胺二甲嘧啶和甲氧苄啶在10根MIP/GCE上氧化峰电流的RSD分别为4.9%和3.7%,说明该传感器具有良好的重复性。
2.5 实际应用
为了评估该传感器的实际应用价值,将其用于湖水、土壤、生菜、鸡肉、猪肉和鱼肉样品中磺胺二甲嘧啶和甲氧苄啶的加标回收测定,所有数据均为6次平行测定的平均值,测定结果如表2所示。测定样品的RSD值小于4%,加标回收率介于91.20%~103.44%,说明所构建的传感器具有较高的准确度,可应用于实际样品中磺胺二甲嘧啶和甲氧苄啶的分析。

表2 实际样品中磺胺二甲嘧啶和甲氧苄啶的测定Tab. 2 The detection of sulfadimidine and trimethoprim in real samples
3 结论
本文以磺胺二甲嘧啶和甲氧苄啶为双模板分子,采用溶胶-凝胶法制备了分子印迹聚合物,基于该分子印迹聚合物构建了可以特异性识别磺胺二甲嘧啶和甲氧苄啶的分子印迹电化学传感器。结果表明,该传感器特异性强、灵敏度较高,可用于实际样品中磺胺二甲嘧啶和甲氧苄啶的定量准确检测。本文建立的传感器有望为其他抗生素的多元分析提供一种高效的检测手段。
