骆驼刺氯仿提取物镇痛抗炎作用的初步研究
2022-04-20刘琪琪宗时宇王春柳
周 洁,陈 静,刘琪琪,宗时宇,刘 洋,张 红,穆 珺,王春柳*,李 晔,
(1.陕西中医药大学 药学院,陕西 咸阳 712046;2.陕西省中医药研究院,陕西 西安 710003)
疼痛与炎症常常伴随多种疾病的发生发展过程[1]。疼痛会从心理、生理、精神等方面严重影响着患者的生活质量,已成为全球性的公共健康问题[2-3]。目前,临床上常用镇痛药主要分为阿片受体类镇痛药及解热镇痛药;抗炎药主要有甾体抗炎药与非甾体抗炎药。各类镇痛抗炎药虽然临床疗效好,但常会出现由于不合理用药或药物的不良反应引发各种安全性问题。因此,研发高效低毒的天然镇痛抗炎药物是研究者长期奋斗的目标[4]。而中药目前在镇痛抗炎活性研究方面已取得了较好的发展。
骆驼刺(Alhagi sparsifoliaShap,AS)为豆科骆驼刺属植物的干燥茎枝[5-6],也是骆驼在沙漠中能够维持生存的粮食来源,故又被形象的称为“骆驼草”[7]。骆驼刺被收录于《新疆主要饲用植物志》和《中国植物志》中[8]。骆驼刺作为维吾尔医与藏医传统医用民族药材,资源丰富,分布广泛,民间应用历史悠久,临床上主要作为治疗牙痛、头痛、腹痛腹胀等疾病的常用药[9]。其单方可用于治疗各种疼痛疾病,如头痛、牙痛、寒湿性关节炎等;复方主要在临床用于慢性风湿性关节炎、咽喉疼痛、腹痛腹泻等症的治疗。但骆驼刺作为镇痛抗炎药用时有效部位不明确,药效作用机制不清楚,且未见有相关制剂研究。本实验将以骆驼刺氯仿提取物(AS chloroform extract,ASE)为研究对象,通过小鼠热板试验、醋酸扭体试验、福尔马林致痛和二甲苯致耳肿胀试验进行ASE 镇痛抗炎活性评价,以期为骆驼刺开发成为镇痛抗炎药物奠定一定的科学基础。
1 仪器与材料
1.1 仪器与试药
ASE(实验室自制);热板测痛仪(ZH-LB100,安徽正华生物仪器设备有限公司);羧甲基纤维素钠(CMC-Na,国药集团化学试剂有限公司);醋酸(20190307,国药集团化学试剂有限公司);罗通定(20190806,泌阳盘古药业有限责任公司);吲哚美辛(20190322,上海信谊九福药业有限公司);阿司匹林(20190321,丹东医创药业有限公司)。
1.2 动物
SPF 昆明小鼠,体重18~22 g;SD 大鼠,体重180~200 g,均购自西安交通大学实验动物中心,动物许可证编号:SCXK(陕)2012-003。
2 方法
2.1 ASE的制备
称取骆驼刺干燥粗粉2.5 kg 置于圆底烧瓶中,加8 倍70%(v/v)乙醇回流提取2 次,2 h/次,过滤,合并两次滤液,于40℃减压浓缩回收乙醇后收集浓缩液;将浓缩液依次用石油醚、氯仿按照1:1(v/v)萃取3 次,合并氯仿层萃取液,于40℃减压浓缩,挥干溶剂,干燥后称重得ASE。
2.2 热板试验
雌性昆明小鼠适应性喂养3 d,分组前对小鼠进行预筛选。将热板温度设定为55±0.1℃,记录小鼠足部自接触热板至出现舔后足、跳跃等行为的潜伏时间,作为痛阈指标。小鼠的正常痛阈一般在5~30 s,筛选合格小鼠,每只小鼠间隔20 min 测定一次,计算3 次测定结果的平均值记为正常痛阈。取合格小鼠30 只,随机分为5 组,6 只/组,分别为生理盐水组(20 mL·kg-1)、罗通定阳性药对照组(0.02 g·kg-1)、ASE 高、中、低剂量组(1.00、0.50、0.25 g·kg-1)。连续灌胃给药7 d,并于末次给药后30、60、90 和120 min分别测定小鼠的痛阈值[10-11]。
2.3 醋酸扭体试验
昆明小鼠雌雄各半,并随机分为5 组,10 只/组,分别为羧甲基纤维素钠对照组(1% CMC-Na,10 mL·kg-1)、吲哚美辛阳性药对照组(0.01 g·kg-1)、ASE高、中、低剂量组(1.00、0.50、0.25 g·kg-1),按照各组给药剂量,小鼠连续灌胃给药7 d,最后一次给药后1 h,腹腔注射0.2 mL 0.6%的醋酸,以小鼠腹部内凹和伸后足的扭体反应为评价指标,观察并记录15 min 内小鼠扭体次数作为痛阈指标,并计算抑制率(%)[12]。
2.4 福尔马林试验
昆明小鼠50 只,随机分为5 组,10 只/组,分别为羧甲基纤维素钠对照组(1% CMC-Na,10 mL·kg-1)、吲哚美辛阳性药对照组(0.01 g·kg-1)、ASE高、中、低剂量组(1.00、0.5、0.25 g·kg-1),除吲哚美辛阳性药对照组外,其余组均按照上述剂量连续灌胃给药5 d。阳性药对照组于第3 天开始按照20 mL·kg-1给药0.65 mg·kg-1吲哚美辛混悬液1 次。末次给药后1 h,按照20 mL·kg-1于小鼠右后足足底皮下注射2%福尔马林溶液,观察并记录给药后神经疼痛期(第Ⅰ时相,0~10 min)与炎症疼痛期(第Ⅱ时相,15~30 min)两时相小鼠舔舐皮下注射足的累积时间,作为不同时相疼痛强度的评价指标[13-14]。
2.5 二甲苯致耳肿胀试验
昆明小鼠雌雄各半,随机分为5 组,每组10 只,分别为羧甲基纤维素钠对照组(1% CMC-Na,10 mL·kg-1)、阿司匹林阳性药对照组(0.01 g·kg-1)、ASE高、中、低剂量组(1.00、0.50、0.25 g·kg-1),按照上述剂量小鼠连续灌胃给药5 d,末次给药1 h后,每只小鼠一只耳朵的正反两面各均匀涂抹二甲苯20 μL 致炎,30 min后处死小鼠,剪下双耳,重叠后用6 mm 打孔器打出圆形耳片并称重,计算肿胀度[15-16]。
2.6 统计学方法
采用SPSS 19.0 软件对结果进行单因素方差分析,实验数据以平均值±标准偏差(±s)表示,以P<0.05表示差异有统计学意义。
3 结果
3.1 ASE对热板致痛模型的影响
由图1 可得,给药30 min 时,阳性药组与ASE高、中、低剂量组对热刺激致痛均未显示出镇痛作用;在给药后的60~120 min 中,ASE 中、高剂量组的痛阈值明显延长,与基础痛阈值相比,均显示出统计学差异(P<0.05),表明ASE 中、高剂量对热刺激引发的疼痛抑制作用显著,显示ASE 具有一定的中枢镇痛作用。

图1 不同时间点小鼠热板试验痛阈值(-x±s,n=6)Fig.1 Pain thresholds of mice in hot plate experiment at different time points
3.2 ASE对醋酸刺激痛模型的影响
由表1、图2 可知,CMC-Na 组给药后的扭体次数为(46.2±15.5)次,ASE的低、中和高剂量组的扭体次数分别为(28.0±8.9)次、(31.3±8.8)次与(24.5±5.3)次。由统计分析结果可得,与模型组相比,ASE低、中、高剂量组对减少由醋酸所致疼痛模型小鼠扭体反应次数均有显著性差异(P<0.05),其抑制率分别为39.76%、32.72%和47.23%,阳性药的抑制率可达67.88%(P<0.001)。

表1 不同给药组对醋酸刺激痛的影响(-x±s,n=10)Table1 Effects of different administration groups on pain stimulated by acetic acid(-x±s,n=10)
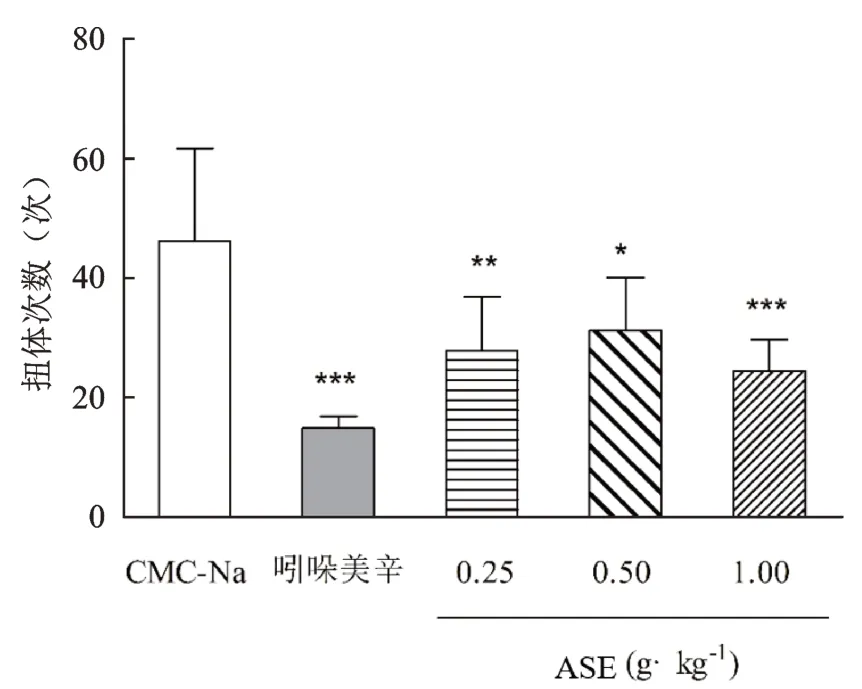
图2 不同给药组对醋酸致扭体次数的影响(-x±s,n=10)Fig.2 Influence of different administration groups on the number of acetic acid torsion(-x±s,n=10)
3.3 ASE对福尔马林致痛模型的影响
由表2、图3 可知,CMC-Na 组第Ⅰ、Ⅱ时相小鼠 的 舔 足 持 续 时 间 分 别 为(76.45±8.22)s 和(84.18±8.09)s,ASE 的中、高剂量组均可缩短福尔马林致疼痛反应的第Ⅰ、Ⅱ时相小鼠累积舔足时长(P<0.05),中剂量组两时相舔足持续时间分别为(41.81±2.45)s 和(56.82±5.50)s,其抑制率分别为45.31%和32.50%;高剂量组两时相舔足持续时间分别为(49.82±5.48)s 和(50.33±7.85)s,其抑制率分别为34.83%和40.21%。阳性药吲哚美辛仅在第Ⅱ时相对福尔马林致痛模型显示抑制作用(P<0.05),表明吲哚美辛仅对炎性致痛期有抑制作用。

表2 不同给药组对福尔马林致疼痛反应的影响(-x±s,n=10)Table2 Influence of different administration groups on pain response induced by formalin(-x±s,n=10)
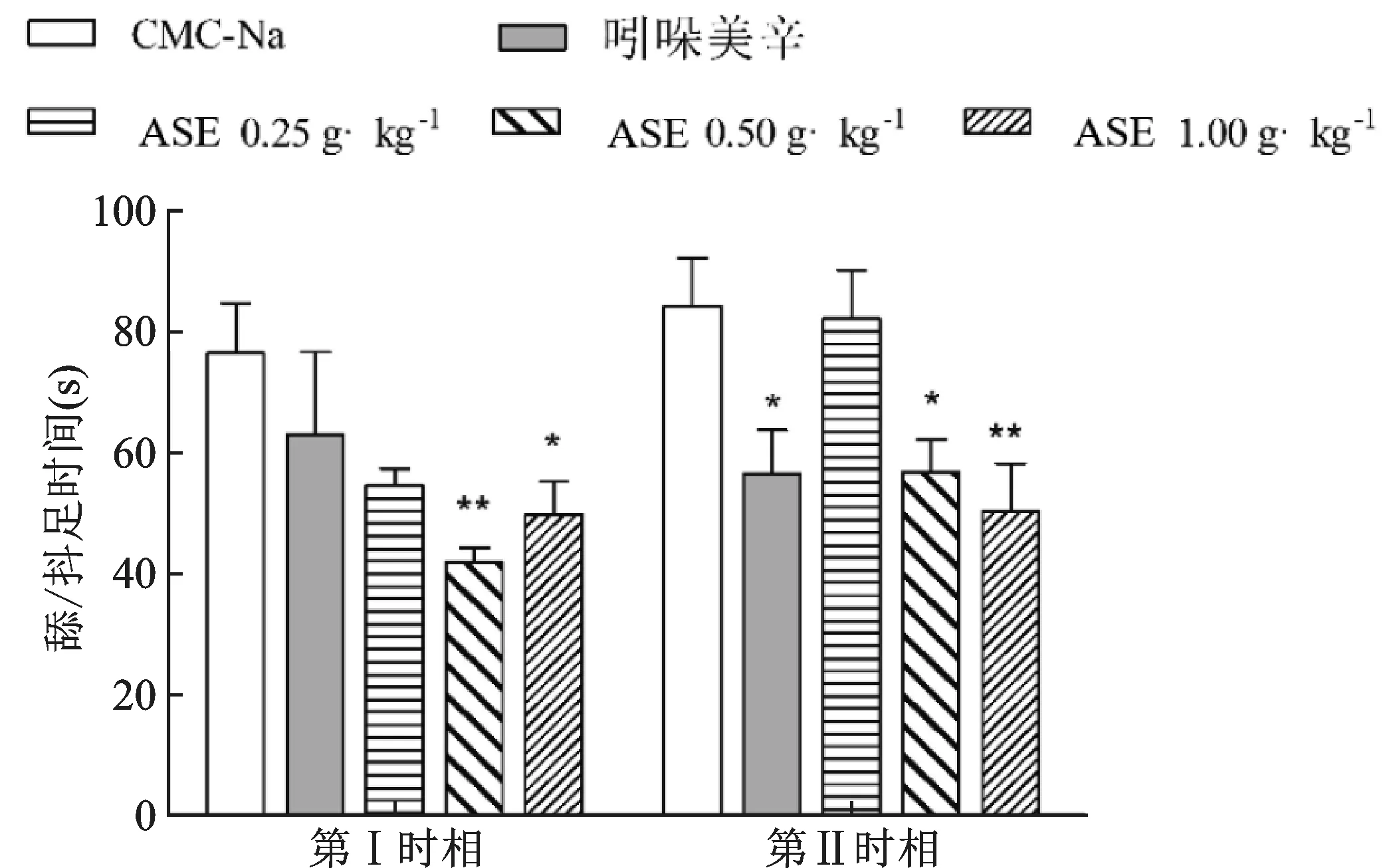
图3 不同给药组对福尔马林致疼痛反应的影响(-x±s,n=10)Fig.3 Effects of different administration groups on formalin-induced pain response(-x±s,n=10)
3.4 ASE对二甲苯致小鼠耳肿胀的影响
由图4可知,正常小鼠耳廓经二甲苯刺激后,明显肿胀,表明已造模成功。与模型组相比,ASE 中、高剂量组均可使耳肿胀度显著减小(P<0.001),表明其抗炎作用呈一定的剂量依赖性。

图4 不同给药组对二甲苯致耳肿胀的影响(-x±s,n=10)Fig.4 Influence of different administration groups on ear swelling induced by xylene(-x±s,n=10)
4 讨论
疼痛是一种由现存的或潜在的组织损伤所引发的机体心理和生理不舒适的感觉[17],常常会给患者身体和精神上带来巨大影响[18]。疼痛会导致患者生活质量低下及机体生理功能紊乱,也是对机体所处外界环境或机体不良状态时的自我保护反应。炎症是一种常见的组织器官的病理过程,是机体自身与致炎因子两者之间斗争的结果,炎症发生的同时也常常会伴随着发热、肿痛和疼痛等反应[19-20]。
骆驼刺作为维吾尔医与藏医传统医用民族药材,临床上主要用于治疗各种疼痛性疾病。据报道,骆驼刺中的主要成分为黄酮类化合物,其中包括异鼠李素、山奈素、芒柄花素、槲皮素等,是骆驼刺中主要发挥药效的物质。
课题组前期研究表明骆驼刺氯仿提取部位的抗炎镇痛活性最好,并利用UPLC-Q-TOF-MSE技术对ASE 进行了化合物成分,共解析出异鼠李素-3-O-芸香糖苷、异鼠李素等10 个化合物,发现ASE 中的主要成分为黄酮类化合物[21]。现代药理研究表明,槲皮素可促进促炎细胞因子(TNF-α、IL-1β、IL-6)的产生,显著提高TLR(Toll like receptor,TLR)信号负调节因子Toll 相互作用蛋白的表达,达到抗炎镇痛的疗效[22]。抗炎机制通路中,一氧化氮在炎症级联反应中起到关键的调节作用,黄酮类化合物可通过影响环磷酸鸟苷水平,抑制转录因子NF-κB(Nuclear factor kappa-B,NF-κB)的活化,影响多种炎症因子的表达,达到抑制诱导型一氧化氮合酶和一氧化氮产生的作用[23]。因此我们推测可能黄酮类化合物与镇痛抗炎作用有关。
因此,本试验通过建立了4 种经典疼痛及炎症动物模型来评价ASE 的镇痛抗炎作用。结果表明,骆驼刺氯仿部位提取物可以有效缓解二甲苯诱导的小鼠耳肿胀,具有显著抗炎作用;可以减轻醋酸诱导的小鼠扭体反应和福尔马林诱导骆驼刺氯仿部位提取物的镇痛效果。该结果充分证明了ASE具有良好的镇痛抗炎活性,为骆驼刺氯仿提取物开发为潜在的抗炎镇痛药物提供了理论基础。
