新生儿重症监护室金黄色葡萄球菌定植菌株的耐药性及生物膜形成能力研究
2022-04-20李文婷耿文静姚开虎周婧婧杨鑫孙静马香
李文婷 耿文静 姚开虎 周婧婧 杨鑫 孙静 马香,*
(1 山东大学齐鲁儿童医院,济南 250022;2 首都医科大学附属北京儿童医院,北京 100045)
金黄色葡萄球菌作为一种机会性致病菌,可以引发一系列社区和医院获得性感染,也可以在人体的皮肤和黏膜无症状定植,鼻前庭是最主要的定植部位[1]。通常情况下,金葡菌的定植者是无症状的健康状态,与细菌形成共生关系,但定植状态会增加感染的风险[2-3],报道显示60%~93%的金葡菌感染起源于内源性定植菌株[4]。主动筛查金葡菌定植状况并有针对的进行去定植治疗可以降低相关感染的发生率、死亡率和医疗成本。据了解,我国目前针对住院患儿金葡菌定植的主动监测及感染防控措施较少,且定植的相关研究主要关注MRSA[5],缺少MSSA的相关报道。前期本课题组已对北京儿童医院NICU患儿鼻部金葡菌定植菌株的基因型和毒力特征进行了研究及报道[6],发现ST59-IVa-t437和ST188-t189分别是MRSA、MSSA最常见的流行克隆,定植株的毒力基因携带率较高,为进一步了解我国NICU患儿的金葡菌定植菌株的耐药谱及生物膜形成能力,本研究对MRSA及MSSA进行药物敏感性实验及生物膜形成能力检测。
1 材料与方法
1.1 患者和鼻拭子标本
收集2015年5月20日—2016年3月20日北京儿童医院新生儿重症监护病房(NICU)住院的患儿病例,符合以下标准者纳入本次研究:①年龄:出生至生后28 d;②入院时间<24 h;③获得父母或法定监护人的知情同意。具有以下则排除:存在可能会影响采取鼻拭子的情况(例如:重度呼吸窘迫和其它临床医师认定的因素);父母或法定监护人不同意参加该调查。采集的鼻拭子标本暂时于-20℃低温贮藏,冷冻状态下转运至北京儿童医院微生物实验室进行细菌分离培养和鉴定。
1.2 金葡菌的培养、鉴定及基因分型
通过菌落形态学、凝固酶试验及nuc基因检测对菌落进行金葡菌鉴定,采用头孢西丁纸片(3Pg,Oxoid)法和mecA基因检测筛查MRSA。头孢西丁纸片法按照2014年美国临床实验室国家标准委员会(CLSI)标准判定[7],抑菌环直径≤21 mm为MRSA,≥22 mm为MSSA。前期实验对分离株进行了进行多位点序列、金葡菌蛋白A基因及agr分型,对MRSA进行葡萄球菌染色体盒及其亚型分型[6]。
1.3 抗生素敏感性检测
对头孢西丁纸片法筛选出的MSSA,根据2014年CLSI制定的标准[7]采用E-test法检测菌株对β-内酰胺类抗生素(青霉素、苯唑西林、头孢呋辛、头孢曲松)和非β-内酰胺类抗生素(利福平、复方磺胺甲恶唑、红霉素、莫匹罗星)共8种抗生素的最低抑菌浓度(MIC)值;MRSA菌株除上述8种抗生素外,增加对美罗培南、万古霉素、利奈唑胺、夫西地酸和替加环素的MIC检测。莫匹罗星、替加环素、夫西地酸的敏感性依照欧洲抗菌药物敏感性试验执行标准[8]界定。质控菌株为ATCC29213。根据所测菌的MIC,计算MIC50及MIC90。
1.4 结晶紫染色实验检测生物膜形成能力
生物膜定量检测参照结晶紫染色实验[9]。菌株在含0.25%葡萄糖的TSB液中37℃过夜培养,调整菌液浓度为McFarland等级0.5浓度(~1.5×108CFU/mL),并在含0.25%葡萄糖的TSB中稀释至最终浓度106CFU/mL。在无菌96孔细胞培养板中37℃培养48 h。弃去培养液并用0.9%氯化钠轻轻洗涤3次,并用甲醇固定15 min。风干后,将孔用0.1%结晶紫染色5 min,再用无菌PBS洗涤3次,自然风干,随后于33%冰乙酸中作用 30 min,590 nm条件下用酶标仪测定培养孔中溶液的吸光度值(A值),平行3个重复,计算其平均值。以未接种菌的培养液作为阴性对照,A值反映生物膜与接触表面黏附的牢固程度,依据临界Ac值(Ac是由空白孔的平均值加上其3倍的标准差),可将生物被膜分成以下4类:A≤Ac为不黏附(0),Ac<A≤2Ac为弱黏附(+),2Ac<A≤4Ac 为中等黏附(++),A>4Ac为强黏附(+++)。
1.5 统计学分析
应用WHONET 5.6软件录入数据并进行敏感性分析。采用SPSS19.0 软件进行统计分析。两组间中位数比较用秩和检验。率的比较用卡方检验或Fisher's确切概率分析。P<0.05 时,表示差异有统计学意义。
2 结果
2.1 金葡菌的培养与鉴定
536份鼻拭子标本共分离出金葡菌96株,NICU新生儿鼻前庭金葡菌的定植率为17.9%,其中 MRSA有28株(29.2%),MSSA 68株(70.8%)。MRSA均为mecA阳性,且头孢西丁抑菌环≤21 mm。
2.2 抗生素敏感性检测结果
2.2.1 MRSA与MSSA药敏结果
如表1所示,所有的MRSA菌株对青霉素耐药,对苯唑西林耐药率为57.1%,中介率28.6%,有4株(14.3%)为苯唑西林敏感甲氧西林耐药金葡菌(OS-MRSA)。对头孢曲松的耐药率为78.6%,中介率14.3%。MRSA对红霉素耐药率为92.9%,对夫西地酸耐药率3.6%,对其他抗菌药物包括庆大霉素、利福平、复方磺胺甲恶唑、莫匹罗星、左氧氟沙星、美罗培南、万古霉素、利奈唑胺及替加环素均敏感。在所有MSSA菌株中,对青霉素的耐药率为82.4%,对头孢曲松耐药率为8.8%,对红霉素耐药率47.1%,中介率27.9%,对庆大霉素的耐药率为16.2%,对其余抗菌药物包括苯唑西林、利福平、复方磺胺甲恶唑、莫匹罗星及左氧氟沙星均敏感。

表1 药物敏感性检测结果Tab.1 Antimicrobial susceptibility test results
MRSA与MSSA在9种抗菌药物不敏感率比较中,MRSA对苯唑西林、头孢曲松和红霉素的不敏感率显著高与MSSA,差异有统计学意义。
2.2.2 OS-MRSA药物敏感性
28株MRSA中检测出4株OS-MRSA,检出率为14.3%,4株均经菌落形态学、凝固酶试验及nuc基因验证确定为金葡菌,多重PCR验证均含有mecA基因,头孢西丁纸片法抑菌环直径均≤21 mm。在4株OS-MRSA中,ST59-IVa-t437(3/4)为最常见的流行克隆,另有一株ST22-V-t309。4株菌株对头孢西丁耐药,其抑菌环直径分别为16、17、16和18 mm,对苯唑西林均敏感,MIC值分别为1.5、1、2和2 mg/L。同时耐青霉素(MIC 4~>32 mg/L)和头孢曲松(MIC 6~>32 mg/L)。3株OS-MRSA对红霉素耐药,1株对红霉素中介(表2)。

表2 OS-MRSA分子特征与药物敏感性Tab.2 The molecular characteristics and antibiotic resistance of oxacillin-susceptible mecA-positive S.aureus
2.3 生物膜形成能力检测
2.3.1 MRSA与MSSA菌株生物膜形成能力的比较
根据结晶紫实验结果,96株金葡菌中有88株(91.7%)为生物膜阳性,8株(8.3%)为生物膜阴性。MRSA、MSSA 的生物膜阳性率分别为89.3%(25/28)、92.6%(63/68)。将 88株金黄色葡萄球菌形成生物被膜的能力分为强(+++)、中等(++)、弱 (+)三组,其中强产膜菌株、中产膜菌株和弱产膜菌株分别为有21株(23.9%)、 62株(70.5%)、5株(5.7%)。其中,25株生物膜阳性MRSA菌株中1株(3.6%)为强产膜菌株,24株(85.7%)为中产膜菌株。63株生物膜阳性的MSSA菌株中,强、中、弱产膜菌株分别5株(7.4%)、38株(55.9%)、20株(29.4%)。MRSA和MSSA在生物膜形成能力方面没有显著差异(P=0.66)(图1)。
2.3.2 不同ST型菌株生物膜形成能力的比较
25株生物膜阳性的MRSA菌株中,96%(24/25)的ST59菌株、95.8%(23/24)的SCCmec-IV菌株和90.5%(19/21)的spa-t437菌株能形成中等以上生物膜。不同基因型的联合分析表明,ST59-SCCmecIVt437克隆菌株中有83.8%(19/20)为中等以上生物膜形成菌。进一步比较不同ST型的生物膜形成能力,发现它们之间存在显著差异(P=0.0276)(表3),其中ST188与其他型别之间存在显著差异(P=0.0254),其余任两组之间没有显著差异(图2)。
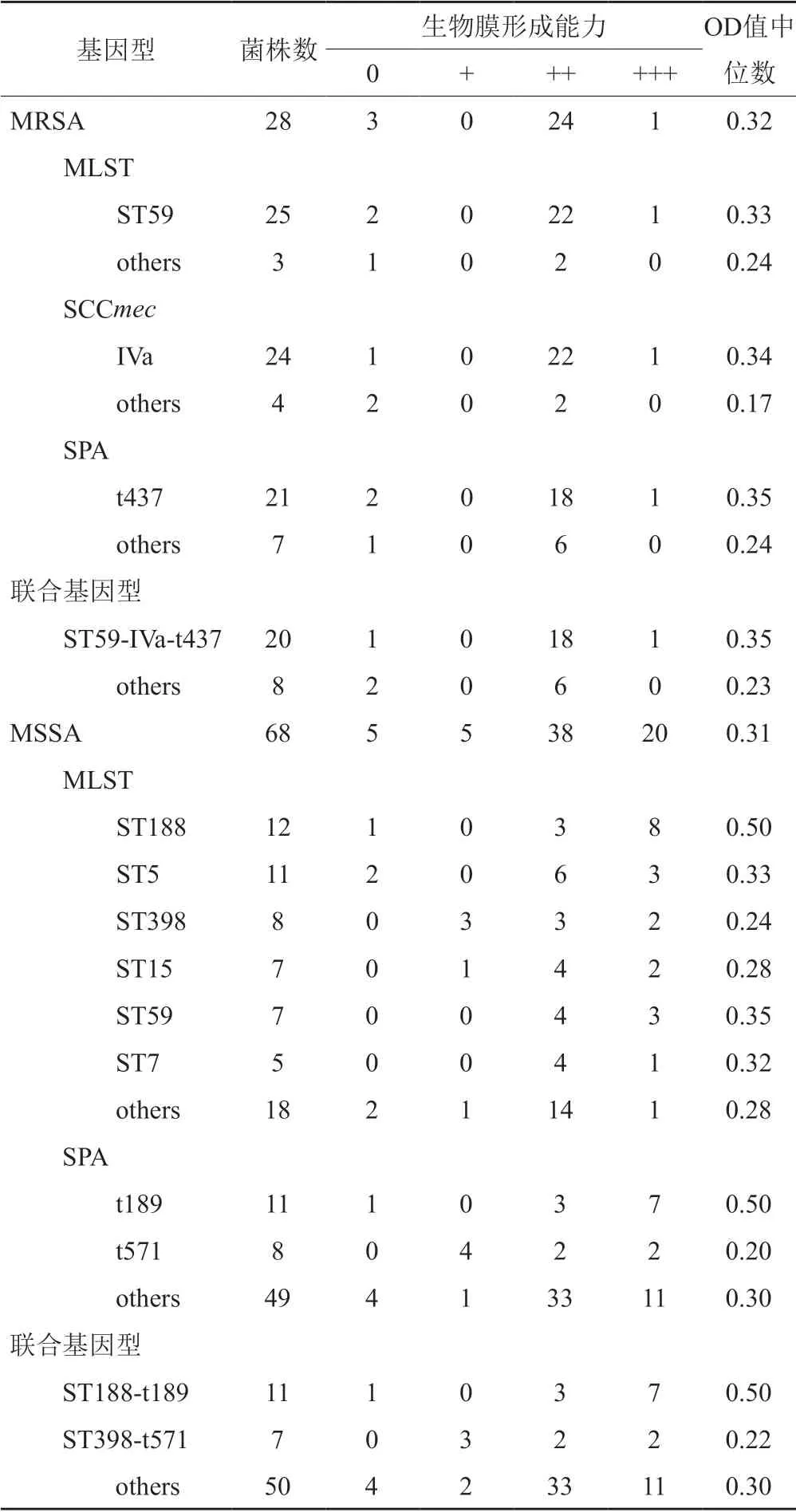
表3 生物膜形成能力Tab.3 The biofilm formation ability
2.3.3 产膜菌株与非产膜菌株的耐药率
对比产膜菌株与非产膜菌株的药敏情况,生物膜阳性菌株对青霉素、苯唑西林、庆大霉素、头孢曲松和红霉素的耐药率分别为87.5%、15.9%、12.5%、21.6%和60.2%。生物膜阴性菌株对青霉素、苯唑西林、头孢曲松、红霉素的耐药率分别为7.5%、25%、37.5%和62.5%,而对庆大霉素均敏感,但药敏差异不存在统计学意义(表4)。

表4 产膜菌株与非产膜菌株的药敏比较Tab.4 Comparison of the antimicrobial susceptibility between biofilm-forming and non-biofilm-forming isolates
3 讨论
MRSA所引发的感染可呈散发或暴发流行,常常治疗困难,且病死率较高,对MRSA的药物敏感性监测显得尤为重要。本研究药敏显示,除青霉素、苯唑西林、红霉素和头孢曲松外,MRSA对其他抗菌药物均保持敏感, 尤其是对庆大霉素、复方磺胺甲恶唑、利福平和左氧氟沙星的敏感性,显著高于儿童MRSA感染株的药敏报道[10],也高于同期国内其他MRSA药物敏感性的报道。蒋漓丽等[11]报道MRSA 对庆大霉素、左氧氟沙星耐药率均大于75% ,对复方磺胺甲恶唑稍敏感,耐药率仍达39.6%。吴宇等[12]报道MRSA除对青霉素、苯唑西林、红霉素耐药率较高外,对庆大霉素、左氧氟沙星耐药率也均高于80%。菌株来源、克隆群构成差异可能是产生不同研究结果的原因。2017年CHINET细菌耐药性监测报道[13],MSSA对青霉素、红霉素和庆大霉素的耐药率分别为89.9%、53.3%和11.9%。本研究中MSSA对青霉素、红霉素和庆大霉素的耐药率分别为82.4%、75%和16.2%,与同期国内情况基本一致。整体而言,相比儿童感染分离株,本研究中定植金葡菌尤其是MRSA,除对青霉素、红霉素及头孢类耐药仍较高,对其他抗生素敏感性较好,可能得益于近年来临床合理用药等措施。
近年来,很多国家或地区逐渐报告了OS-MRSA菌株,巴西[14]和印度[15]OS-MRSA的在金葡菌中的比例高达33.7%和14.68%。我国1项10个城市2068株金葡菌的筛查中,广州、武汉OS-MRSA检出率高达35%、18%[16],该报道中CC59-SCCmecV-t437是OSMRSA 的主要克隆型,本研究中4株OS-MRSA中3株为ST59-SCCmecIV-t437,但克隆的基因环境与OSMRSA的相关性仍有待进一步研究。
本研究金葡菌的生物膜阳性率高达91.7%,明显高于Neopane等[17]报道的69.8%及我国覃金球等[18]报道的51.72%。覃金球等[18]和Yang等[19]发现MRSA产膜能力强于MSSA,本研究及Naicker等[20]并未发现两者在产膜方面存在明显差异,但MRSA和MSSA的生物膜形成机制的确不同,MSSA菌株形成生物膜由细胞间多糖抗原介导,而MRSA菌株生物膜形成则与细胞外DNA、锚定蛋白等相关[21]。值得注意的是,OS-MRSA生物膜的形成机制与MRSA不同,且β-内酰胺类抗生素可诱导OSMRSA生物膜的形成[22],临床治疗时需予以重视。此外,Naicker等[20]发现MLST-CC5可能与高生物膜形成有关。本研究中,83.8%的ST59-SCCmecIVt437克隆株中有中等以上生物膜形成菌,ST188亦较其他型具有较强生物膜形成能力,优势克隆的强生物膜形成能力可能是其在我国流行广泛的部分原因。覃金球等[18]研究表明,产膜菌与非产膜菌比有更高的耐药率,本研究及Brahma等[15]研究并未发现生物膜形成能力与药物敏感性的关联,研究表明,生物膜是通过改变内部微环境、被膜菌的表型变异、基质屏障、主动外排系统以及群体感应系统等机制对抗药物的杀菌作用,因而体外实验存在较多局限性。
本研究提供了近一年的NICU金葡菌定植率及定植菌株的耐药性及生物膜形成能力,尚没有对定植患儿进行前瞻性观察,还不能回答定植者在后续住院过程中发生感染的概率及感染类型等情况,未来还需进一步开展研究,明确金葡菌定植与感染的相关关系,为制订临床干预措施提供参考,对预防和控制菌株播散或暴发等具有重要意义。
