清醒小鼠背侧耳蜗核单个神经元的细胞外记录技术
2022-04-19秦春晖汤正权
秦春晖, 汤正权
(安徽大学 生命科学学院, 合肥230601)
在体电生理记录技术,主要包括在体多通道电生理记录技术(multi-channelinvivorecording)、在体单细胞记录技术(single-unitinvivorecording)以及在体全细胞膜片钳记录技术(invivowhole-cell patch-clamp recording),被广泛应用于神经科学领域。多通道记录技术,是采用细胞外记录的方法检测一群神经元或者单个神经元的放电活动,具有记录的神经元数量多、可以在清醒自由活动的动物上进行记录、数周乃至数月长期记录等优点[1]。然而,多通道记录技术有个明显的缺点:多通道记录使用的是金属电极,对脑组织伤害程度大,不适合做深层脑区神经元放电活动的记录。在体全细胞膜片钳记录是指在清醒或麻醉动物上对其中枢神经元进行全细胞膜片钳记录的技术,常采用盲法记录或与双光子显微镜结合的可视法记录,此技术能对神经元离子通道和突触传递特性的研究提供更精确的手段,但其缺点是技术难度大,较适合皮层、嗅球浅层神经元记录[2]。
随着神经科学的发展,对深层脑区单个神经元放电活动的研究可以进一步揭示某一类的神经元在大脑中的信息编码功能和疾病发生机制[3]。因此,探索清醒动物深层脑区单个神经元的电生理活动记录具有重要的科学价值和应用前景。近年来,深层脑区结构和功能的研究受到广泛关注,但是对清醒动物深层脑区神经元放电活动的研究存在一定的难度。目前大多记录单细胞放电活动使用的都是金属电极,对脑组织都有一定程度的伤害[4-5],而使用玻璃微电极可以有效减少金属电极带来的伤害程度。因此,本研究采用玻璃微电极对清醒小鼠深层脑区背侧耳蜗核单个神经元的细胞外记录技术进行探索。
1 材料与方法
1.1 材料
1.1.1 实验动物
C57BL/6J SPF级小鼠(8~12周),购自庐江县白湖博源实验用品销售有限公司[SCXK(苏)2016-0010]和美国杰克森实验室(The Jackson Laboratory),用于在体电生理技术记录背侧耳蜗核主神经元。Ai32和GlyT2-Cre转基因小鼠购于美国Jackson Lab,转基因小鼠与野生型C57BL/6J小鼠交配,子代小鼠经PCR鉴定结果为阳性后进行饲养繁殖。GlyT2-Cre;Ai32由雄性Ai32小鼠和雌性GlyT2-Cre小鼠杂交产生。GlyT2-Cre;Ai32小鼠的抑制性中间神经元标记有绿色荧光蛋白用于离体脑片膜片钳记录背侧耳蜗核中间神经元[6]。实验动物饲养于安徽大学动物房和美国俄勒冈健康与科学大学动物房。所有动物程序均符合安徽大学动物伦理委员会的相关规定(2020-039)以及美国俄勒冈健康与科学大学动物伦理委员会的相关规定。
1.2 方法
1.2.1 手术操作和头部固定系统
通过腹腔注射戊巴比妥钠(40 mg/kg)使成年小鼠麻醉,等实验小鼠完全麻醉后,使用眼膏防止小鼠干眼症。将小鼠头部固定在立体定位仪上,利用剪刀剪去头部毛发并进行碘酒消毒。用手术刀片切开头皮暴露颅骨Bregma和Lambda,然后使用牙科水泥将一个金属杆(headpost)固定在颅骨前部正中位置上,并在前额骨下放置一个参考电极。使用立体定位仪定位右侧背侧耳蜗核的位置 (距离Bregma约5.9 mm ,距离Midline约2.3 mm)[7],在体视显微镜下用颅钻切除部分颅骨,行开颅手术做 1 cm2切口(craniotomy)暴露脑膜,并用骨蜡封住切口,并且在切口周围涂上三联抗生素软膏。最后缝合手术切口,将小鼠放回笼子恢复至少2 d。
1.2.2 在体细胞外记录
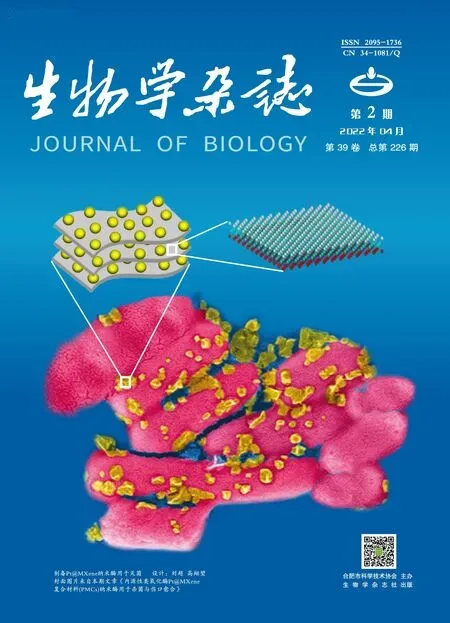
将小鼠身体放在一个可以自由转动的轮子上,并将其头部固定在一个金属架上,让小鼠在转轮上自由活动或跑动[图1(a)],熟悉并训练3 d后再进行声音刺激和在体细胞外电生理记录 (200B patch-clamp amplifier, MANTA neurophysiology data acquisition)。在记录的过程中,利用微操使玻璃微电极从小脑缓慢进入背侧耳蜗核的表层(molecular layer)、中间层(fusiform layer)和深层(deep layer),记录各层神经元对声音刺激的反应以及在静息状态下的自发放电活动[图4(a)]。通过自写的Matlab程序进行数据分析。
1.2.3 电极记录位置的验证
电生理记录结束后,通过玻璃电极,利用快速微离子(iontophoresis)导入荧光染料(Alexa 594)或者利用微量注射泵注入CTB488病毒来标记电极记录的位置。实验结束后处死实验动物并取出脑组织,检测Alexa 594荧光染料或者绿色荧光蛋白标记[图1(e)],确定记录的脑区是背侧耳蜗核。
(a)清醒小鼠细胞外记录模式图;(b)背侧耳蜗核矢状切片;(c)背侧耳蜗核冠状切片;(d)背侧耳蜗核神经环路(FC,fusiform cell;CWC,cartwheel cell;VC,vertical cell); (e)椭圆形虚线指示背侧耳蜗核边缘,白实线表示玻璃电极注入CTB488的位置。脑片厚度:100 μm。比例尺:200 μm。图1 在清醒状态下,C57BL/6J小鼠背侧耳蜗核神经元细胞外记录技术以及背侧耳蜗核的神经环路Figure 1 The extracellular recordings of principal neuron fusiformcell in awake mice
1.2.4 脑片膜片钳记录
将小鼠用戊巴比妥钠深度麻醉后,快速断头取脑,在冰冻(0 ℃)的人工脑脊液中取出组织,随后采用振动切片机(Leica VT1200 S)进行切片,得到脑切片后在ACSF中室温下孵育1 h,最后对背侧耳蜗核神经元进行全细胞膜片钳记录[8]。在电流钳模式下,记录背侧耳蜗核神经元的自发放电活动[图4(b)]。全细胞电流记录使用膜片钳放大器Axon 700B,Digidata 1440数模转换器,数据采集和分析用Clampex软件。
2 结果与分析
2.1 主神经元对声音的反应特性
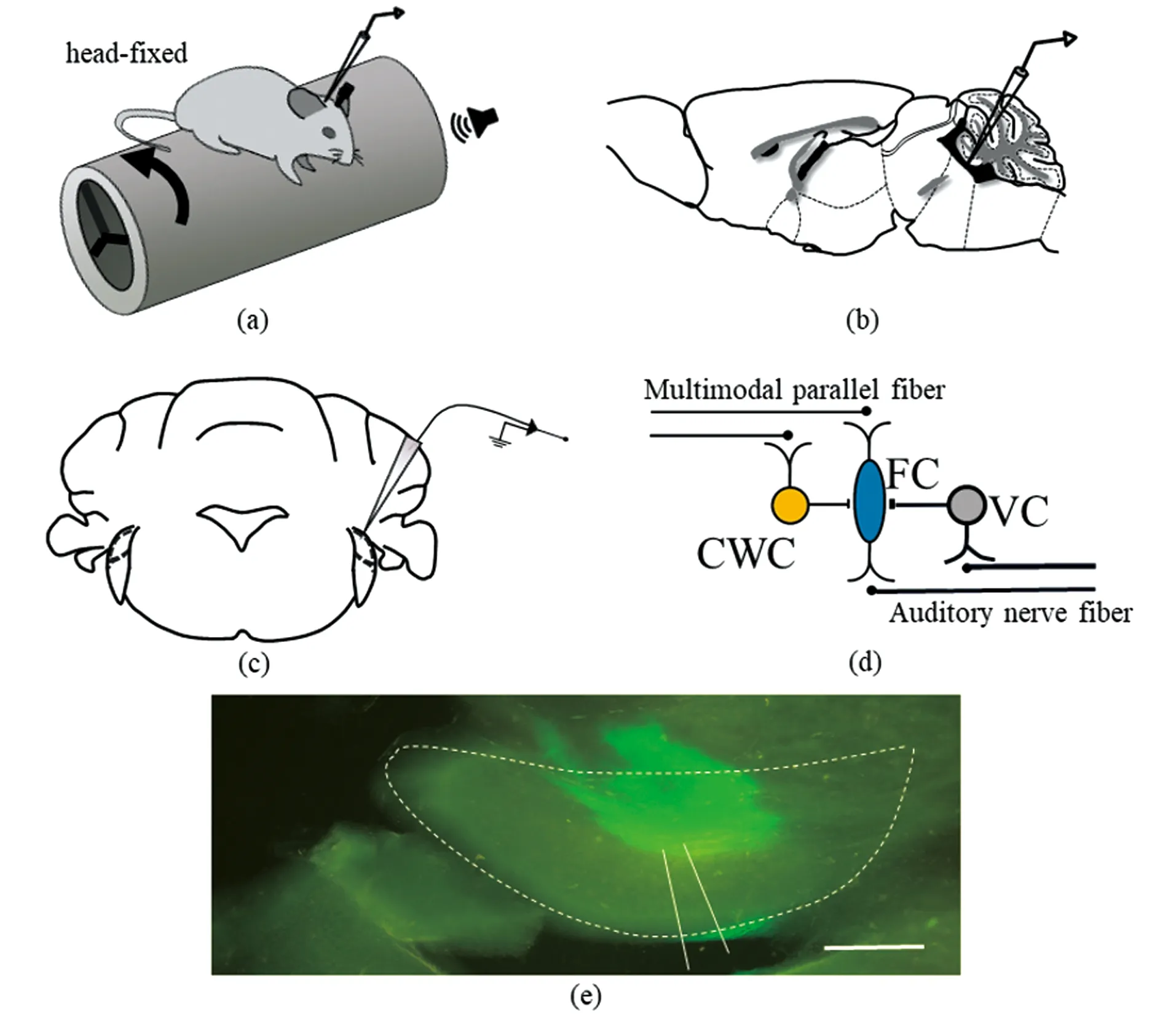
尽管背侧耳蜗核神经环路上约有10种细胞类型,但是之前的在体电生理记录结果表明背侧耳蜗核中只有主神经元梭形细胞(fusiform cell,FC)和抑制性中间神经元垂直细胞(vertical cell,VC)对声音有反应,且主神经元梭形细胞具有能进行自发放电活动、对声音刺激阈值较低以及对声音的反应调频曲线(frequency tuning curve,FTC)为“V”型等典型的电生理学特性[7]。在记录过程中,玻璃电极缓慢从小脑穿过,逐渐进入背侧耳蜗核,并且用声音刺激记录梭形细胞对声音刺激的反应[图1(b)和(d)]。并检测了梭形细胞对不同频率调制范围,声音诱导的反应调频曲线为“V”型[图2(b)和(c)] ,刺激时间直方图(peri-stimulus time histogram,PSTH)为 “建立型”(buildup)[图2(d)]。此外,我们检测了梭形细胞对雪貂(ferret)发出的4种声音反应 [图3(a)] ,神经元并不是对所有声音都有反应,而是选择性对其中的一种发声(vocalization)有反应[图3(b)] 。

(a)小鼠背侧耳蜗核单个神经元对声音刺激的反应;(b)单个神经元对20 dB 21 kHz声音诱导的反应;(c)频率调谐曲线(FTC);(d)刺激时间直方图 (PSTH)。图2 C57BL/6J小鼠主神经元梭形细胞的在体细胞外电生理记录Figure 2 The extracellular recordings of principal neuron fusiformcell in C57BL/6J mice
(a)雪貂发出4种声音的频谱图;(b)用扬声器播放雪貂发出4种声音,梭形细胞只对其中1种发声有反应。图3 C57BL/6J小鼠主神经元梭形细胞选择性对动物发声的反应Figure 3 Principal neuron fusiform cell responds to sound vocalizationsin C57BL/6J mice
2.2 在体和离体电生理记录的单个神经元的自发放电活动比较
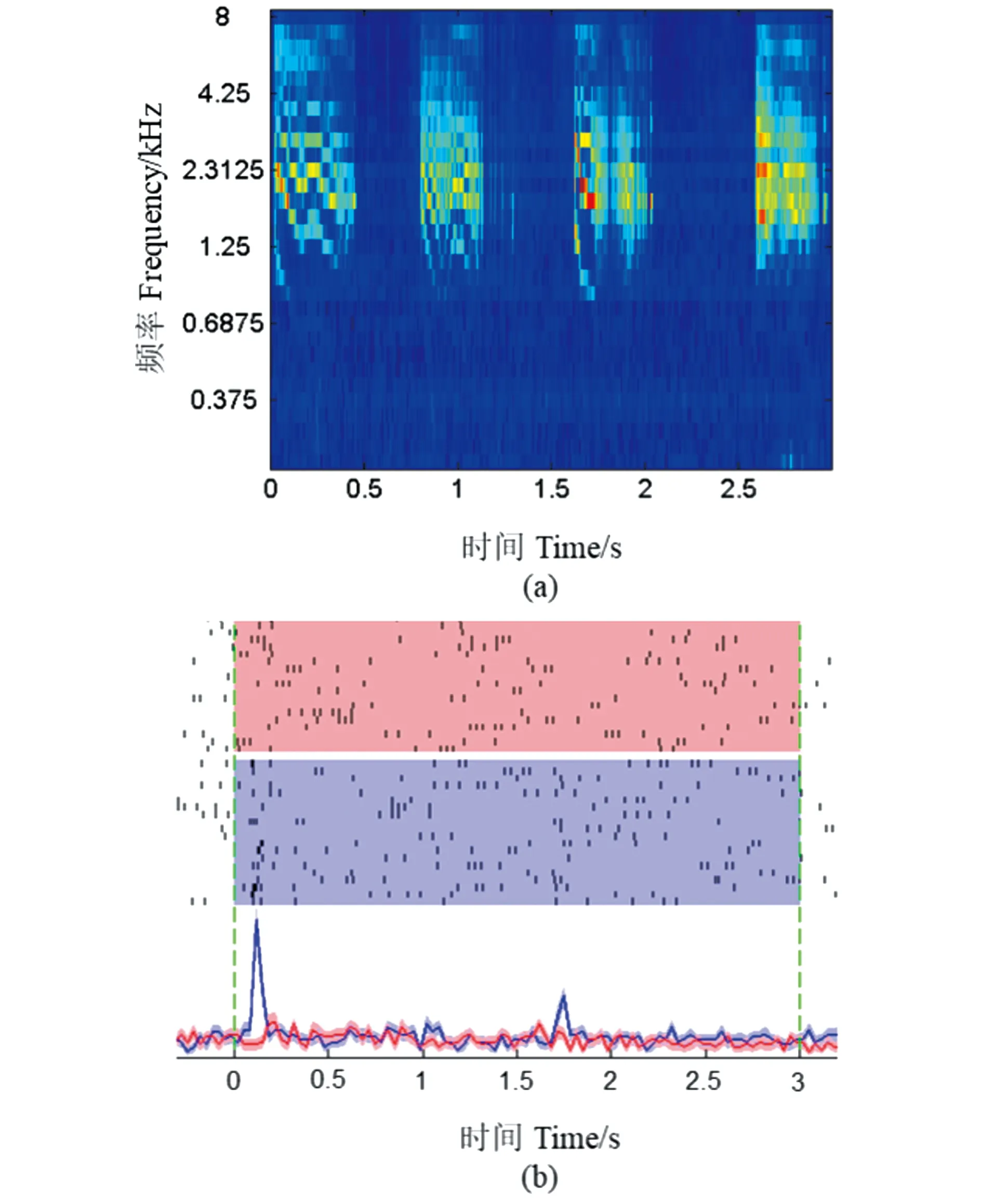
在脑片膜片钳实验中,GlyT2-Cre;Ai32小鼠的背侧耳蜗核脑片中抑制性中间神经元标记有绿色荧光蛋白,通过荧光显微镜可以鉴别出中间神经元[9]。主神经元梭形细胞位于中间层(fusiform layer),胞体形状为梭形,2个树突分别位于分子层(molecular layer)和深层结构(deep layer)中;在荧光显微镜下,通过玻璃电极内液中载有荧光染料显现梭形细胞的形态和位置[9],从而鉴别出梭形细胞。因此,在GlyT2-Cre;Ai32转基因小鼠背侧耳蜗核神经环路上,利用脑片膜片钳技术记录了3种类型的细胞自发放电活动,主神经元梭形细胞自发放电活动[图4(b)],中间神经元车轮细胞(cartwheel cell, CWC)自发放电活动非常活跃,主要呈现暴发性锋电位序列 (burst spike train);另一类中间神经元垂直细胞在静息状态下无自发放电活动(数据没有展现)。在体细胞外记录实验结果表明,主神经元梭形细胞具有自发放电活动[图4(a)],并对声音的刺激有反应,车轮细胞基本对听觉刺激不反应但是表现出暴发性锋电位序列 ,而垂直细胞对声音刺激有反应,但是没有自发性动作电位的发放。这些实验结果和之前的报道是一致的[8-9]。结果表明,利用玻璃微电极能鉴别出主神经元梭形细胞。
(a)在体细胞外记录梭形细胞的自发放电活动;(b)离体脑片电流钳模式下记录梭形细胞的自发放动作电位[9]。图4 GlyT2-Cre;Ai32转基因小鼠主神经元梭形细胞在静息状态下的自发放电活动Figure 4 Principal neuron firs a spontaneous spike activity at rest inGlyT2-Cre;Ai32 mice
3 讨论
采用玻璃微电极对单个神经元的细胞外记录技术,记录清醒小鼠背侧耳蜗核主神经元梭形细胞对声音刺激的反应以及其自发放电活动(图 1)。研究结果表明,梭形细胞对纯音刺激诱导反应的频率调谐曲线(FTC) 呈“V”型,刺激时间直方图(PSTH)为“建立型”(buildup),见图 2,并且对动物的发声有选择性反应(图 3)。为进一步验证在体单细胞记录技术能精确鉴定细胞的类型, 利用脑片膜片钳技术记录了GlyT2-Cre;Ai32转基因小鼠背侧耳蜗核上的3种主要细胞类型(梭形细胞、车轮细胞和垂直细胞)在静息状态下的自发放电活动。与脑片膜片钳技术记录结果一致,在体单细胞记录的主神经元梭形细胞在静息状态下自发放电活动(图 4),与中间神经元车轮细胞在静息电位下自发放电暴发性锋电位和垂直细胞在静息状态下无自发放电活动有明显的差别。因此,本研究结果初步表明此方法可以准确鉴定背侧耳蜗核神经元细胞类型。在未来的研究中,将结合形态学、免疫染色以及光遗传学等方法技术进一步验证神经元的细胞类型。
中枢神经系统中有数以万计的神经元,这些神经元在细胞形态、结构和功能上具有高度的多样性。不同种类的神经元的电生理特性差别很大[10]。例如,听觉中枢背侧耳蜗核——一个很小的脑区(直径为5 mm)就存在多种不同的神经元类型,包括主神经元梭形细胞、中间神经元车轮细胞和垂直细胞等[9]。目前,研究表明听觉中枢背侧耳蜗核在声源定位和消除动物自身活动产生噪音方面起了重要的作用[11]。随着神经科学的发展,单一类的神经元在脑疾病的发病机制中的作用越来越受到关注。例如:多巴胺细胞功能紊乱与帕金森疾病发生相关[12];一些离体电生理和行为学实验研究表明背侧耳蜗核梭形细胞或者车轮细胞的兴奋性升高会导致耳鸣的发生[13-14]。因此,对背侧耳蜗各类神经元的电生理功能进行分析,在临床预防治疗耳鸣上具有重要的科学价值和意义。
虽然早期的研究已经对小鼠的背侧耳蜗核神经元进行记录,但是利用麻醉动物或者固定小鼠的身体会导致小鼠急性的应急反应(stressful)甚至抑郁发生[7,15-16]。我们采用固定小鼠的头部,但小鼠的身体可以自由活动的方法,让小鼠可以在转盘上跑步,相对不会导致小鼠过度的应急反应。利用玻璃微电极能够记录到信噪比很好的单细胞自发放电活动和对不同声音的反应。因此,此技术可以应用到深层脑区单个神经元的生理功能以及疾病相关的研究中。我们记录到的梭形细胞对声音的反应特性,和以前在豚鼠小鼠报道中主要采用金属电极记录取得的结果是一致的,在静息电位下表现出自发放电活动,对声音的调频曲线为“V”字形状[7,15-17]。此外,早期研究表明背侧耳蜗核神经元对动物发声有反应[15],也可以抑制动物自身活动产生的噪音[11]。的确,我们的研究也表明主神经元梭形细胞对动物发声有选择性反应。
现有在体电生理记录方法大多是使用金属电极对浅层脑区神经元进行记录,但利用玻璃微电极对深层脑区的神经元记录少有报道。本研究采用玻璃微电极和头部固定系统对清醒小鼠背侧耳蜗核的主神经元作急性细胞外电信号记录,并且能准确鉴定主神经元梭形细胞。最后,利用声音刺激确定所记录的神经元定位在听觉核团。研究结果初步提示了在体电生理记录技术能够被应用于清醒动物深层脑区神经元类型的鉴定。与大多数金属电极记录方法相比,此方法具有准确性高和对组织伤害性小的特点,为深入研究深层脑区的功能提供了有效手段 。
致谢:感谢美国俄勒冈健康与科学大学Vollum 研究所 Laurence O Trussell教授提供转基因小鼠、仪器等支持和技术指导。