新食品原料—阿拉伯半乳聚糖的资源分布、结构及生物活性研究进展
2022-04-19刘文丛张君婕
张 帅,刘文丛,王 梓,张君婕,李 伟
(吉林农业大学中药材学院,吉林 长春 130118)
阿拉伯半乳聚糖(Arabinogalactan,AG)是一种由阿拉伯糖和半乳糖组成的中性多糖,主要包括以β-D-(1→4)-半乳糖为主链的Ⅰ型、以β-D-(1→3)或(1→6)-半乳糖为主链的Ⅱ型和以各种单糖为主链的Ⅲ型。2002年6月,美国FDA批准AG为食品添加剂[1]。通过大鼠的急性毒性试验、遗传毒性试验,进行系统的毒理学评价,AG表现出良好的安全性[2]。鉴于其安全和有益作用,我国于2014年把AG列为新食品原料。此外,作为天然来源的植物多糖,AG的广泛生物学活性被陆续发现。本文主要对AG的资源分布、结构和生物活性展开综述。
1 阿拉伯半乳聚糖的资源分布
AG是一种高分支、高分子量的中性多糖[3],主要由阿拉伯糖和半乳糖组成,比例一般在1:5左右。AG的分布广泛,常见于植物和一些微生物中。在一些食物中含有AG,如柿子[4]、香蕉[5]、马铃薯[6]、苹果[7]、无花果[8]等;在中药材中也含有AG,如苦荬菜[9]、金鸡菊[10]、珠子草[11]、徐长卿[12]、当归[13]等;在微生物的体内,也发现了AG的身影。在分枝杆菌体内,AG与长链脂肪酸、霉菌酸通过酯键共价结合[14]。
目前研究表明,落叶松中AG的含量最为丰富,含量可达到30%左右,主要存在于心材的细胞腔内,少量存在于射线细胞与树脂道周围的泌脂细胞中[15]。我国东北地区的长白山脉和大兴安岭地区是落叶松的重要产区[16],提供着充足的原材料。二氢槲皮素是自然界中一种重要的黄酮类化合物,在肿瘤疾病的治疗以及心脑血管病的防治中有着重要的应用[17]。目前,二氢槲皮素的生物来源主要是落叶松,其含量在1%左右[18]。AG作为二氢槲皮素生产中的副产物,AG的深入研究,也能够使落叶松的资源得到充分的利用。
2 阿拉伯半乳聚糖的结构
多糖在生物化学和药理学领域受到广泛的关注。多糖的生物活性在不同程度上与多糖的分子量、分支和链构象密切相关[19]。因此,多糖的结构解析成为了研究多糖生物活性的重要环节。
国内学者对AG的结构研究较晚,大部分研究集中于AG的提取工艺优化[20]。对其结构的分析主要从分子量测定、单糖组成分析、Smith降解、官能团检测、甲基化分析以及核磁检测几方面进行[21]。孙启立等[22]从党参根中分离纯化得到AG,由交替的[(1→4)-]、[(1→6)-]或[(1→3)-]连接的吡喃型半乳糖(Galp)组成,在[(1→6)-]连接的Galp有少量的分支,呋喃型阿拉伯糖(Araf)残基通过末端的O-6位置与之连接。何涛斌等[23]从辣木叶中分离得到一种新型的AG,主链为[→1)-β-DGalp-(3,4→],分支由[→1)-β-D-Galp-(4→],[→1)-α-D-Galp-(2→],[Araf-(1→]和[Galp-(1→]组成。姚艳丽等[24]用热水从红花中提取得到AG,其主链通过[(1→6)-]连接的Galp的C-3位置与分支连接,分支主要由[(1→5)-]连接的Araf残基组成。
国外学者对AG的结构研究较早。在1960年,Adams等[25]就从枫叶中得到AG,并对其结构进行检测,发现其主要由[(2,3,5)-3-O-Araf]、[(2,4,6)-3-O-Galp]和[(2,4)-2-O-Galp]组成。Ra⁃khmanberdyeva等[26]从阿魏科植物中提取得到的AG,由[(1→6)-β-Galf]残基组成。AG的C3位置连接[α-Araf]、[(1→5)-]连接的低聚糖以及[β-DGlcpA-4-O-Me-(1→6)-β-Galp-(1→]片段。主链的一小部分在C-2位置连接[β-Galp-(1→]。Ketha等[27]从绿豆中分离得到的II型AG,由阿拉伯糖和半乳糖以1:2的比例组成,分子量为1200 kDa。以[1,3-β-D-Galp]为主链,O-6上有(1→5)连接的Araf醛基侧链,这些侧链进一步被Araf醛基残基取代,形成高度支链化结构。Galp残基以非还原末端的形式存在。
根据国内外关于AG结构的检测结果分析,主要将其划分为三类[28]。韩雨露等[29]从仙人掌果皮中提取得到的AG为AG-Ⅰ型。它是以1,4-β-半乳聚糖为主链,C3或C6位可能被[(1→5)-Araf]、糖醛酸或一些单糖取代。水飞蓟[30]和落叶松[31]中的AG主要为AG-Ⅱ型,它是以(1→3/6)-β半乳聚糖为主链,支链为[(1→3/5)-α-Araf],如图1所示。AG-Ⅱ型的结构因来源植物、组织和年限的不同而不同。AG-Ⅲ型是以各种单糖为主链,伴随有AG的支链,其结构较复杂,且在植物中含量很少。Aspi⁃nall等[32]在阔叶榆果胶中发现了它的存在。
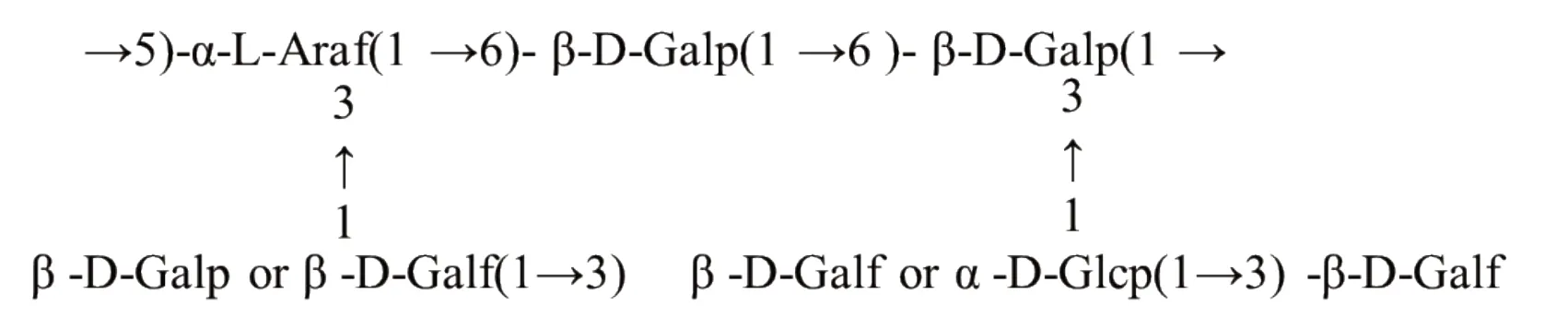
图1 落叶松中AG-Ⅱ型AGFig.1 AG-Ⅱarabinogalactan in Larix gmelinii(Rupr.)Kuzen.
3 阿拉伯半乳聚糖的生物活性
随着“大分子时代”的来临,人们对AG的研究逐渐深入。根据研究发现,AG具有良好的生物学活性[33],汇总如表1所示。
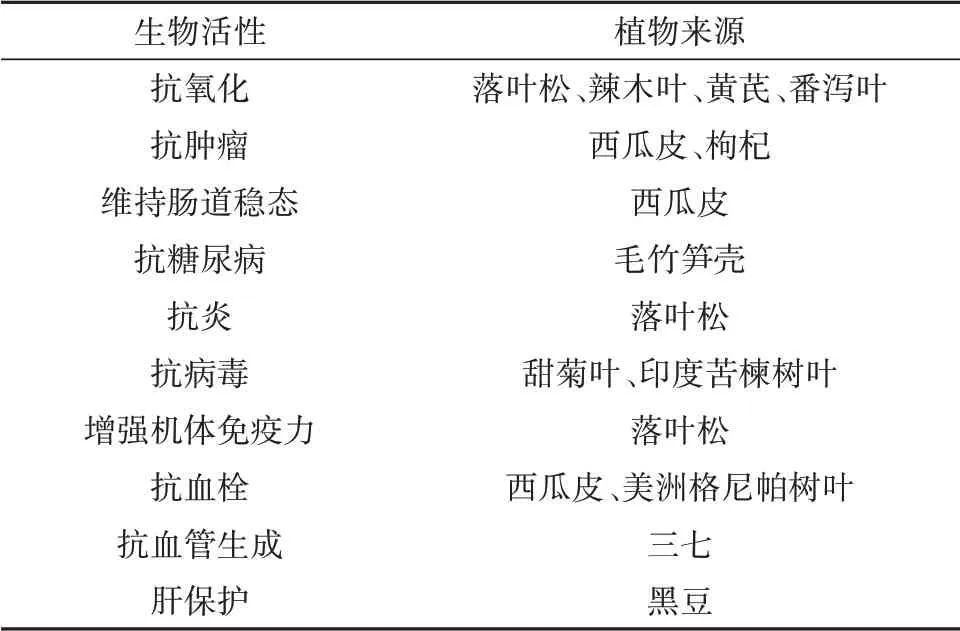
表1 AG的生物活性汇总Tab.1 Summary of AG's biological activity
3.1 抗氧化
郭怡帆[34]等通过比较超声降解前后落叶松中AG的抗氧化活性,虽然AG的羟自由基清除能力和DPPH自由基清除能力都低于Vc,但是同样表现出了良好的抗氧化能力,并且超声降解后AG的抗氧化能力得到进一步的提升。何涛斌等[23]通过测定辣木叶中AG的DPPH自由基清除能力、ABTS自由基阳离子清除能力和铁还原抗氧化能力,表明其具有良好的体外抗氧化能力。刘再志等[35]从提取二氢槲皮素的黄芪残渣中分离得到AG,其具有良好的羟自由基清除能力、铁还原能力。Sinha等[36]从番泻叶中提取的AG,其具有良好的铁还原抗氧化能力和DPPH自由基清除能力。表明AG在体外抗氧化方面具有良好的活性。
3.2 抗肿瘤
AG在抗肿瘤方面也展示出很大的潜力。从西瓜皮中分离得到AG[37],作用于HepG2细胞,当其浓度在2.5~10µg·mL-1时,AG对HepG-2细胞的增殖显示出明显的抑制作用,且呈剂量依赖性。AG可以通过作用于免疫系统,从而阻断癌细胞向肝脏的转移。由于肿瘤细胞在肝中对凝聚素载体的特异性,使其向肝脏转移更为普遍。AG能够通过抑制凝集素载体位点的活性,部分阻断癌细胞DNA在肝脏的复制情况,从而提高受试者的生存时间。Nergard等[38]通过一项间接体内研究发现,AG可以利用细胞因子网络,提高自然杀伤细胞抑制肿瘤扩散的能力。AG通过阻滞细胞周期和凋亡抑制癌细胞生长[39]。从枸杞中提取的AG,作用于SMMC-7721和HepG-2肝癌细胞、HeLa宫颈癌细胞、SGC-7901胃癌细胞以及MCF-7人乳腺癌细胞,发现AG能使细胞周期阻滞在G0/G1期,改变线粒体功能,激活氧化应激,调控MAPK信号通路诱导细胞凋亡。因此,AG可能是一种潜在的对体外正常细胞无毒性的预防癌症的药物成分。
3.3 维持肠道稳态
低至5 mmol的氨能够诱导结肠上皮细胞产生病变[40]。在服用AG后,会使粪便中氨浓度降低,对结肠上皮细胞起到保护作用。AG可通过促进肠道内微生物菌群的发酵[38],提高短链脂肪酸的含量。调节宿主体内肠道微生物的结构,使体液和电解质之间保持平衡[37],从而为肠道细胞输送营养,保护肠道黏膜细胞。Ramona等[41]将20位受试者分成两组,进行为期三周的饮食治疗,每天按剂量15 g和30 g服用AG,测定其对胃肠道和血液参数的影响。结果表明,添加AG的日粮与基础日粮相比,增加了厌氧菌和乳酸菌的密度,降低了胆固醇水平,维持和恢复了肠道平衡。证明AG在维持肠道稳态方面发挥着重要作用。
3.4 抗糖尿病
AG可以通过抑制α-葡萄糖苷酶活性、改善糖耐量和减少晚期糖基化终产物(AGEs)的积累[42],从而对由高血糖引发的骨质疏松症起到保护作用。刘焕言等[43]从毛竹笋壳中分离得到AG,采用体外Caco-2单层细胞模型来评价AG的降血糖活性。结果表明,对照组与AG给药组总体上存在差异,说明一定浓度的AG溶液能显著抑制不同浓度葡萄糖的吸收,且呈时间依赖性。上述研究表明AG可作为一种潜在的天然降糖剂而被开发利用。
3.5 抗炎
AG因其能增强对巨噬细胞的损伤、抑制促炎因子的活性[44],受到了广泛的关注。程俊文等[45]从落叶松粉末中提取得到AG,将其作用于脂多糖(LPS)刺激的巨噬细胞RAW264.7,孵育24 h后,检测TNF-α、IL-6和IL-1β水平。结果显示,AG能促进促炎细胞因子的分泌,具有很强的免疫调节活性。Tabarsa等[46]从分子水平探讨AG对巨噬细胞RAW264.7的作用,上调了包括TNF-α、IL-1β、IL-6和IL-12在内的促炎细胞因子的mRNA表达。通过Western blot分析,AG诱导的巨噬细胞RAW264.7中p-NF-κB,p-JNK、p-ERK和p-p38蛋白水平表达升高。表明AG主要通过MAPK和NF-κB信号通路减缓LPS对巨噬细胞RAW264.7产生的刺激。
3.6 抗病毒
De等[47]从甜菊叶中提取AG,发现AG的粗提物、碱性提物和均相提物都具有体外抗单纯疱疹病毒1型(HSV-1)的活性。Saha等[48]从印度苦楝树的叶子中提取得到AG,进行了低水平的细胞毒性分析,显示出对牛疱疹病毒1型(BoHV-1)的抑制作用。
3.7 增强机体免疫力
在一项临床试验中,落叶松中提取的AG能够提高机体免疫力而抵御普通感冒感染的能力[49]。在细胞和动物模型中,落叶松AG能够增强自然杀伤(NK)细胞和巨噬细胞以及促炎细胞因子的分泌[44]。AG能够刺激自然杀伤细胞的细胞毒性,增强免疫系统的其他功能,并抑制肿瘤细胞向肝脏的转移[50]。因此,AG在增强机体免疫力方面发挥着积极作用。
3.8 抗血栓
临床上,用落叶松中提取的AG清洗从血浆中分离出的血小板,经过清洗后的血小板,可用于临床输血。经过这种方法洗涤后的血小板,不仅能够去除血浆蛋白,还能够保持其正常的形态和功能[37],这对于临床应用具有巨大意义。从美洲格尼帕树叶中提取的AG[51],可以延长凝血时间,抑制静脉血栓的形成和增加出血时间。因此,AG有望成为抗血小板聚集、抗凝、抗血栓和降低出血性的治疗药物。
3.9 抗血管生成
王佩佩等[52]从三七中分离得到AG,通过抗血管生成实验表明,AG能降低内皮细胞在基质上的迁移活性和成管能力,但对内皮细胞的生长无影响。进一步研究发现AG可以通过BMP2信号通路发挥抗血管生成的作用。
3.10 肝保护
孙健等[53]首次研究了从黑豆中提取的AG,作用于CCl4致小鼠急性肝损伤的模型。AG不仅显著提高了超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶和谷胱甘肽还原酶等抗氧化酶的水平,而且升高了肝组织非酶抗氧化水平。
4 研究展望
现在,“大分子时代”已经来临,更多的目光都聚焦于大分子物质。AG因其具有抗氧化、抗肿瘤、维持肠道稳态等多种生物活性,在医疗领域具有良好的发展前景。随着国内外学者的不断深入研究,其药用价值和作用机制逐渐被人们了解,吸引了更多人关注。
顺铂(Cisplatin,CP)[54]作为临床中治疗多种癌症的首选化疗药物,其伴随而来的急性或延迟性胃肠道副作用却无法被忽视。本课题组前期已经证明,AG通过减弱肠道组织中氧化应激与细胞凋亡来改善CP诱导的肠道粘膜损伤,并首次发现一种新途径——内质网应激,参与AG的保护机制中。经过不同浓度的AG处理后,IEC-6细胞可显著减少CP诱导后细胞内活性氧(ROS)的产生。通过Hoechst 33258染色证明了AG可以抑制CP诱导的肠道细胞凋亡。通过western blot定量分析得到,CP处理后IRE1α、CHOP、BiP和XBP1(s)四种蛋白的水平均有不同程度的升高,且都能够被AG剂量依赖性的降低。证实了内质网应激(ERS)在CP诱导的肠道细胞凋亡中的重要作用。采用4-苯基丁酸钠盐(4-PBA)反向验证,通过western blot定量分析证实在CP处理期间,4-PBA的使用显著降低了肠道细胞中ERS关键蛋白的表达,同时抑制了caspase-3的激活。充分说明AG通过抑制ERS信号通路的过度激活,降低细胞凋亡的发生。
AG来源广泛,不仅原材料的价格便宜,而且资源得到了充分的应用。其次,AG提取工艺简单,适宜工厂的生产,具有巨大的市场前景。因此,作为新食品原料,AG在医疗卫生和食品行业具有巨大的发展潜能。
