类风湿关节炎继发骨质疏松症临床防治药物研究进展
2022-04-19徐子涵商玮赵智明陆乐沈俊逸蔡辉
徐子涵 商玮 赵智明 陆乐 沈俊逸 蔡辉*
1.南京中医药大学第一临床医学院,江苏 南京 210002 2.东部战区总医院(原南京军区南京总医院)中西医结合科,江苏 南京 210002
类风湿关节炎(rheumatoid arthritis,RA)以滑膜对称性浸润、关节软骨和骨质侵犯为特征,多伴有局部和全身性骨量丢失。骨质疏松症是 RA最常见的合并症之一。一项韩国的流行病学研究显示,近50 %患RA的绝经后女性患有骨质疏松症[1]。而韩国50岁以上的成年人中,骨质疏松症的患病率在女性中为35.5 %,在男性中为7.5 %[2]。全身性炎症状态、抗瓜氨酸化蛋白抗体的存在、糖皮质激素的使用、活动受限等因素的综合作用导致了RA全身性的骨质丢失。即使采用骨质疏松症初级预防策略,例如通过适当的钙剂和维生素D膳食补充及体育锻炼,大多数RA患者在疾病发展过程中仍会发生骨质疏松。
近年来,新型药物的研发日益深入,为RA骨质疏松的治疗提供新的选择。基于目前国内外尚无RA继发骨质疏松症相关诊疗指南,在此,我们通过计算机检索PubMed、CNKI数据库,搜集关于RA继发骨质疏松症治疗药物的文献,以“类风湿关节炎、骨质疏松症、治疗药物、诊疗进展、临床研究”为关键词进行检索,检索时限从2000年1月至2020年12月,从改变病情抗风湿药(disease-modifying antirheumatic drugs,DMARDs)对骨骼健康的影响和RA继发骨质疏松的防治药物的角度,对相关临床研究进展作一综述,以供参考。
1 DMARDS对骨骼健康的影响
RA的病程与局部和全身性骨量丢失的程度之间存在明显的正相关关系,也就是说,疾病的活动、病情的反复与骨量丢失有关。因此,使用DMARDs治疗非常重要,不仅是为了控制疾病的活动,而且为了限制普遍的骨质流失。
1.1 传统合成DMARDs(csDMARDs)
常规的csDMARDs如甲氨蝶呤(methotrexate,MTX)、来氟米特(leflunomide,LEF)、羟氯喹(hydroxychloroquine,HCQ)、柳氮磺胺吡啶(salicylazosulfapyridine,SASP)等,是风湿科医生在RA治疗中的标准药物。这些药物会降低RA的疾病活动度,从而减慢关节损伤的进展。
早期的研究表明,MTX是不利于骨骼健康的,并有病例报道称长期低剂量MTX治疗导致成人脆性骨折增加以及高剂量MTX导致儿童骨形成受损[3]。因为该药可能会损害成骨细胞的增殖和活性,以及抑制原始骨髓基质细胞增殖[4]。这可能导致患者自发性应力性骨折,这种情况被称为“MTX骨病”,主要发生在血液病患者,其使用剂量远高于用于治疗RA的剂量。对于MTX与RA、骨质疏松之间的联系,仅存在少量研究结果显示,使用MTX治疗对女性RA患者骨密度(bone mineral density,BMD)没有显著影响。
Kwon等[5]研究显示LEF与腰椎BMD的增加显著相关[OR3.000,95 %CI(1.177~7.645),P=0.021]。LEF最初是通过其代谢产物抑制炎症,从而减轻骨侵蚀。LEF本身还诱导AHR-ARNT相互作用,抑制模型大鼠肝脏C反应蛋白的产生,减轻骨侵蚀[6]。然而,一些学者认为csDMARDs能干扰关节炎发生的过程,但不能充分治疗骨侵蚀和骨质疏松症[7]。
1.2 生物制剂DMARDs(bDMARDs)
针对肿瘤坏死因子(tumor necrosis factor,TNF)的生物制剂在RA治疗中引入较早,可迅速使急性期RA病情得到缓解。一些研究表明抗TNF治疗对RA患者的BMD和骨转换有改善作用。最早报道英夫利昔单抗治疗RA患者对骨代谢有益,后有研究观察到腰椎和髋部BMD的保持或改善,以及骨吸收标志物的减少和骨形成标志物的增加[8]。其他TNF抑制剂如依那西普和阿达木单抗对BMD产生了相似的作用[9],但缺乏骨折风险的数据。
其他bDMARDS关于RA患者 BMD和骨折率的相关数据较少。有研究显示使用阿巴西普和利妥昔单抗的RA患者发生骨折的风险与接受TNF抑制剂治疗者相似[10]。阿巴西普[11]、托珠单抗[12]与RA患者股骨颈 BMD 增加相关,而在利妥昔单抗治疗的患者中腰椎BMD无显著变化,髋部BMD下降[13]。
1.3 靶向合成DMARDs(tsDMARDs)
Janus激酶(JAK)介导的细胞因子信号传导已成为治疗诸如RA等炎症疾病的重要治疗靶标。因此,JAK抑制剂构成了新的一类药物,其中托法替布和巴瑞替布已被批准用于RA的治疗。最新的一项关于JAK抑制剂对骨稳态的研究,显示JAK抑制剂增加模型小鼠骨量,并增强成骨细胞功能,对破骨细胞无直接影响。这一结果支持了JAK抑制剂可诱导骨合成代谢作用,对关节炎所致骨侵蚀有修复作用[14]。
2 RA继发骨质疏松症的防治药物
在RA的治疗中,尽管bDMARDs可以减少RA炎症所致的关节破坏,但是,bDMARDs不能预防RA或糖皮质激素治疗引起的骨质疏松症的进展,并且药物的成本和对安全性的因素限制了bDMARDs的使用率,因此,考虑到RA患者的高风险,应配合使用防治骨质疏松症的药物。
2.1 钙剂和维生素D
钙和维生素D的补充显得尤为重要。在2017美国风湿病学会预防和治疗糖皮质激素性骨质疏松(ghcocorticoid-induced osteoporosis,GIOP)指南中,建议所有患者补充钙(800~1 000 mg/d)和维生素D(600~800 IU/d)以及改变生活方式[15]。不建议补充高剂量钙,其原因在于高钙摄入与心血管事件之间的关联仍存在争议[16]。这在RA治疗中需特别关注,因为 RA本身与罹患心血管疾病的风险增加有关。维生素D具有广泛的免疫活性,一些证据表明它可能与RA的发病机理有关。维生素D摄入缺乏与RA风险增加和疾病活动性增加有关[17]。目前一些证据表明,在RA中常规使用维生素D补充剂,有益于RA疾病的治疗[18]。
2.2 双膦酸盐类
双膦酸盐抑制骨吸收的作用已被证实,对高转换骨质疏松症的治疗效果可以肯定。注射用双膦酸盐用于治疗各种骨病时,偶尔会在1~3 d内出现急性期反应,表现为流感样症状如发烧和肌肉骨骼疼痛等,这与γδT细胞的激活以及炎症因子如干扰素-γ和TNF-α的释放有关。使用双膦酸盐治疗后,循环中γδT细胞减少,非常巧合的是,γδT细胞参与RA的发病机制,靶向γδT细胞可能是治疗RA的一种潜在途径[19]。
关于双膦酸盐运用于RA继发性骨质疏松的临床试验较少,并且样本量较少。Jensen等[20]在一项早期活动性RA患者的临床试验中观察到,Z值(Z-score,表示被测人的骨密度与同性别同年龄同种族的人骨密度平均值的差别)低的患者服用阿仑膦酸钠治疗后腰椎和股骨颈BMD得到改善。周淑平等[21]研究表明对老年RA继发骨质疏松患者使用LEF联合阿仑膦酸钠治疗比单用LEF治疗获益更多。Xie等[22]研究显示唑来膦酸和MTX联合治疗能减少RA患者骨质流失和髋部骨折的风险。另一研究表明,米诺膦酸盐与利塞膦酸盐相比,对骨吸收的抑制作用更强,能成为RA继发骨质疏松症的治疗选择之一[23]。
2.3 特立帕肽
特立帕肽是一种甲状旁腺素类似物,通过减少成骨细胞和骨细胞凋亡,增加骨形成。在GIOP患者(包括RA等风湿病患者)中,与抗吸收药物阿仑膦酸钠相比,特立帕肽不仅显著增加了BMD水平,而且显著减少了椎体骨折[24]。骨质疏松的RA患者在接受特立帕肽治疗6个月和12个月后,观察到腰椎BMD和骨强度的改善[25]。在RA患者的治疗中,尽管生物制剂的运用可延缓骨侵蚀的进程,但很少达到骨质修复的作用。Solomon等[26]评估了特立帕肽对TNF抑制剂治疗的RA患者(n=24)关节侵蚀量的影响,结果显示特立帕肽不能显著改善已接受TNF抑制剂治疗的RA患者手或腕部的骨侵蚀,但股骨颈和腰椎BMD有所提高。
2.4 地舒单抗(Denosumab)
地舒单抗是一种针对核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)的全人源化单抗,已开发运用于骨质疏松症和实体瘤骨转移防治中,并于2020年6月在中国获批用于骨折高风险的绝经后妇女的骨质疏松症治疗,商品名为“普罗力”。在处于炎症状态的RA患者中RANKL的表达上调,在RA患者中已评估了治疗效果[27]。一项II期随机对照试验结果显示,与安慰剂组相比,在治疗6个月和12个月后,地舒单抗组的腰椎和全髋关节BMD显著增加[28],同时观察到地舒单抗显著抑制了RA患者关节破坏的进展[29]。现如今,日本已将 “抑制与RA相关的骨侵蚀的进展”纳入到地舒单抗的适应症中。
然而,在一项临床试验中观察到地舒单抗的停药会引起骨标志物反弹,并显著降低骨量[30]。虽然尚未有RA患者发生类似的情况,但应参考原发性骨质疏松患者使用地舒单抗的建议,停用地舒单抗的患者应序贯使用其他抗骨质疏松药物治疗[31],并密切监测随访,警惕相关不良事件的发生。
2.5 其他
一些新型药物,例如组织蛋白酶K(cathepsin K,CatK)和骨硬化蛋白抑制剂,均在临床试验中取得新的进展。Odanacatib是CatK抑制剂,是默沙东公司重点开发的一款骨质疏松症药物,一直以来都寄予厚望。在骨折试验III期临床研究中,与安慰剂相比,Odanacatib显著降低了三种类型的骨质疏松性骨折的风险。然而,非常遗憾的是,在研究中同时观察到该药物与心血管事件(特别是中风)的风险增加相关。根据获益与风险之间的总体平衡,研究的发起人决定放弃Odanacatib的临床开发[32]。
罗莫珠单抗是全球首款获批上市的骨硬化蛋白抑制剂[33],通过抑制骨硬化蛋白,在促进骨形成的同时抑制骨吸收。该药能有效降低骨折风险,改善患者BMD。2020年美国内分泌学会提出对于存在较高骨折风险的绝经后的骨质疏松症患者,建议使用罗莫珠单抗(皮下注射210 mg/月)治疗1年,有较高心血管疾病风险者除外。然而,有学者指出,在慢性TNF-α依赖性炎症条件下,抗骨硬化蛋白抗体治疗可能会恶化临床RA结局,这意味着在考虑对RA炎性骨量丢失进行这种治疗应谨慎行事[34]。罗莫珠单抗是否适用于RA患者骨质疏松的治疗,有待进一步临床研究。
3 对RA骨质疏松治疗的相关建议
尽管与二三十年前相比,RA患者现在有了有效的治疗方案,但仍然面临骨折风险增加的问题。骨折发病率高,骨质疏松药物依从性低,其中最具威胁性的原因之一是糖皮质激素的持续使用,导致GIOP。对于RA骨质疏松的治疗,在此将一些专家意见汇总如下。首先,应加强RA患者关于骨质疏松方面的健康宣教,倡导健康的生活方式,控制所有与骨质疏松相关的因素,同时在诊疗过程中应注重RA患者骨代谢指标、BMD的监测及骨折风险评估;其次,提倡以尽可能低的剂量使用糖皮质激素,同时以RA患者的病情缓解或尽可能低的疾病活动状态为目标;第三,在治疗RA-骨质疏松症时,应额外关注钙的补充以及足量的维生素D的使用,尤其是糖皮质激素使用者;第四,对于骨折风险明显升高的RA患者,在控制疾病活动的同时,应给予额外的抗骨质疏松药物治疗,抗骨质疏松药物应在抑制骨吸收药物(如双膦酸盐、地诺单抗)和骨合成代谢药物(如特立帕肽、罗莫珠单抗)中进行区分,并根据RA患者的骨转化指标进行药物选择。抗骨质疏松药物靶向化、精准化的研发为RA骨质疏松的治疗提供更多的选择。在实际运用时,应根据RA患者的情况,综合考虑药物疗效、不良反应和治疗费用等因素,在RA疾病缓解的同时尽早防治骨质疏松,降低骨折风险,使患者得到更大获益。
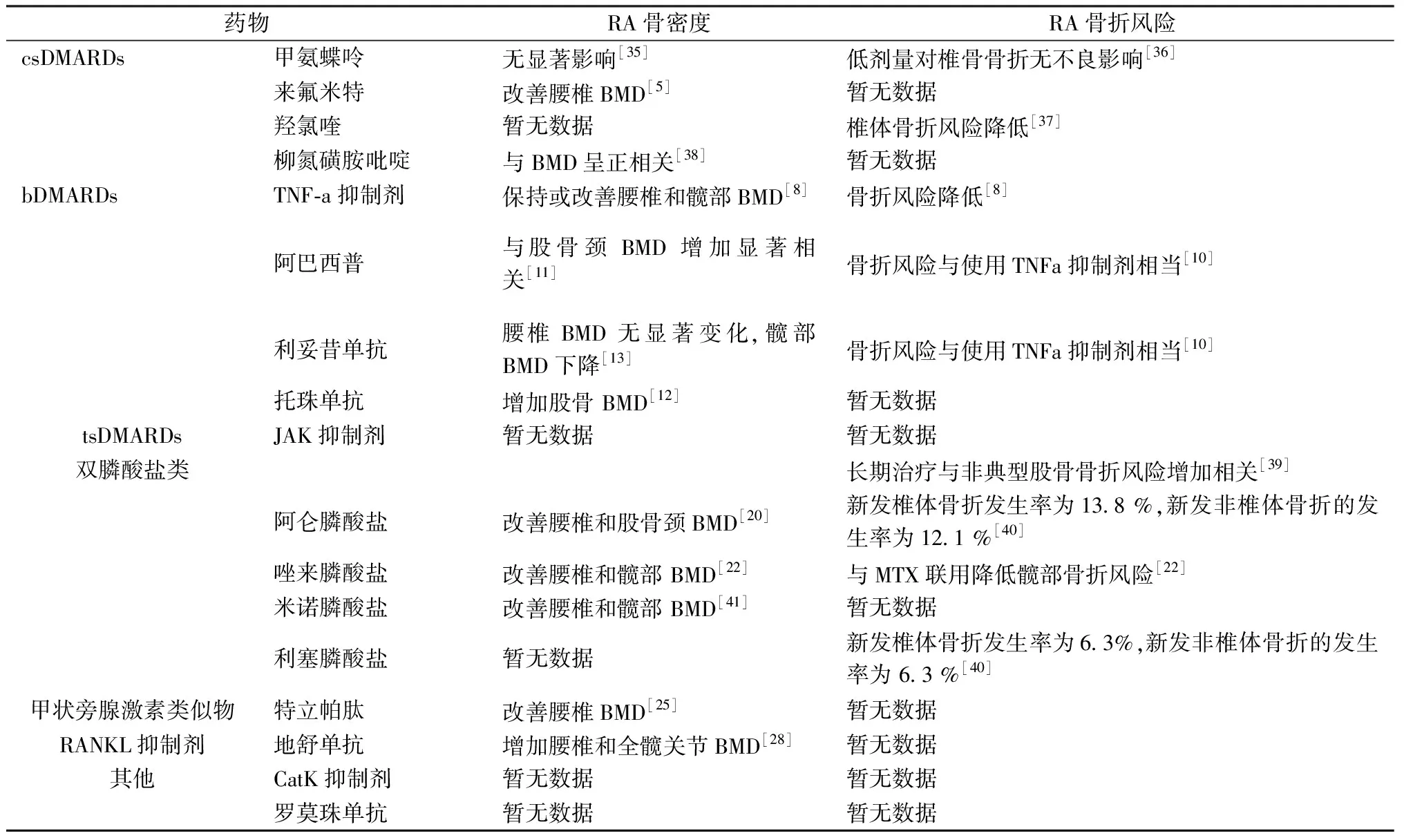
表1 抗风湿和抗骨质疏松治疗对RA患者骨密度和骨折风险的影响Table 1 The effects of anti-rheumatic and anti-osteoporotic therapy on bone mineral density and fracture risk in patients with RA
