越南紫薯组培快繁及FMV病毒检测
2022-04-19李艳辉穆玉洁白冰洋蒋素华
李艳辉 穆玉洁 白冰洋 蒋素华









摘要 [目的]探究获得大规模的越南紫薯脱毒苗的技术方法。[方法]采用茎尖组织培养快繁技術和RT-PCR技术,探讨不同培养基成分对越南紫薯无毒茎尖的诱导、分化、增殖以及生根的影响和羽状斑驳病毒的检测,建立越南紫薯高效再生体系和病毒检测体系。[结果]筛选出最适越南紫薯不定芽产生的培养基是MS+6-BA 1.0 mg/L,最佳增殖培养基为1/2MS+6-BA 1.0 mg/L+CW 2.0 mg/L,最佳生根培养基为1/2MS+NAA 0.5 mg/L。[结论]该试验为大田甘薯种苗FMV病毒的高效检测提供了理论依据。
关键词 越南紫薯;FMV病毒;组织培养
中图分类号 S531 文献标识码 A 文章编号 0517-6611(2022)07-0092-04
doi:10.3969/j.issn.0517-6611.2022.07.021
开放科学(资源服务)标识码(OSID):
Tissue Rapid Propagation and FMV Virus Detection of Vietnam Ipomoea batatas
LI Yan-hui1, MU Yu-jie1, BAI Bing-yang2 et al
(1. Fengqiu County Agriculture and Rural Affairs Bureau, Xinxiang, Henan 453000;2. Luohe Tiankang Agricultural Development Co., Ltd., Luohe, Henan 462000)
Abstract [Objective]To acquire large-scale Vietnam Ipomoea batatas seedings. [Method]This study adopts the tissue of rapid propagation technology,discusses different culture medium components of Vietnam Ipomoea batatas buds reduction,differentiation,proliferation and the influence of root. [Result]The results illustrate that the MS+6-BA 1.0 mg/L was the optimum medium for Ipomoea batatas buds reduction, 1/2MS +6-BA 1.0 mg/L+CW 2.0 g/L was the best medium for Ipomoea batatas proliferation,1/2MS+NAA 0.5 mg/L was the optimum medium for Ipomoea batatas growing roots.[Conclusion]Therefore, this experiment can provide a fundamental theory for virus G detection in the field.
Key words Vietnam Ipomoea batatas;Virus FMV;Tissue culture
病毒病是甘薯的重要病害之一,该病直接影响甘薯的生产量,使其种性退化。据报道,目前世界上甘薯病毒有30余种 [1-3],其中甘薯羽状斑驳病毒(FMV)是我国甘薯中检测到的最普遍的病毒[4],通常情况下FMV与甘薯褪绿矮化病毒(CSV)交叉感染甘薯[5]。但是两者对甘薯植株产生的影响不同,FMV主要的生理病症是破坏叶绿体结构,降解叶绿素,常见的表现症状是不规则的萎黄症状、褪绿斑以及不规则的羽状黄化斑,有些病斑外缘通常会有紫色素的产生。据统计,目前发现的甘薯病毒中,对甘薯感染面积最大的病毒是马铃薯Y病毒属,病毒FMV和CSV都是马铃薯Y病毒[6],FMV已被明确指出有多个株系,属于世界性分布,几乎所有的甘薯种植区都会有FMV的存在。FMV是长825~850 nm、杆状弯曲的粒子,是马铃薯Y病毒所有病毒中最长的病毒[7-9],侵染成功率相当高。
甘薯采用无性繁殖进行增殖,病毒会随植株不断的增殖,通过块茎或者秧苗代代相传,致使甘薯的生产质量不断下降。国内外研究者致力于甘薯抗病毒育种及甘薯脱毒研究,但至今尚未发现对甘薯病毒病有效的化学预防和治疗药剂,也未发现实用的甘薯品种能够高抗病毒病[10]。鉴于此,甘薯脱毒苗的大量培养成为提高甘薯产量和质量最有效的方法之一[11]。
甘薯脱毒苗的培养利用甘薯茎尖分生组织是无毒区的原理,将茎尖剥离,并进行组织培养获得无毒苗的一种生物技术[12-13]。分子生物学检测法即RT-PCR法,根据待测病毒外壳蛋白的核酸序列设计出特定的引物,提取越南紫薯的总RNA,建立合适的体系反转录得到其cDNA,用设计好的引物建立RT-PCR体系对得到的cDNA进行扩增并用普通琼脂糖进行电泳检测[8]。该研究利用越南紫薯的茎尖进行快繁,通过RT-PCR检测获得真正的无毒薯苗,提高紫薯的生产量,为甘薯病毒检测及脱毒苗快繁技术提供理论依据。
1 材料与方法
1.1 试验材料
采取新鲜越南紫薯叶片,用自来水清洗干净并放于液氮中速冻,标记后存放于-80 ℃恒温中备用。
1.2 引物设计
在NCBI上查取SPFMV外壳蛋白(SPFMV-CP)的序列,用Primer premier 5.0 设计序列保守引物,并由上海英骏生物技术公司合成,上引物:FMV-CP-F:5′-TTAGGCAGATTATGACGCA-3′;下引物:FMV-CP-R:3′-GCACACCCCTCATTCCTA-5′。
1.3 PCR扩增与测序
利用TIANGEN公司的多糖多酚植物总RNA提取试剂盒提取紫薯的总RNA,用试剂盒M-MLV反转录得到cDNA,以得到的cDNA为模板,进行PCR扩增,凝胶回收目的基因,然后进行T载体连接转化,最后进行基因测序。
1.4 越南紫薯的茎尖脱毒与病毒检测
1.4.1 脱毒苗的获得与芽诱导培养。
选取健康无病斑的越南紫薯块,用清水洗净表面泥土。先用0.1%高锰酸钾处理15 min,再用0.5%多菌灵浸泡1 h,捞出晾干,在0.1%多菌灵水中进行恒温催芽,温度为28 ℃,相对湿度为80%~85%,待薯芽萌动后,于35~40 ℃处理30 d(8 h/d)。
剪取生长旺盛的甘薯枝条顶芽下3~6节,剪去叶片和叶柄后进行消毒。消毒时先将材料放在水与洗洁精比例为1∶500的溶液中冲洗15 min,流水冲洗30 min,再将枝条剪成至少带2个顶芽的小段后,再用70%乙醇浸泡40 s。用无菌水清洗干净后,以0.1%HgCl 2灭菌6~7 min,再用无菌水反复清洗4次。在超净工作台上,把小段茎尖顶端的生长点(一般带有1~2个叶原基)剥离后,插入芽诱导X 1~X 3号培养基中,X 1:MS+6-BA 1.0 mg/L;X 2:MS+KT 0.5 mg/L+NAA 0.1 mg/L;X 3:MS。接种15 d后观察生长情况并统计。
1.4.2 脱毒苗的增殖培养。
选取健壮无菌丛生芽分割成5 mm左右的小段,叶片切成直径为4 mm左右大小的块,接种到M 1~M 3号培养基中培养,M 1:MS+6-BA 0.5 mg/L+NAA 0.1 mg/L;M 2:MS+KT 0.5 mg/L+NAA 0.1 mg/L;M 3:1/2MS+6-BA 1.0 mg/L+CW 2.0 mg/L。培养基为120 ℃灭菌30 min。每瓶接种数目一致(4~6个),置于光照培养室进行培养,并观察丛生芽增殖和长势情况。
1.4.3 脱毒苗的生根培养与病毒检测。
选取脱毒成功的越南紫薯增殖苗,切成带有2~3片嫩叶且2~3 cm的小段,移至Z 1~Z 3号生根培养基中,Z 1:1/2MS+NAA 0.5 mg/L;Z 2:1/2 MS+NAA 0.3 mg/L;Z 3:1/2MS。每瓶接种数目一致,培养20 d,观察生根情况。当小苗在培养瓶中长到7~9 cm时可进行炼苗和移栽。每株至少摘取1片生根培养后的叶片进行RT-PCR检测,然后用1.0%琼脂糖凝胶电泳及UVITEC成像系统分析电泳结果。若无对应FMV病毒外壳蛋白目标条带,即可判断经过茎尖脱毒的株系脱毒成功,并将未脱毒成功的株系淘汰。
2 结果与分析
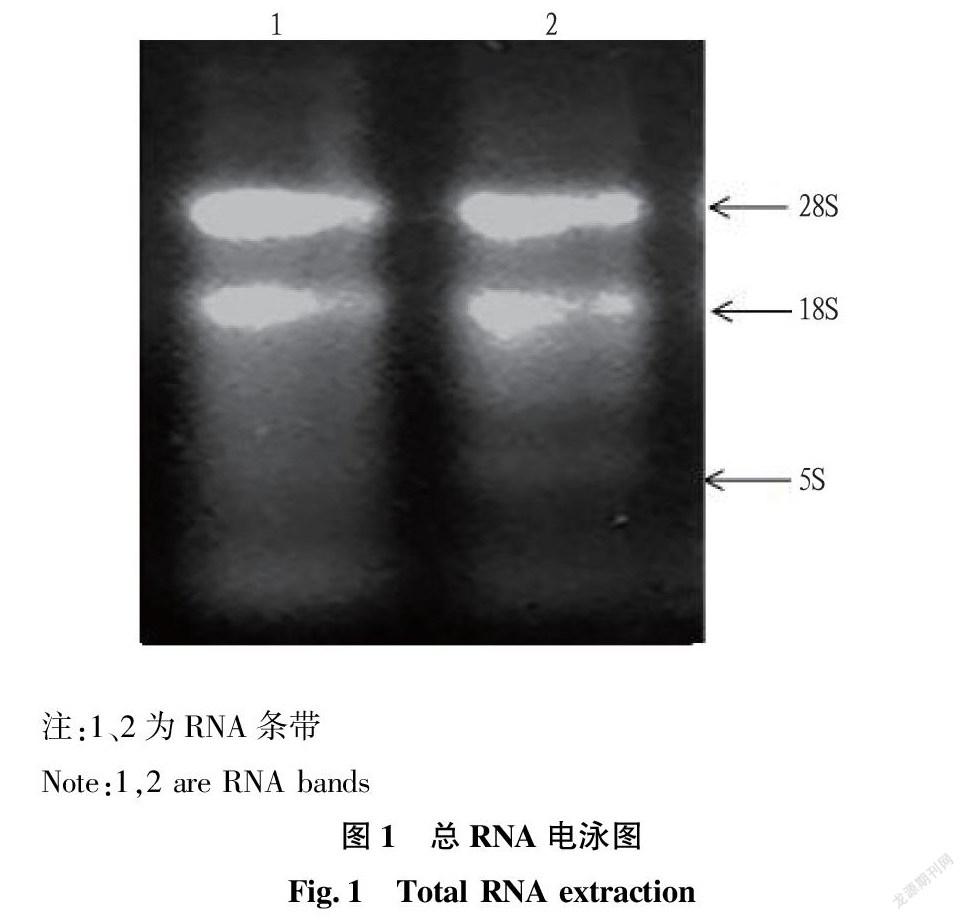
2.1 总RNA的提取
获得总RNA溶液后,凝胶电泳检测其完整性,结果见图1。从图1可以看出,18S、28S条带清晰,且28S条带为18S的2倍,通过紫外分光光度计检测其OD值在1.8~2.0,说明提取的RNA完整性较好,可通过PCR进行扩增。
2.2 基因克隆
以获得的cDNA作为模板,设计好引物FMV-CP-F和FMV-CP-R,用RT-PCR检测,结果显示有1条特异性条带在336 bp(图2),说明基因片段已经获得。
2.3 PCR检测与分析
连接转化后挑取阳性菌落作为目的基因模板,用引物FMV-CP-F和FMV-CP-R配制PCR体系,经扩增得到300 bp片段(图3)。
2.4 茎尖脱毒与病毒的检测
2.4.1 茎尖诱导。
对越南紫薯进行消毒和催芽后,取茎尖生长点接种到芽诱导培养基中进行培养,15 d后观察培养情况。由表1可知,X 1培养基诱导率达到100%,不定芽生长旺盛,呈深绿色,说明诱导效果好;X 2的诱导率虽然达到970%,但芽呈黄绿色,说明X 2的茎尖诱导效果一般;X 3的诱导率为92.5%,芽较弱,说明诱导效果欠佳。综合判断,X 1培养基中的激素适合不定芽的诱导,茎尖诱导情况见图4。
2.4.2 增殖培養和病毒检测。
为了避免诱导得到的不定芽老化,在其培养一段时间后,将其及时分成独立的芽苗接种到新鲜的培养基上,使芽苗能够快速增殖生长,以满足生根培养的需求。该试验采用3种不同的培养基对增殖培养过程进行比较筛选,结果见表2。由表2可知,培养基M 3的增殖效果最好,即培养基1/2MS+6-BA 1.0 mg/L+CW 2.0 mg/L适合越南紫薯苗的增殖,增殖率达98.9%,且苗生长健壮。增殖培养情况见图5。
2.4.3 脱毒检测。
从快繁体系中挑取长势较好的植株,将其移栽至智能温室中培养,剪取茎尖,提取脱毒苗的总RNA,进行PCR检测,判断其是否含有病毒。从图6可见,条带1 明亮,为阳性对照,条带2、3看不到条带则证明脱毒成功,可将植株2、3继续培养,作为获得无毒苗的材料。
2.4.4 生根培养。
选取未淘汰的无毒紫薯苗,在超净工作台上取带有2~3片嫩叶的短茎转移到Z 1~Z 3培养基上进行生根培养,结果见表3。由表3可知,越南紫薯嫩苗在Z 1培养基上生根率为100%,且根长而粗,生根效果理想。而Z 2培养基上的生根率虽然也为100%,但植株长势不好。因此,根诱导最适培养基为Z 1。生根培养情况见图7。
3 讨论
该研究通过比较不同浓度6-BA、NAA、KT等对越南紫薯组培快繁的影响,初步建立了越南紫薯的组培快繁体系。根据该研究结果可知,不同培养基成分在对越南紫薯茎尖的诱导、增殖和生根产生了不同效果:在诱导紫薯茎尖产生不定芽时宜采用MS+6-BA 1.0 mg/L;在进行增殖培养时宜采用1/2MS+6-BA 1.0 mg/L+CW 2.0 mg/L;在进行生根培养时宜采用1/2MS+NAA 0.5 mg/L,该组合得到的越南紫薯苗适合炼苗和移栽,单纯的1/2MS培养基上紫薯苗虽然也能长出根,但根较弱,难以吸收营养物质,不适合炼苗和移栽。综合说明培养基中添加激素可以促进器官诱导,而不同激素组合对同一种诱导有不同效应。组织培养的过程中根据RT-PCR检测方法可检测脱毒苗是否脱毒成功,检测过程灵敏快捷。
该研究在短时间内可完成越南紫薯植株再生和病毒检测过程,实现了再生体系的建立,该体系的建立对越南紫薯快速繁殖和规模化生产有着重要的指导意义。根据相关报道,我国每年因甘薯病毒病而造成的损失极大[14],而高效的茎尖脱毒体系将会大大降低损失,因此推广优质的甘薯品种病毒检测体系及茎尖脱毒体系势在必行。
参考文献
[1] LUAN Y S,ZHANG J,LIU D M,et al.Molecular characterization of sweet
potato leaf curl virus isolate from China(SPL CV-CN)and its phylogenetic relationship with other members of the Geminiviridae [J].Virus genes,2007,35(2):379-385.
[2] LOZANO G,TRENADO H P,VALVERDE R A,et al.Novel begomovirus species of recombinant nature in sweet potato(Ipomoea batatas)and Ipomoes indica:Taxonomic and phylogenetic implications [J].Journal of general virology,2009,90(10):2550-2562.
[3] 何海旺,何虎翼,谭冠宁,等.反向斑点杂交法快速检测甘薯羽状斑驳病毒和甘薯G病毒[J].南方农业学报,2014,45(1):43-48.
[4] 王关林,刘娟.甘薯病毒的分子生物学研究进展[J].商丘师范学院学报,2009,25(3):7-15.
[5] 张盼,兰新芝,乔奇,等.甘薯病毒病害(SPVD)的多重RT-PCR检测方法及其应用[J].植物保护,2013,39(2):86-90,100.
[6] CLARK C A,HOY M W.Effects of common viruses on yield and quality of Beauregard sweetpotato in Louisiana[J].Plant disease,2006,90(1):83-88.
[7] 王丰.甘薯病毒病脱毒技术及检测[J].植物檢疫,2003,17(5):295-298.
[8] 林林,陈炯,郑红英,等.甘薯羽状斑驳病毒分离物的基因组3′-末端序列测定与分析[J].浙江农业学报,2003,15(4):211-214.
[9] 王升吉,尚佑芬,杨崇良,等.甘薯羽状斑驳病毒分子生物学研究概况[J].山东农业大学学报(自然科学版),2001,32(4):539-543.
[10] 张希太,张彦波,肖磊,等.指示植物检测甘薯病毒技术的改进研究[J].西南农业学报,2014,27(4):1509-1513.
[11] 孟令文.甘薯茎尖脱毒及快繁技术研究[J].杂粮作物,2010,30(6):414-415.
[12] 卢玲,聂明建,王学华.甘薯脱毒苗培育的研究进展[J].安徽农业科学,2013,41(4):1456-1458.
[13] 王林生,马晓玉.甘薯脱毒技术的研究与应用[J].种子,2005,24(10):51-53.
[14] 乔奇,张德胜,秦艳红,等.中国甘薯病毒种类的初步鉴定[C]//郭泽建,侯明生.中国植物病理学会2011年学术年会论文集.北京:中国农业科学技术出版社,2011.
