土壤中抑菌放线菌的筛选鉴定及发酵条件研究
2022-04-19晏爱芬余丽黄鑫
晏爱芬 余丽 黄鑫
摘要 采用弹土法从高黎贡山百花岭段土壤中共分离到放线菌38株,对分离得到的38株放线菌的发酵液进行抑菌活性测定,其中H33菌株对枯草芽孢杆菌、金黄色葡萄球菌和白假丝酵母都具有较好的抑菌作用,其抑菌直径都在8 mm以上。通过对H33菌株培养特征、显微特征和生理生化特征的研究,初步鉴定为链霉菌属(Streptomyces)。H33菌株的最佳发酵培养基为发酵培养基2(葡萄糖0.5 g、蛋白胨0.25 g、胰胨0.15 g、NaCl 0.25 g、重铬酸钾7.5 mg、复合维生素10 g、水500 mL,pH 7.2),最佳发酵时间为6 d,最适发酵培养基pH为7.0,最适培养温度28 ℃。
关键词 抑菌放线菌;筛选;鉴定;分离纯化;发酵条件
中图分类号 S154.3 文献标识码 A 文章编号 0517-6611(2022)07-0065-03
doi:10.3969/j.issn.0517-6611.2022.07.016
开放科学(资源服务)标识码(OSID):
Study on Screening and Identification of Bacteriostatic Actinomycetes in Soil and Fermentation Conditions
YAN Ai-fen, YU Li,HUANG Xin
(School of Resources and Environment,Baoshan University,Baoshan,Yunnan 678000)
Abstract A total of 38 actinomycetes were isolated from the soil in Baihualing section of Gaoligong Mountain by the bombing method,and the antibacterial activity of the 38 isolated actinomycetes was tested.Among them,the H33 strain had good antibacterial effects on Bacillus subtilis,Staphylococcus aureus and Candida albicans,and its antibacterial diameter was all above 8 mm.Through the study of the culture characteristics,microscopic characteristics and physiological and biochemical characteristics of the H33 strain,it was preliminarily identified as Streptomyces.The best fermentation medium for H33 strain was fermentation medium 2 (glucose 0.5 g,peptone 0.25 g,tryptone 0.15 g,NaCl 0.25 g,potassium dichromate 7.5 mg,multivitamin 10 g,water 500 mL,pH 7.2) ,the optimal fermentation time was 6 d,the optimal fermentation medium pH was 7.0,and the optimal culture temperature was 28 ℃.
Key words Antibacterial actinomycetes;Screening;Identification;Isolation and purification;Fermentation conditions
放线菌由于菌落边缘菌丝呈放射状而得名[1]。在微生物资源中放线菌具有巨大的應用价值,在它的营养细胞分化成菌丝以及进一步产生孢子的过程中,细胞代谢会产生各种各样的次生代谢产物,它们能够合成一些具有专一性功能的物质,来控制细胞分化和细胞周期,从而抑制病原菌的生长[2]。放线菌在自然环境中分布广泛,如陆地、淡水、动物肠道、植物体等均有分布。其中土壤含水量较低、通风较好、腐殖质丰富,适宜大量放线菌的生长[3]。谭悠久等[4]从土壤中分离抑菌放线菌,并对分离到的抑菌放线菌进行代谢产物抗菌活性研究;王东胜[5]从秦岭主峰太白山北坡土壤中分离抑菌放线菌,分离到的放线菌具有抑菌作用的可培养菌株达到56%。高黎贡山百花岭段植被丰富,土壤腐殖质丰富,人为干扰较小,其土壤中含有大量的微生物,该研究从高黎贡山百花岭段土壤中筛选具有抑菌作用的放线菌,并对该放线菌进行初步鉴定、发酵条件等研究。
1 材料与方法
1.1 材料
1.1.1 土壤样品的采集。
从高黎贡山百花岭段不同海拔和植被区采集土壤。采集时去除表层土后用铲子铲取5~10 cm深度的土壤,放入自封袋,写好标签。带回实验室4 ℃保存备用。
1.1.2 供试菌。枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、白假丝酵母(Candida albicans),均由保山学院微生物实验室提供。
1.1.3 培养基。
高氏1号培养基;牛肉膏蛋白胨培养基(细菌);PDA培养基(真菌);发酵培养基1(液体高氏1号培养基);发酵培养基2(葡萄糖0.5 g、蛋白胨0.25 g、胰胨0.15 g、NaCl 0.25 g、重铬酸钾7.5 mg、复合维生素10 g、水500 mL,pH 7.2);发酵培养基3(葡萄糖2.5 g、乳糖0.75 g、玉米饼粉10 g、碳酸钙 1.5 g、蒸馏水500 mL,pH 7.0)。
1.2 方法
1.2.1 放线菌的分离与纯化。
采用弹土分离法分离放线菌。土样风干研碎,放于已灭菌的滤纸片上,打开平板皿盖,用手指弹拨滤纸片背面(使纸片含菌面保持在平板上方),盖上皿盖后置28 ℃恒温培养5~7 d,挑单菌落进行平板划线,28 ℃恒温培养5~7 d,挑取单菌落移接斜面,28 ℃恒温培养5~7 d,置于4 ℃保存备用。
1.2.2 菌株发酵液抑菌活性的测定。
挑取放线菌接种于10 mL液体高氏1号培养基中,放入28 ℃、160 r/min振荡恒温培养箱中培养7 d,取1 mL培养液置于离心机10 000 r/min离心10 min,上清液用0.22 μm滤膜过滤后用于抑菌活性测定[6]。
采用滤纸片法对分离到的放线菌进行抑菌活性测定。用1 mL的移液枪吸取供试菌菌液0.2 mL分别涂布于牛肉膏蛋白胨培养基和PDA培养基表面,用直径为5 mm的滤纸片,蘸取滤液贴于涂满供试菌液的平板上,每个平板贴3张含有滤液的滤纸片,再贴一片蘸取无菌水的滤纸片作为对照,平板分别置于37、28 ℃恒温培养2 d后,采用十字交叉法用直尺测量抑菌圈直径,求平均值[7-8]。
1.2.3 抑菌放线菌的分类鉴定。
1.2.3.1 培养特征观察。
将筛选出的放线菌接种于液体高氏1号培养基中,在28 ℃下培养3、5、7 d分别观察并记录菌株在培养基生长时的菌落形态,不同时间段内的颜色变化和生长情况[9]。
1.2.3.2 显微特征观察。用已灭菌的盖玻片45°插入培养基中,在盖玻片与培养基的交界处接种放线菌,28 ℃培养7 d后缓慢拔出盖玻片,用光学显微镜观察记录菌丝体形态。
1.2.3.3 生理生化特征。菌株的生理生化特征参考徐丽华等[10]的方法进行。
1.2.4 发酵条件的研究。以下试验均用生长速率法测其抑菌率,其方法参照徐方继等[11]的方法进行。
1.2.4.1 发酵培养基对发酵液抑菌活性的影响。
分别取25 mL发酵培养基1、发酵培养基2、发酵培养基3,装入100 mL锥形瓶中灭菌后,接种抑菌放线菌,置于28 ℃、280 r/min摇床恒温培养6 d后,测其对白假丝酵母的抑菌率,选择出最优发酵培养基[12]。
1.2.4.2 培养时间对发酵液抑菌作用的影响。
保持其他培养条件不变,分别在培养4、5、6、7、8 d后测放线菌发酵液对白假丝酵母的抑菌率,选出最优发酵培养时间。
1.2.4.3 温度对发酵液抑菌活性的影响。
取pH为7.0的25 mL发酵培养基装入100 mL锥形瓶中灭菌后,接种抑菌放线菌,分别置于24、28、32、36 ℃在280 r/min摇床培养6 d后,测出其对白假丝酵母的抑菌率,选出最佳发酵温度。
1.2.4.4 pH对发酵液抑菌活性的影响。
利用氢氧化钠(1 mol/L)和盐酸(1 mol/L)将筛选到的液体发酵培养基的pH调至5.0、6.0、7.0、8.0、9.0、10.0,各取25 mL不同初始pH的培养基装入100 mL锥形瓶中灭菌后,接种置于28 ℃、280 r/min摇床培养6 d后,测出其对白假丝酵母的抑菌率。
2 结果与分析
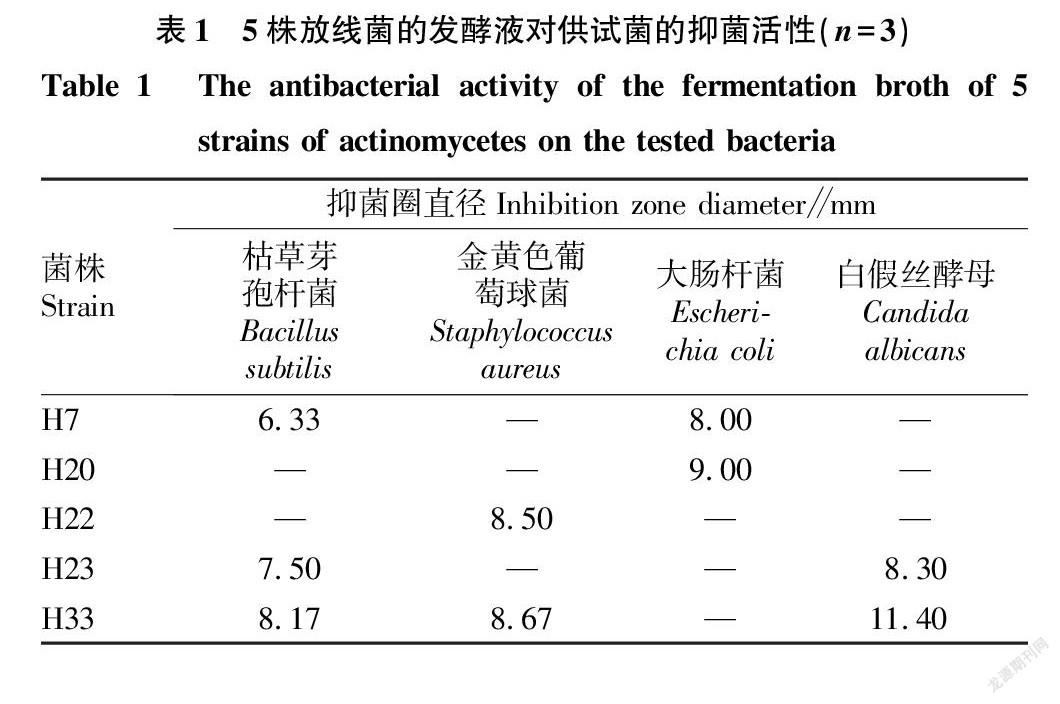
2.1 土壤中抑菌放线菌的筛选 从采集的土样中共分离纯化到38株放线菌,采用滤纸片法对38株放线菌发酵液进行抑菌活性测定,其中有5株放线菌具有抑菌作用,如表1所示。由表1可知,H33菌株的发酵液对枯草芽孢杆菌、金黄色葡萄球菌和白假丝酵母都具有抑菌作用,其中对白假丝酵母的抑菌效果最好,其抑菌圈直径达到11.40 mm。因此,选取H33放线菌进行进一步试验研究。
2.2 菌株的初步鉴定
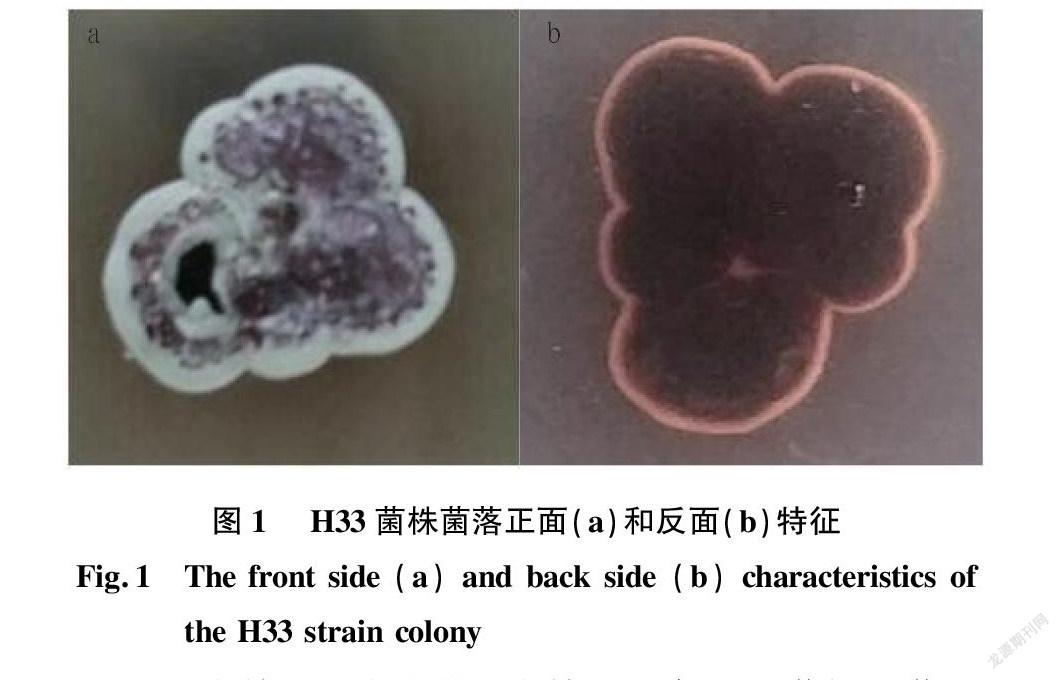
2.2.1 菌落特征。H33菌株菌落特征如图1所示,正面呈现出紫色,反面呈暗紅色,菌落的表面褶皱,产生了一定量的水珠,生长状况良好。
2.2.2 显微特征。
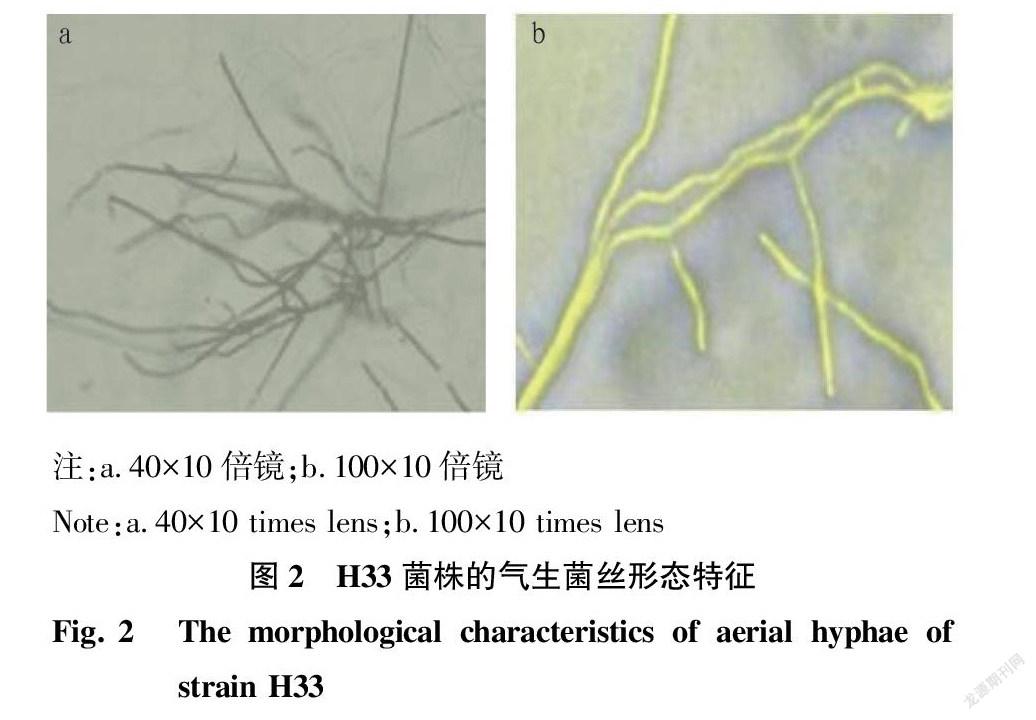
在光学显微镜下观察H33菌株的菌丝形态特征如图2所示,气生菌丝丰富,直径较粗、不断裂,颜色为紫灰色;孢子丝螺旋状、右旋;基内菌丝呈暗红色,质地坚韧、无隔膜。
2.2.3 生理生化特征。
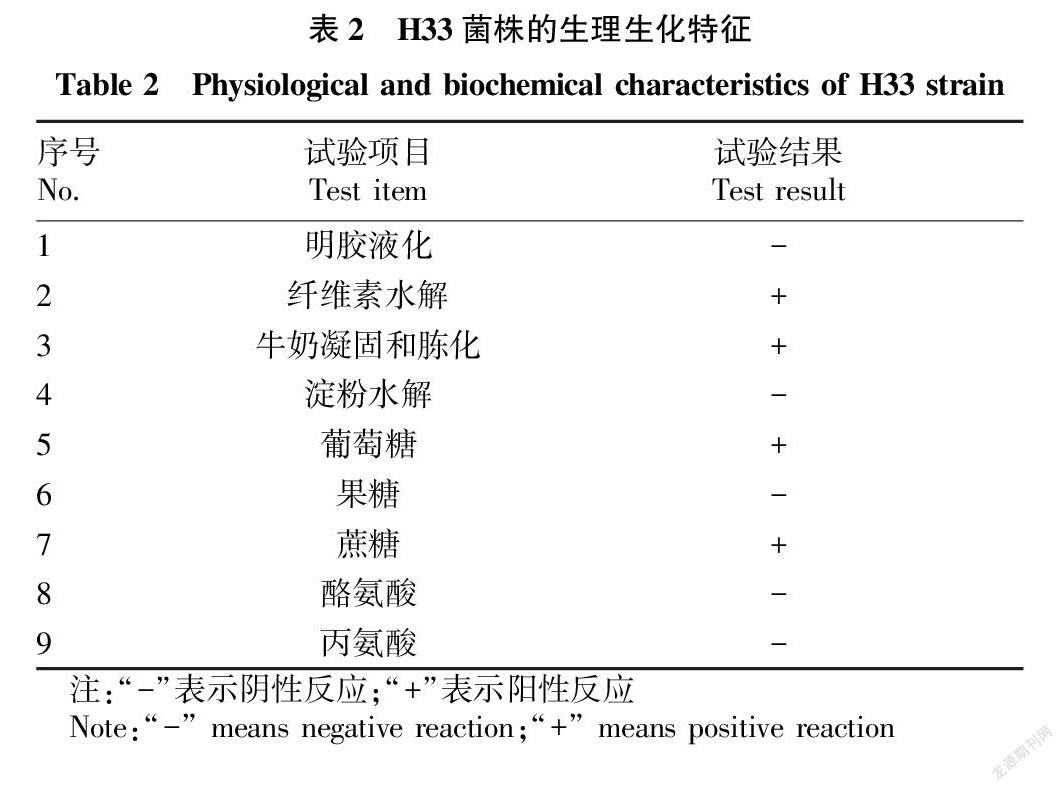
H33菌株的生理生化特征如表2所示,菌株不能使明胶液化,产纤维素酶,能使牛奶凝固和胨化,不产淀粉酶,能利用葡萄糖和蔗糖,不能利用果糖,试验显示H33菌株氮源不能利用丙氨酸和酪氨酸。
根据菌株H33的菌落特征、显微特征、生理生化特征,参照阎逊初[13]放线菌分类系统,初步鉴定菌株H33为链霉菌属(Streptomyces)。
2.3 发酵条件的研究
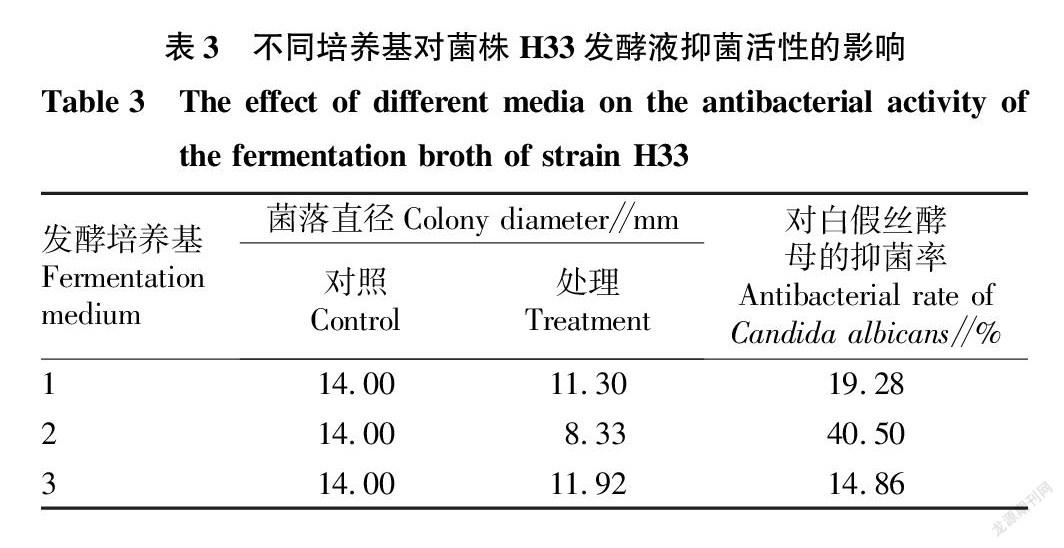
2.3.1 发酵培养基对菌株H33发酵液抑菌活性的影响。
用3种不同发酵培养基对菌株H33进行发酵培养,结果发现(表3),其发酵液对白假丝酵母的抑菌效果最好的是发酵培养基2,抑菌率达到40.50%。
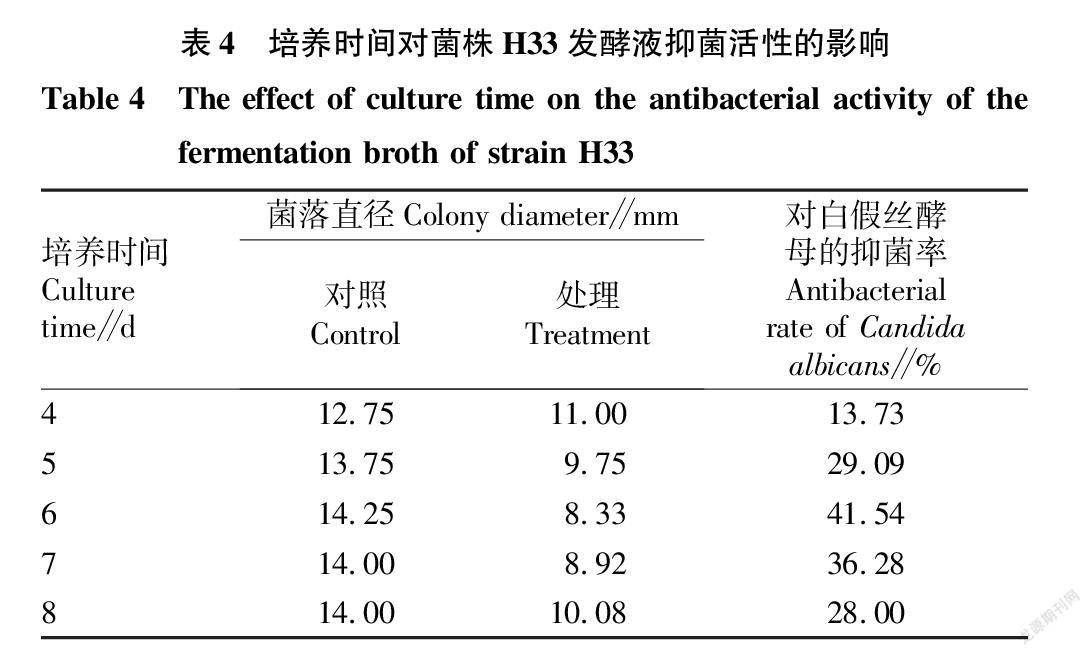
2.3.2 培养时间对菌株H33发酵液抑菌活性的影响。
从表4可以看出,从发酵第4天开始至第6天,菌体慢慢地产生了一些次级代谢物,发酵液的抑菌活性在缓慢增加;到第6天后由于各类营养物质的缺乏和菌体自身代谢活性的降低,自身所产生的一些次级代谢产物也越来越少,发酵液的抗菌活性也随之变弱,所以最佳发酵时间为6 d,其抑菌率达到41.54%。
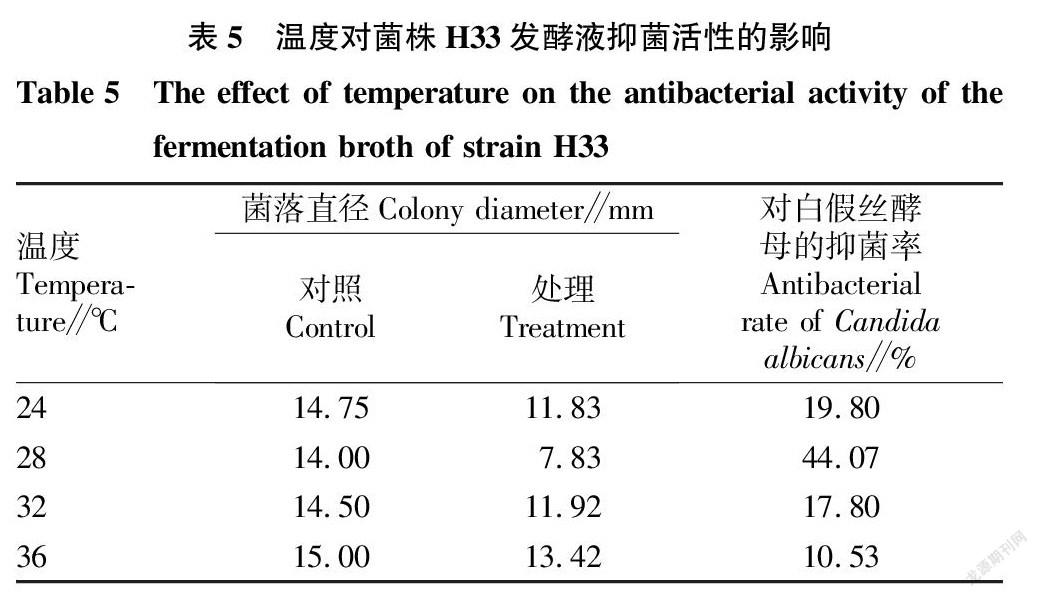
2.3.3 温度对菌株H33发酵液抑菌活性的影响。
H33菌株在不同温度下发酵,其发酵液对白假丝酵母的抑菌活性如表5所示,当发酵温度为28 ℃时,其抑菌效果最好,抑菌率达到44.07%。
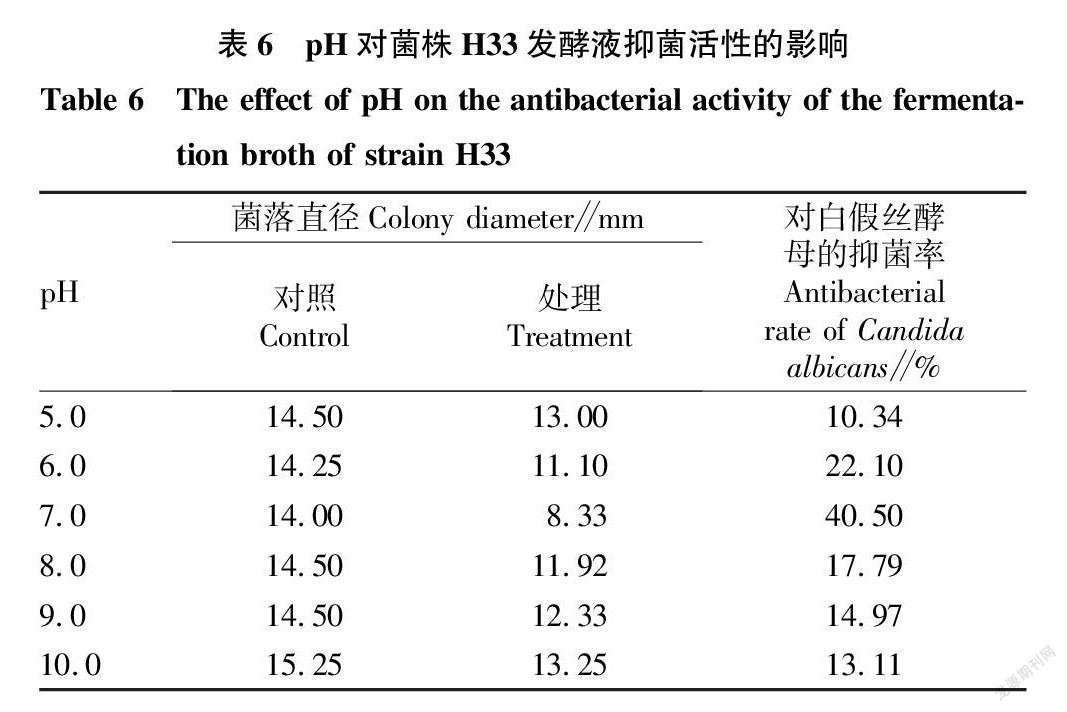
2.3.4 pH对菌株H33发酵液抑菌活性的影响。从表6可以看出,
H33菌株在不同的pH条件下发酵,其发酵液的活性受pH的影响,在pH大于7.0时,活性逐步降低。抑菌活性较好的是pH为7.0的发酵液,抑菌率达到40.50%。
3 讨论与结论
放线菌是一种具有应用前景的微生物资源,自然界分布广泛,数量众多,其中与人类关系密切的链霉菌属(Streptomyces)最为典型[14]。马爱爱等[15]从祁连山老虎沟不同海拔位点的根际土壤中分离纯化放线菌,并对具有抑菌作用的放线菌进行生理及系统发育多样性研究,其中链霉菌属为主要类群。
该研究从高黎贡山百花岭段土壤中分离纯化放线菌,并对分离到的放线菌进行抑菌试验,从中筛选具有抑菌作用的放线菌,菌株H33对枯草芽孢杆菌、金黄色葡萄球菌和白假丝酵母都具有较好的抑菌效果,抑菌直径都在8 mm以上,且对白假丝酵母的抑菌直径在11 mm以上。对H33菌株的菌落特征、显微特征和生理生化特征分析,可将H33菌株初步鉴定为链霉菌属放线菌。通过发酵条件研究菌株H33的最佳发酵培养基为发酵培养基2(葡萄糖0.5 g、蛋白胨0.25 g、胰胨0.15 g、NaCl 0.25 g、重鉻酸钾7.5 mg、复合维生素10 g、水500 mL,pH 7.2),最适发酵时间为6 d,最适发酵初始pH为7.0,最适培养温度为28 ℃。
参考文献
[1]
阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011:1-6.
[2] 苏涛,马宗琪,司美茹.鲁西南地区土壤放线菌的生态分布[J].山东农业科学,2006,38(2):57-60.
[3] 阮继生.放线菌分类基础[M].北京:科学出版社,1977:2-3.
[4] 谭悠久,彭祎,黄永春.土壤放线菌的选择性分离及其代谢产物抗菌活性评价[J].植物保护,2011,37(1):120-123.
[5] 王东胜.秦岭主峰太白山北坡5种生境中微生物区系及拮抗放线菌资源研究[D].杨凌:西北农林科技大学,2014.
[6] 张锦恬.秦岭地区土壤放线菌分离及抑菌活性筛选[D].杨凌:西北农林科技大学,2009.
[7] 范延辉,王君,王进宾.黄河三角洲贝壳堤放线菌多样性及抑菌活性[J].土壤通报,2016,47(5):1142-1147.
[8] 詹伟.金钗石斛根际土壤细菌和放线菌分离及抑菌活性研究[D].贵阳:贵州师范大学,2016.
[9] 李阳,李健强,宋素琴,等.高放射土壤中拮抗放线菌菌株的筛选及鉴定[J].新疆农业科学,2017,54(1):132-139.
[10] 徐丽华,李文均,刘志恒.放线菌系统学:原理、方法及实践[M].北京:科学出版社,2007.
[11] 徐方继,李桂鼎,李沁元,等.怒江大峡谷怒江州段土壤放线菌多样性[J].微生物学通报,2018,45(2):250-265.
[12] 方羽生,杨卫华,张洪玲,等.放线菌对4种病原真菌的拮抗作用初探[J].广东农业科学,2001,28(5):39-41.
[13] 阎逊初.放线菌的分类和鉴定[M].北京:科学出版社,1992.
[14] 郑丹,李鹤鸣,韩力.土壤放线菌资源及其应用[J].绿色科技,2021,23(2):183-187,193.
[15] 马爱爱,徐世健,敏玉霞,等.祁连山高山植物根际土放线菌生物多样性[J].生态学报,2014,34(11):2916-2928.
