槲皮素抑制黄嘌呤氧化酶活性促进环磷酸腺苷发酵合成
2022-04-18谭海员林娜卢南巡张中华常景玲李志刚
谭海,员林娜,卢南巡,张中华,常景玲,2,李志刚,2*
1(河南科技学院 生命科技学院,河南 新乡,453003) 2(现代生物育种河南省协同创新中心,河南 新乡,453003)
环磷酸腺苷(cyclic adenosine monophosphate,cAMP)作为生物体内重要的生理活性物质,主要用于心脑血管疾病、白血病、肝肾功能损伤、糖尿病以及皮肤病等的治疗,并普遍作为饲料添加剂和药物中间体使用[1]。利用发酵法生产cAMP时,培养基中含有嘌呤类物质能够激活补救途径,直接利用前体物质用于产物合成,相比于从头合成途径,补救途径包含的酶促反应少,同时减少了ATP消耗,更有利于cAMP的合成[2]。前期研究表明,通过补加2 g/L次黄嘌呤,cAMP生产效率提高了39.10%,但产量提高幅度不大,发酵周期明显缩短,发酵后期细胞活性及产物合成速率很低[3]。有报道表明,次黄嘌呤可以诱导节杆菌合成大量黄嘌呤氧化酶(xanthine oxidase,XOD)[4]。XOD可以将次黄嘌呤分解为尿酸,降低次黄嘌呤对产物的转化率,并伴随活性氧(reactive oxygen species,ROS)的大量产生。菌体处于高浓度ROS条件下,会导致细胞组分受损,代谢活性下降,影响产物的合成[5]。因此,抑制XOD活性,有利于提高次黄嘌呤转化率,提高细胞代谢活性,进而促进cAMP发酵合成。
目前,临床上用于抑制XOD的药物主要包括别嘌呤醇、非布司他等[6]。研究表明,黄酮类[7]和多酚类[8]物质对XOD活性也具有较好的抑制效果。陈雨涔等[9]进行体外酶活性抑制实验,槲皮素含量达到15.11 mg/kg时,XOD活性抑制率达到90%。李雪岩等[10]通过灌胃100 mg/kg木犀草素,使高尿酸坏血症小鼠体内XOD活性抑制率达到70%以上。李昕卓等[11]通过添加橙皮苷、山奈酚、高良姜素等多酚类物质,有效抑制了XOD活性,其中橙皮苷和高良姜素效果最为显著。
本研究针对补救途径发酵生产cAMP过程中,产物浓度和次黄嘌呤转化率低下的问题,通过添加XOD抑制剂,减少次黄嘌呤无效利用及ROS合成,使更多的次黄嘌呤用于产物合成,提高cAMP产量和次黄嘌呤转化率,为利用补救途径进行嘌呤核苷酸类物质的高效合成提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
节杆菌Arthrobactersp.CCTCC 2013431,中国典型培养物保藏中心。
1.1.2 仪器
LDZX-75KBS高压灭菌锅,上海申安医疗器械厂;BIOTECH-7BG机械搅拌式发酵罐,上海保兴生物设备有限公司;UV—2800紫外分光光度计,上海舜宇恒平科学公司;VCX-150超声波细胞破碎仪,美国SONICS公司;3K30离心机,西格玛奥德里奇(上海)贸易有限公司;1260infinity II高效液相色谱仪,安捷伦科技(中国)有限公司;F-180荧光分光光度计,天津港东科技股份有限公司;1510-04319C酶标仪,赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 培养基
种子培养基(g/L):葡萄糖10,牛肉膏10,蛋白胨10,尿素4,NaCl 3,酵母膏10,pH 7.2,121 ℃高压蒸汽灭菌25 min。
发酵培养基(g/L):葡萄糖50,蛋白胨5,尿素10,KH2PO410,K2HPO410,生物素0.3,CoCl20.01,次黄嘌呤2,NaF 0.1,pH 7.4,121 ℃高压蒸汽灭菌25 min。
1.2.2 培养方法
摇瓶培养:250 mL摇瓶中装有30 mL发酵培养基,121 ℃高压蒸汽灭菌25 min。接入培养24 h的种子液,接种量10%(体积分数,下同),摇床培养72 h,温度30 ℃,转速220 r/min。
发酵罐培养:7 L机械搅拌式发酵罐装载5 L发酵培养基,121 ℃高压蒸汽灭菌25 min。初始pH 7.4,接种量10%,培养温度30 ℃,初始搅拌转速400 r/min,通风量0.1 vvm,视溶氧变化调节转速和通风量。
1.2.3 XOD抑制剂添加方法
摇瓶实验:分别添加槲皮素、木犀草素、葛根素、橙皮苷及别嘌呤醇等抑制剂,每种抑制剂设置6、12、18、24和30 mg/L 5个添加量,每个条件3个平行试验,确定最佳抑制剂及其添加量。设置0、6、12、18、24、30和36 h等7个不同时间,均添加12 mg/L槲皮素,每个条件3个平行试验。以上黄酮类物质难溶于水,加入少量NaOH配制成0.9 g/L的碱性母液,根据浓度要求向培养基中添加相应体积母液。
发酵罐实验:对照批次,发酵18 h补加1 g/L(发酵液,下同)次黄嘌呤,36 h补加1 g/L次黄嘌呤;添加槲皮素批次,发酵18 h添加12 mg/L槲皮素和1 g/L次黄嘌呤,36 h补加1 g/L次黄嘌呤。槲皮素与次黄嘌呤均难溶于水,加入少量NaOH溶解后,根据实验条件要求添加。
1.2.4 分析方法
1.2.4.1 葡萄糖测定
采用DNS法测定。发酵液于10 000 r/min离心5 min,上清液稀释50倍后,以1∶2体积比与DNS溶液混合,沸水浴反应5 min,迅速冷却后稀释至原浓度的1/5测定540 nm下吸光度,根据标准曲线计算葡萄糖浓度。
1.2.4.2 菌体浓度测定
将发酵液稀释至原浓度的1/20后,用600 nm波长下吸光度表示菌体浓度。
1.2.4.3 关键酶活性测定
XOD、6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PDH)、超氧化物歧化酶(superoxide dismutase,SOD)以及过氧化氢酶(catalase,CAT)使用试剂盒(Solarbio)进行测定,酶活性单位均以U/mg蛋白表示。5 mL发酵液4 ℃离心10 min收集菌体,加入1 mL细胞破碎液,冰浴条件下超声破碎5 min,功率40%,超声3 s,间隔6 s,经4 ℃、12 000 r/min离心10 min,取上清液测定酶活性,具体操作步骤见试剂盒说明书。
腺苷酸环化酶(adenylate cyclase,AC)和腺苷琥珀酸合成酶(succino-AMP synthetase,sAMPase)测定:细胞破碎方法同上,酶活性单位:U/mg蛋白。反应体系及具体操作参考文献[12]。
1.2.4.4 细胞活性测定
使用Alamar Blue细菌活性检测试剂盒测定,发酵液离心收获菌体,磷酸盐缓冲溶液(phosphate buffered solution,PBS)洗涤悬浮,配制为OD600=1.0的细胞悬液,加入Alamar Blue,37 ℃培养60 min后测定荧光强度,激发波长540 nm,发射波长590 nm,具体操作方法见说明书。
1.2.4.5 尿酸含量测定
采用试剂盒(Solarbio)进行测定。发酵液10 000 r/min离心5 min,保留上清液用于尿酸测定,具体操作步骤见说明书,单位mg/L。
1.2.4.6 cAMP和次黄嘌呤含量测定
高效液相色谱法测定。发酵液12 000 r/min离心5 min,取2 mL上清液经0.45 μm孔径水相膜过滤后待测。色谱条件:Lichrospher C18(4.6 mm×250 mm,5 μm),柱温30 ℃。水相:体积分数0.6%磷酸溶液用三乙胺调至pH 6.6,V(水相)∶V(甲醇)=70∶30,进样量2 μL,流速0.8 mL/min,检测波长254 nm,详见文献[13]。
1.2.4.7 ROS和丙二醛(malondialdehyde,MDA)含量测定
ROS采用化学荧光法测定。发酵液低温离心收获菌体,PBS洗涤3次,配制为OD600=1.0的细胞悬液,加入2,7-二氯荧光双乙酸盐探针,摇床中37 ℃、200 r/min反应40 min,12 000 r/min离心5 min收集菌体,PBS洗涤3次去除多余探针,重新悬浮后测定荧光强度,激发波长485 nm,发射波长525 nm。
MDA采用巴比妥酸法进行测定。发酵液离心收获菌体,破碎方法同1.2.4.3,具体方法参见文献[14]。蛋白浓度采用考马斯亮蓝染色法测定[12]。
1.2.4.8 次黄嘌呤转化率和cAMP合成速率测定
次黄嘌呤转化率和cAMP合成速率计算如公式(1)(2)所示:
(1)
(2)
式中:YP/HX,cAMP对次黄嘌呤的转化率,g/g;RP,cAMP合成速率,g/(L·h);t,发酵时间,h;c(P)和c(HX)分别表示cAMP和次黄嘌呤的质量浓度,g/L;参数取3次测定值的平均值。
1.3 数据处理
使用Excel分析数据,Origin 2019软件作图。
2 结果与讨论
2.1 不同XOD抑制剂对cAMP发酵生产的影响
利用补救途径发酵生产cAMP时,XOD大量生成,将部分次黄嘌呤分解为尿酸,同时伴随ROS的产生,导致次黄嘌呤转化率低下和cAMP产量难以提高。在250 mL摇瓶中,进行了添加不同XOD抑制剂的cAMP发酵试验,结果如表1所示。通过添加不同的XOD抑制剂,cAMP产量均得到一定程度的提升,其中槲皮素和木犀草素作用效果较为明显。在单独添加6 mg/L木犀草素和12 mg/L槲皮素条件下,cAMP质量浓度分别达到3.20和3.42 g/L,与对照(不添加抑制剂)相比,分别提高80.80%和93.22%,cAMP产量得到极显著提高(P<0.01)。
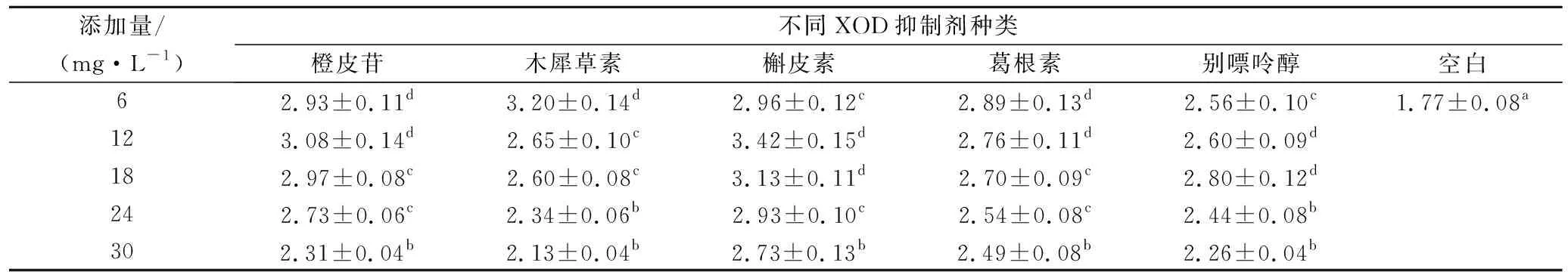
表1 不同XOD抑制剂对cAMP发酵产量的影响 单位:g/L
确定槲皮素为最佳XOD抑制剂,并在摇瓶中进行了不同时间添加12 mg/L槲皮素的cAMP发酵实验。如图1所示,cAMP产量呈现先升后降的趋势,在18 h达到3.37 g/L的最大值。因此,确定18 h添加12 mg/L槲皮素为发酵罐实验条件。
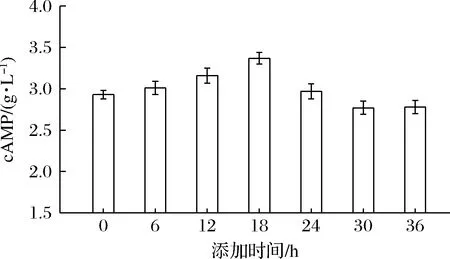
图1 槲皮素添加时间对cAMP发酵生产的影响Fig.1 Effects of quercetin addition time on cAMP fermentation in shake flasks
2.2 槲皮素提高次黄嘌呤转化率和cAMP发酵性能
在7 L发酵罐上进行添加12 mg/L槲皮素的cAMP发酵实验,对能够反映发酵性能的主要参数进行测定和计算,结果如图2所示。添加槲皮素批次的cAMP产量达到5.33 g/L,比对照提高了33.92%,产物合成得到显著提高。两批次中cAMP合成速率均呈现先升后降的变化规律,在发酵18~50 h,添加槲皮素批次的合成速率相比于对照具有显著的提高,36 h提高幅度达到46.53%(图2-c)。然而,由于槲皮素的添加,分别作为碳源和前体的葡萄糖与次黄嘌呤的消耗量却都有一定程度的减少,尤其是次黄嘌呤消耗量比对照减少了0.57 g/L,表明利用补救途径发酵合成cAMP时,槲皮素促进了葡萄糖和次黄嘌呤向产物的转化。图2-d是次黄嘌呤转化率的计算结果,与对照相比,18 h添加槲皮素后,次黄嘌呤转化率得到明显提高,36 h转化率达到3.03 g/g,提高了29.92%,表明槲皮素显著提高了次黄嘌呤的转化率,使更多次黄嘌呤通过补救途径用于cAMP合成,其他代谢途径受到抑制,减少了次黄嘌呤的浪费。
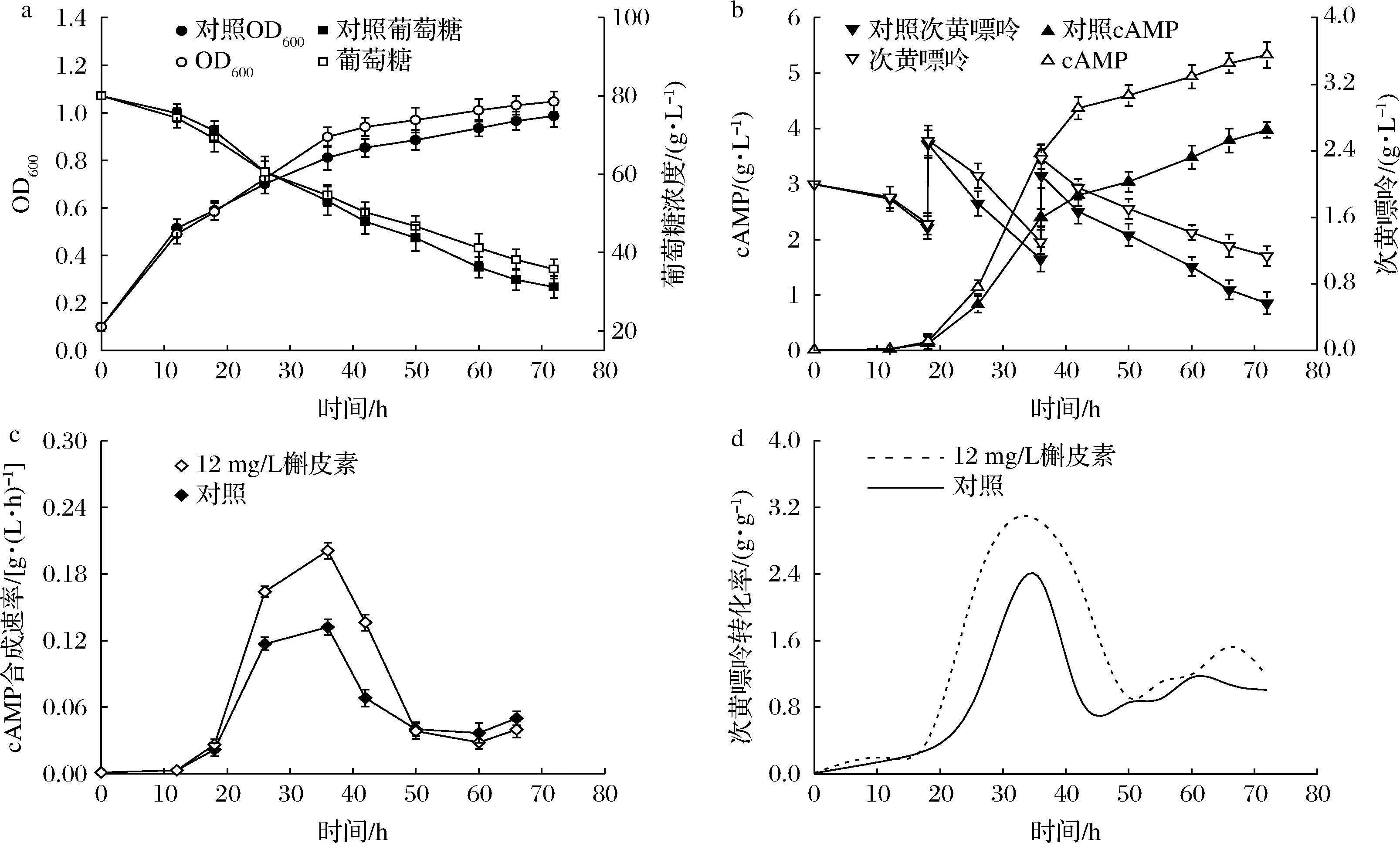
a-600 nm下吸光度及葡萄糖浓度;b-cAMP及次黄嘌呤浓度;c-cAMP合成速率;d-次黄嘌呤转化率图2 槲皮素对cAMP发酵整体性能的影响Fig.2 Effects of quercetin on cAMP fermentation performance conducted in a 7 L bioreacter
尾气中CO2含量与细胞呼吸代谢直接相关,反映了细胞呼吸代谢的强弱。如图3所示,两批次中CO2含量和细胞活性均呈现先升后降的趋势,发酵18 h后,与对照相比,添加槲皮素批次的CO2含量与细胞活性均得到显著提高,表明槲皮素能够一定程度上提高菌体活性和呼吸代谢水平,有利于cAMP的高效合成。
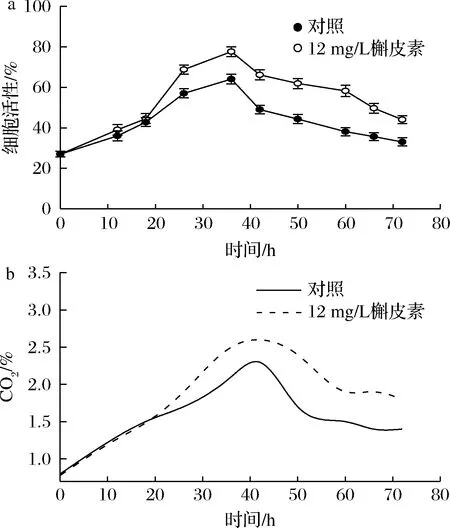
a-细胞活性;b-CO2含量图3 槲皮素对细胞活性及尾气中CO2含量的影响Fig.3 Effects of quercetin on cells viability and CO2 contents
2.3 槲皮素对cAMP合成途径中关键酶活性的影响
XOD能够分解次黄嘌呤形成尿酸并释放ROS,造成次黄嘌呤损失,降低转化率,还会影响细胞代谢活性[15]。如图4-a所示,槲皮素有效抑制了XOD活性,发酵50 h时XOD活性仅为对照的29.15%,这就解释了添加槲皮素批次中次黄嘌呤转化率、细胞活性及CO2含量等提高的原因。G6PDH是磷酸戊糖途径中的关键酶,酶活性强弱直接反映戊糖磷酸途径的代谢强度。如图4-b,与对照相比,槲皮素显著提高了G6PDH活性,36 h时G6PDH活性提高17.68%,更多的碳流分配到磷酸戊糖途径,为产物合成提供物质基础。sAMPase和AC是cAMP合成的关键酶,直接影响cAMP合成。测定结果表明,与对照相比,添加槲皮素批次的sAMPase和AC活性均得到显著提高,36 h分别达到4.07和4.60 U/mg,比对照分别提高43.81%和33.89%。这表明槲皮素有效抑制了XOD的活性,减少了次黄嘌呤的无效损耗,同时使更多碳流进入磷酸戊糖途径,进而有效促进cAMP合成。
2.4 槲皮素对代谢副产物尿酸合成的影响
发酵液中尿酸含量变化反映了次黄嘌呤经XOD分解的情况。对添加槲皮素批次发酵液中尿酸含量进行测定。如图5所示,18 h添加槲皮素后,尿酸合成速率明显下降,积累量明显低于对照批次,终浓度仅为对照的63.75%。表明槲皮素抑制XOD活性,减少了次黄嘌呤的分解,大幅降低副产物尿酸合成,进而提高了次黄嘌呤的转化率。
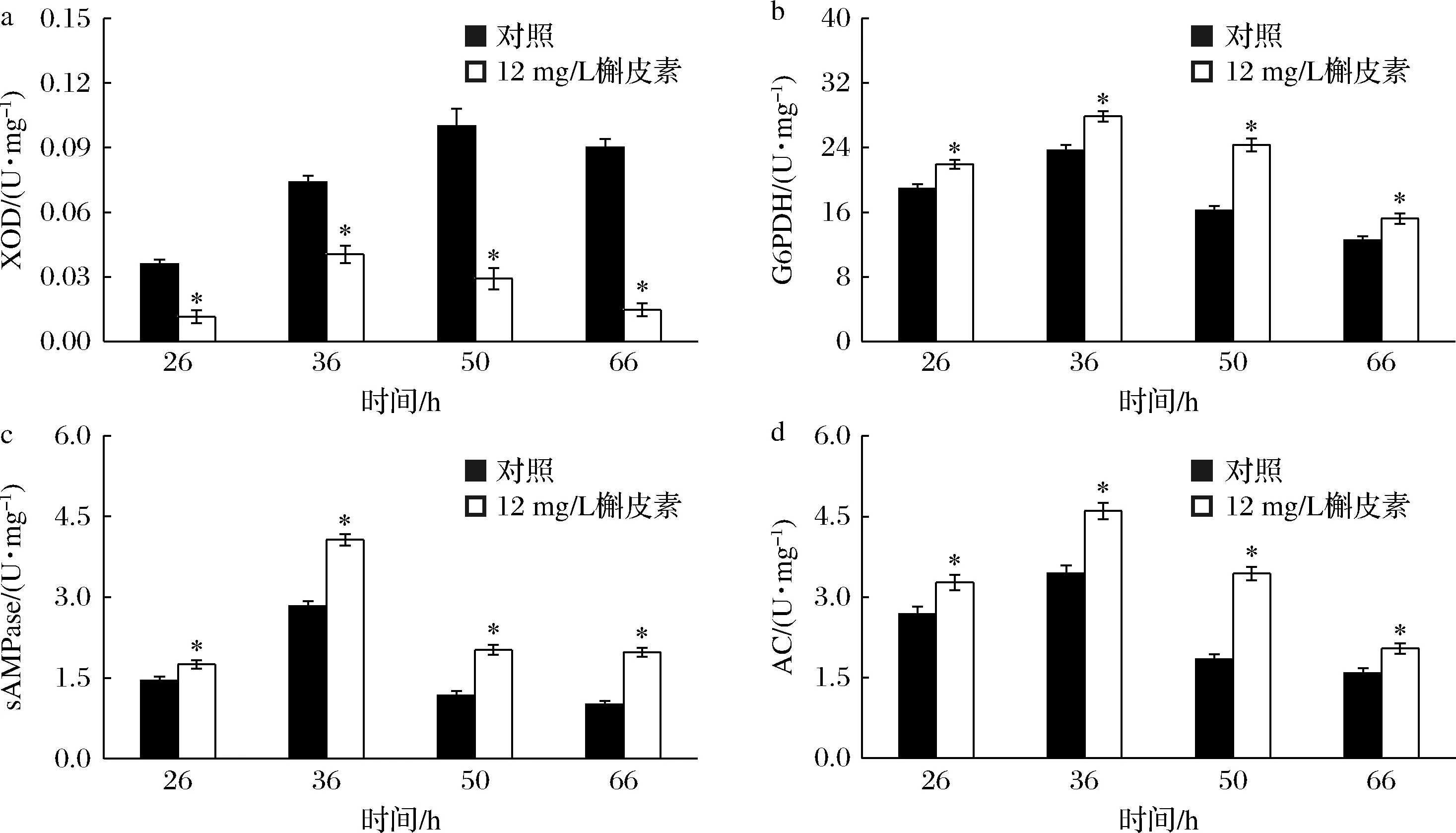
a-XOD活性;b-G6PDH活性;c-sAMPase活性;d-AC活性图4 槲皮素对cAMP合成相关途径中关键酶活性的影响Fig.4 Effect of quercetin on activities of key enzymes presented in cAMP biosynthesis pathways 注:*表示与对照相比差异极显著(P<0.01)(下同)
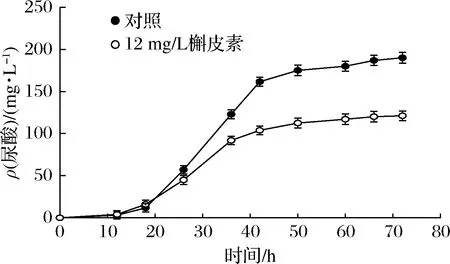
图5 槲皮素对发酵液中尿酸含量的影响Fig.5 Effect of quercetin on uric acid contents in fermentation broth
2.5 槲皮素对细胞内ROS和MDA水平的影响
XOD分解次黄嘌呤过程中,伴随ROS大量产生。ROS积累会对细胞组分造成损伤,导致蛋白质构象发生改变,细胞膜脂质过氧化,引起细胞代谢功能障碍甚至死亡[16]。MDA含量反映了细胞膜过氧化程度。ROS和MDA的测定结果如图6所示。整个发酵周期内,添加槲皮素批次的ROS和MDA含量均明显低于对照批次,36 h ROS的荧光强度和MDA含量分别为对照批次的63.92%和76.38%。表明槲皮素抑制了XOD活性,减少了ROS生成和细胞成分损伤,提高了细胞代谢活性,促进了产物合成。
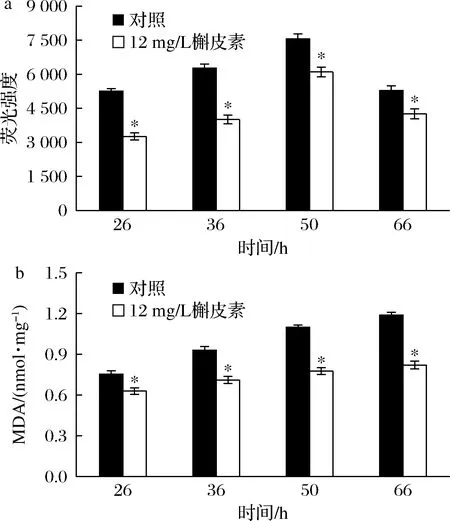
a-ROS荧光强度;b-MDA含量图6 槲皮素对ROS、MDA含量的影响Fig.6 Effect of quercetin on intracellular ROS and MDA contents
2.6 槲皮素对抗氧化酶活性的影响
氧化胁迫条件下,微生物会大量生成SOD与CAT,消除过量ROS,维持胞内氧化还原平衡[17]。对添加槲皮素批次的SOD及CAT进行测定,结果如图7所示。添加槲皮素批次的SOD和CAT活性明显低于对照批次,36 h时2种酶活性分别为对照的84.75%和75.10%。这表明槲皮素有效减少了胞内ROS的合成与积累,降低了氧化胁迫水平,仅需要较少的抗氧化酶即可维持氧化还原平衡。
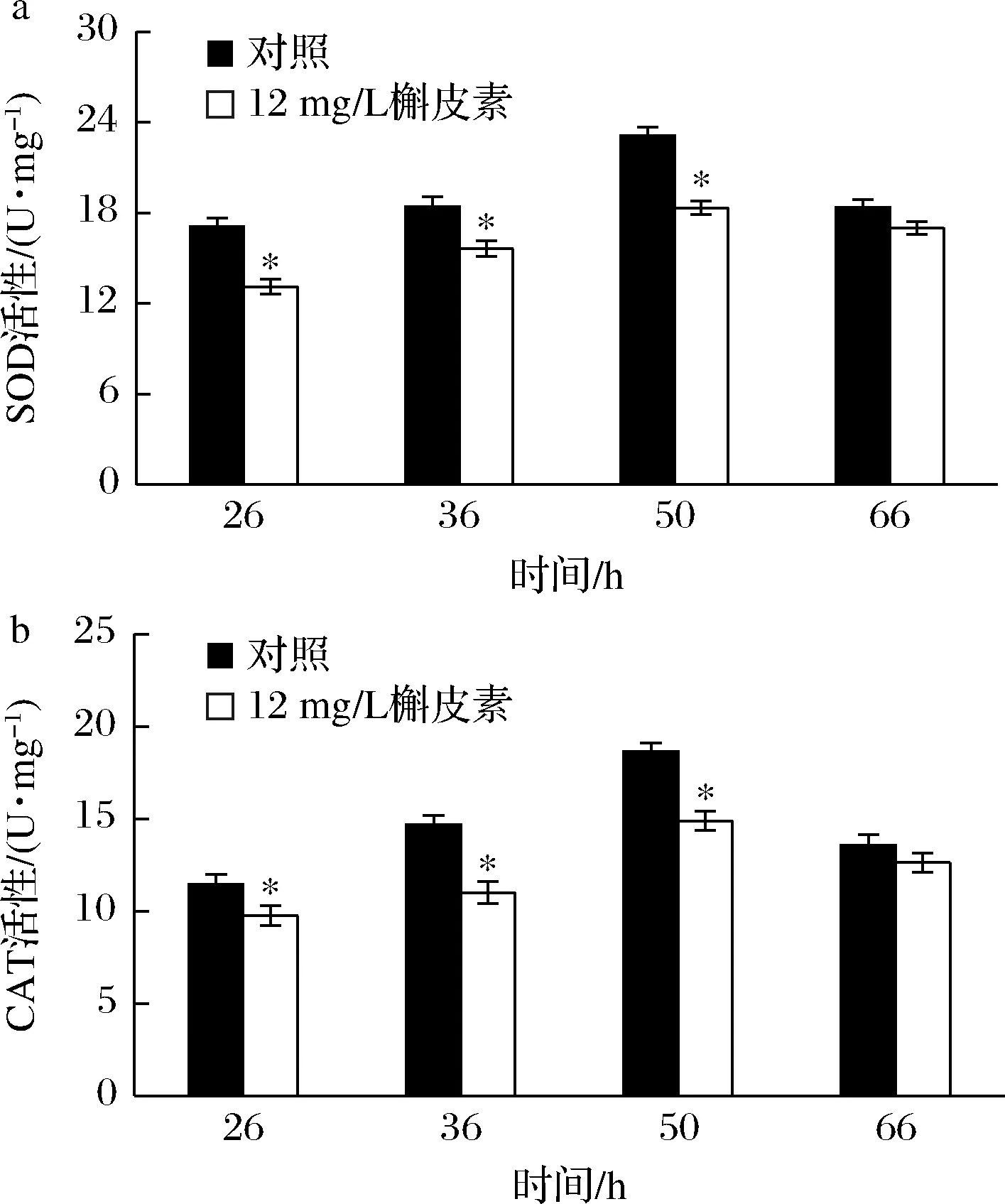
a-SOD活性;b-CAT活性图7 槲皮素对SOD和CAT活性的影响Fig.7 Effect of quercetin on intracellular SOD and CAT activities
3 结论
通过添加12 mg/L槲皮素,cAMP产量达到5.33 g/L,与对照相比提高了33.92%,同时次黄嘌呤转化率也得到明显提升,发酵性能得到显著提高。关键酶活性分析结果表明,槲皮素有效抑制XOD的活性,减少了次黄嘌呤的分解,G6PDH、sAMPase与AC活性均得到显著提高,更多碳流分配到磷酸戊糖途径用于产物合成,副产物尿酸含量的显著减少也表明次黄嘌呤的分解得到有效抑制。ROS、MDA以及抗氧化酶活性的测定结果表明,槲皮素抑制XOD的活性,显著降低了ROS含量,缓解氧化胁迫对细胞组分造成的损伤,同时增强细胞活性,使cAMP产量得到显著提升。