鸡骨香乙醇提取物舒张小鼠气道平滑肌的作用机理研究
2022-04-18姚凤杰曾晓月沈金花
姚凤杰, 曾晓月, 沈金花
(中南民族大学生命科学学院, 医学生物研究所&武陵山区特色资源植物种质保护与利用湖北重点实验室, 武汉 430074)
哮喘,是一种常见的气道异质性的慢性炎症疾病,通常会导致可变的气道阻塞[1]. 气道平滑肌是调节气道阻力的关键组织,其反应过度并产生收缩是哮喘的主要特征[2]. 气道平滑肌的收缩反应与Ca2+浓度相关,其收缩依赖于细胞内Ca2+浓度的升高[3]. 而收缩性激动剂可以激活气道平滑肌细胞膜表面受体和气道平滑肌细胞内Ca2+相关通道进而导致细胞内Ca2+浓度升高,引起气道平滑肌收缩[4]. 因此,可根据哮喘的发病机理设计实验,研究药物的抗收缩性,从而进一步研究药物对哮喘的作用.
近年来,由于环境的因素,全球范围内哮喘的发病率正持续上升. 然而,目前常用的支气管扩张药物的治疗效果有限,且副作用较多, 因此亟待开发更有效、副作用更小的哮喘治疗药物. 越来越多的证据表明,抗炎中药对哮喘患者具有良好的治疗效果,且中药具有作用温和、副作用少等优点,开发具有抗炎特性的中药用于治疗哮喘,可能成为抗哮喘药物创新的有效途径[5]. 本课题组通过已有文献和预实验筛选出鸡骨香(CrotoncrassifoliusGeisel),将其提取成分通过张力测量和膜片钳技术等体外实验,呼吸阻力测量等活体实验探究其作用机理,试图开发出一种安全有效的中药来抑制气道平滑肌的异常收缩,从而缓解哮喘.
鸡骨香为大戟科,巴豆属植物,味辛、苦,以根入药,主要分布于我国西南地区,常用于治疗咽喉肿痛、关节炎、胃炎等疾病[6]. 鸡骨香具有抗炎、抗肿瘤等作用,其化学成分包括萜类、挥发油类、甾醇类等[7]. 二萜类成分为鸡骨香的主要化学成分,其中克罗烷型二萜chettaphanin Ⅰ、3S-methoxyl-teucvin等都具有抗炎活性[8-9]. 目前国内外对鸡骨香的药理研究仍然有限,到目前为止,尚无有关鸡骨香中的特定成分具有抑制小鼠气道平滑肌收缩潜力的文献报道. 并且有研究表明,鸡骨香乙醇提取物(ethanol extracts fromCrotoncrassifoliusGeisel, EECC)具有较好的抗炎镇痛作用[10]. 因此,本文以EECC为研究对象,研究EECC在气道平滑肌中的舒张作用及作用机制,以此探究EECC对哮喘的影响.
1 材料与方法
1.1 实验动物
从辽宁长生生物技术股份有限公司购买的SPF级7~8周雄性BALB/c小鼠120只,许可证号SCXK(辽)2020-0001,饲养于中南民族大学实验动物中心,动物实验均按照中南民族大学动物伦理委员会的要求进行,许可证号为2016-SCUEC-AEC-0030.
1.2 材料和仪器
鸡骨香药材于2019年9月采自广东湛江市草药药材基地(湛江市属于热带季风气候,年均气温为23 ℃. 草药药材基地位于湛江红壤分布区,此区土壤呈酸性,地理坐标为110°30′ N, 21°20′ E),共采集5 kg,经中南民族大学生命科学学院刘虹副教授鉴定为鸡骨香的根茎. 将采集的鸡骨香根部清洗、烘干、粉碎,干粉在4 ℃冰箱密封储存备用;氯化乙酰胆碱(ACh)(上海源叶);乙醇、二甲基亚砜(国药集团);牛血清蛋白(BSA)、Pyrazole 3(Pyr 3)、Gadolinium、硝苯地平(Nifedipine)(Sigma公司).
高钾溶液、2 mmol·L-1Ca2+-PSS(PSS)、0 mmol·L-1Ca2+-PSS、Li-PSS溶液、电极内液、细胞外液、木瓜蛋白酶溶液、胶原蛋白酶溶液,参考文献[11]配置.
中草药粉碎机(天津市秦斯特仪器);BL-420S生物机能实验系统、HV-4型离体组织器官恒温灌流系统(成都泰盟科技);IX51膜片钳显微镜(日本OLYMPUS);EPC-10膜片钳放大器(德国HEKA);小动物肺功能仪(SCIREQ Inc.,Montreal,Canada).
1.3 鸡骨香乙醇部提取物的制备
称取鸡骨香粉1 kg,在室温下浸泡于体积分数为95%的乙醇溶液中7 d,固液比为1∶10. 7 d后将上清液真空抽滤得滤液,滤液旋转蒸发得乙醇浸膏. 将提取的鸡骨香乙醇部放置于真空干燥箱中保存备用,实验时,将EECC溶解于二甲基亚砜.
1.4 小鼠气管环的获取与处理
用颈椎脱臼法处死实验小鼠,取出肺与气管,放置于冰浴的PSS溶液中. 在体视显微镜下清除主气管周围多余组织,剪取气管三角区附近长约6 mm的主气管. 将主气管用两个边长约7 mm的三角钩固定住,悬挂到张力换能器上,把主气管初始前负荷调节到300 mg左右并持续15 min,PSS溶液每15 min更换一次,重复4次. 待4次平衡结束,使用100 μmol·L-1ACh或80 mmol·L-1高钾溶液对主气管进行预刺激,待主气管充分的收缩后,再用PSS溶液洗脱使其恢复至基线[11]. 主气管在基线状态下休息25 min后再开始正式实验(每个实验结果均重复6次,即随机选用6只小鼠做实验).
1.5 小鼠气道平滑肌细胞的制备
将气管和肺固定于盛有冰浴解离液的胶板上,清除支气管和主气管上的多余组织,剪除软骨环,获取平滑肌肌条. 将肌条置于37 ℃预热的木瓜蛋白酶溶液中消化21 min,然后将肌条转移到37 ℃预热的胶原蛋白酶溶液中消化3 min,再用冰浴的BSA溶液清洗肌条两次,最后将肌条转移到含400 μL BSA溶液的EP管中,用力弹EP管使肌条分散成单个细胞,置于4 ℃冰箱备用.
1.6 VDLCCs电流的记录
利用膜片钳系统,采用步阶式刺激方式作用于急性分离的单个气管平滑肌细胞,通过全细胞记录方式来记录L型电压依赖性钙通道(L-type voltage dependent calcium channels, VDLCCs)电流(实验分为两组,每组6只小鼠).
1.7 小鼠呼吸系统阻力(respiratory system resistance,Rrs)的测量
首先给实验小鼠称重,然后根据体重皮下注射1%的戊巴比妥钠使其麻醉. 深度麻醉小鼠后,在小鼠的气管上用剪刀开一个小的“T”型开口,并插入专用插管. 手术后的小鼠通过插管连接肺功能仪,利用雾化头给药,使用不同浓度的ACh升高小鼠Rrs,测量药物对小鼠Rrs的影响,从而反映药物的作用(实验分为两组,每组6只小鼠).
1.8 统计学方法

2 结果与分析
2.1 EECC对高钾诱导的小鼠气道平滑肌收缩的舒张作用
在气道平滑肌中,必须通过多种机制严格调控胞内Ca2+的浓度,以维持适当的气道通畅性[12]. 高钾可以诱导VDLCCs开放,使胞外Ca2+通过VDLCCs进入细胞内,胞内Ca2+浓度升高,导致气道平滑肌反应过度,发生收缩. EECC能够以剂量依赖的方式完全舒张由高钾诱导预收缩的小鼠主气管,并达到最大舒张值(图1A). 重复6次实验,结果一致,平均最大舒张比值为(102.12 ± 0.05)%,小鼠主气管100%舒张时EECC的浓度为0.129 mg·mL-1(图1B). 加入10 μmol·L-1Nifedipine(VDLCCs通道的特异性阻断剂)可以完全抑制由高钾诱导的小鼠主气管的收缩(图1C). 而EECC并不影响静息状态下的正常的主气管(图1D). 实验结果表明:EECC以剂量依赖的方式抑制了高钾诱导的小鼠主气管的收缩,并且VDLCCs可能参与了该过程.
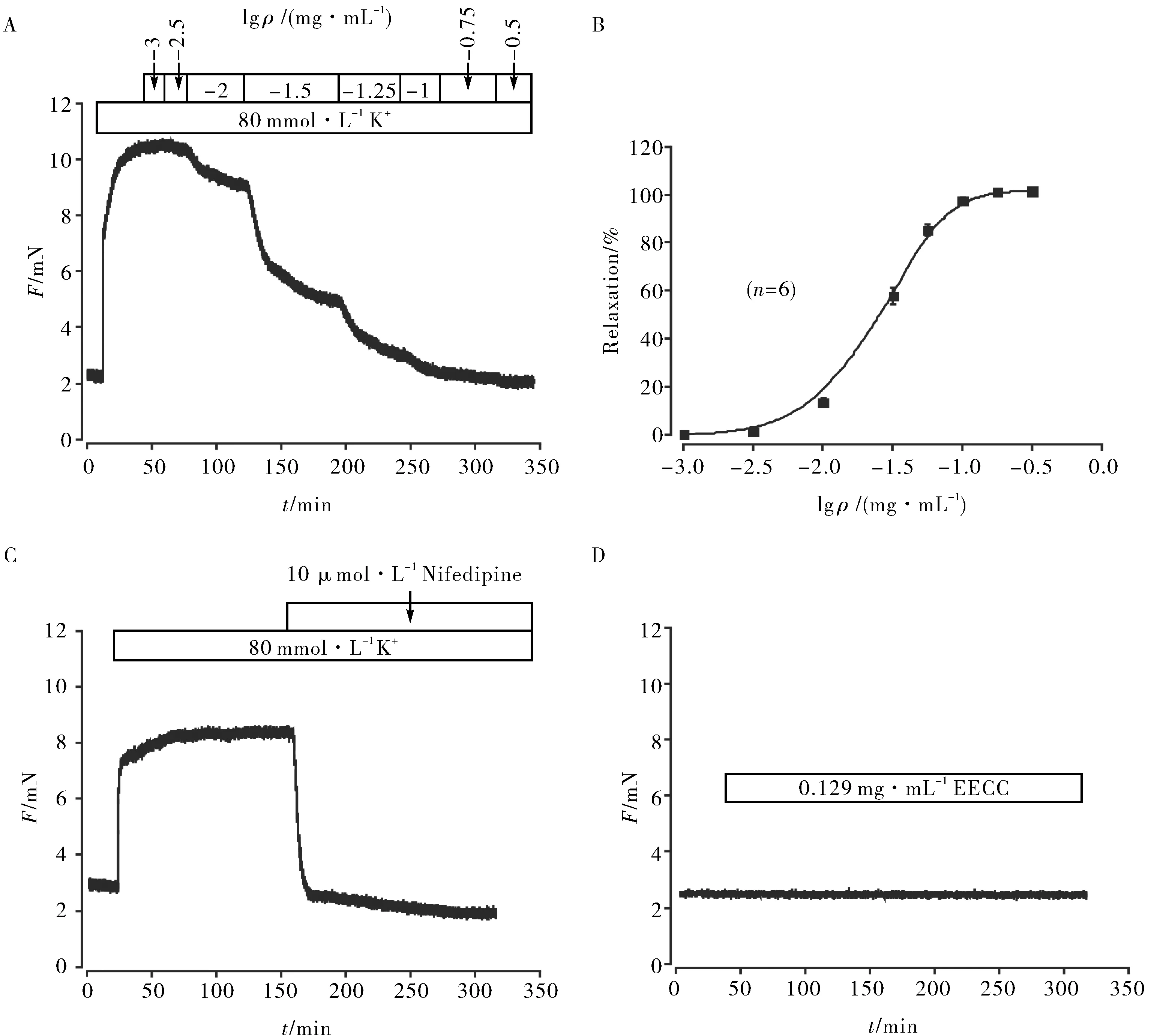
A.EECC以剂量依赖的方式完全舒张高钾诱导收缩的主气管;B.EECC舒张高钾诱导收缩的主气管的量效曲线(n=6);C.10 μmol·L-1 Nifedepine完全舒张高钾诱导收缩的主气管;D.EECC对静息状态下的正常的主气管无影响A.EECC completely relaxed the main trachea induced by high potassium in a dose-dependent manner; B.Dose response curve of EECC in relaxing the main trachea induced by high potassium (n=6);C.10 μmol·L-1 Nifedepine completely relaxed the main trachea induced by high potassium; D.EECC had no effect on the normal main trachea at rest图1 EECC对高钾诱导预收缩的小鼠气道平滑肌的舒张作用Fig.1 Relaxation effect of EECC on mouse airway smooth muscle with high potassium induced pre-contraction
2.2 EECC抑制高钾诱导的外部钙内流
在0 mmol·L-1Ca2+条件下,高钾不能引起主气管收缩,当实验溶液中Ca2+浓度恢复到2 mmol·L-1时,主气管异常收缩,加入0.129 mg·mL-1EECC,预收缩的主气管完全舒张(图2A). 提前孵育0.129 mg·mL-1EECC,实验溶液中的Ca2+浓度由0 mmol·L-1恢复到2 mmol·L-1后,主气管只产生了微弱短暂的瞬时收缩(图2B). 实验结果表明:EECC可以通过抑制VDLCCs,从而抑制外部环境中的Ca2+流入细胞质,舒张高钾诱导预收缩的主气管.
2.3 EECC抑制VDLCCs全细胞电流
为了进一步探讨VDLCCs在EECC舒张气道平滑肌中的作用,采用步阶电压刺激急性分离的单个气道平滑肌细胞,利用膜片钳系统记录VDLCCs全细胞电流. 观察到加入Nifedipine或EECC均可抑制VDLCCs电流(图3A). 用步阶电压(-70 mV~+40 mV)刺激细胞,随着电压逐渐升高,电流先升高后降低,当加入EECC或Nifedipine时,电流被抑制(图3B). 实验结果说明EECC与Nifedipine作用相似,EECC可以通过抑制VDLCCs电流即阻断VDLCCs,从而抑制外部钙内流,舒张气道平滑肌.

A.EECC阻断了高钾所致的钙内流; B.存在EECC的情况下,高钾不能使主气管产生收缩A.EECC blocked calcium influx induced by high potassium;B.In the presence of EECC, high potassium could not cause contraction of the main trachea图2 EECC对高钾引起的外部钙内流的抑制作用Fig.2 Inhibitory effect of EECC on calcium influx induced by high potassium

A.EECC作用于VDLCCs的时间—电流图;B.EECC作用于VDLCCs的电压-电流图A.Time current diagram of EECC acting on VDLCCs; B.Voltage current diagram of EECC acting on VDLCCs图3 EECC阻断VDLCCs电流Fig.3 EECC blocked VDLCCs current
2.4 EECC对ACh诱导的小鼠气道平滑肌收缩的舒张作用
ACh可以激活调控Ca2+的多种离子通道,如非选择性阳离子通道(non-selective cation channels,NSCCs)和VDLCCs等,使外部钙内流和内部钙释放,导致气道平滑肌过度收缩. EECC能够以剂量依赖的方式舒张ACh诱导预收缩的主气管,并达到最大舒张值(图4A). 重复6次实验,结果一致,平均最大舒张比值为(97.21 ± 0.39)%(图4B),此时EECC的浓度为0.562 mg·mL-1.
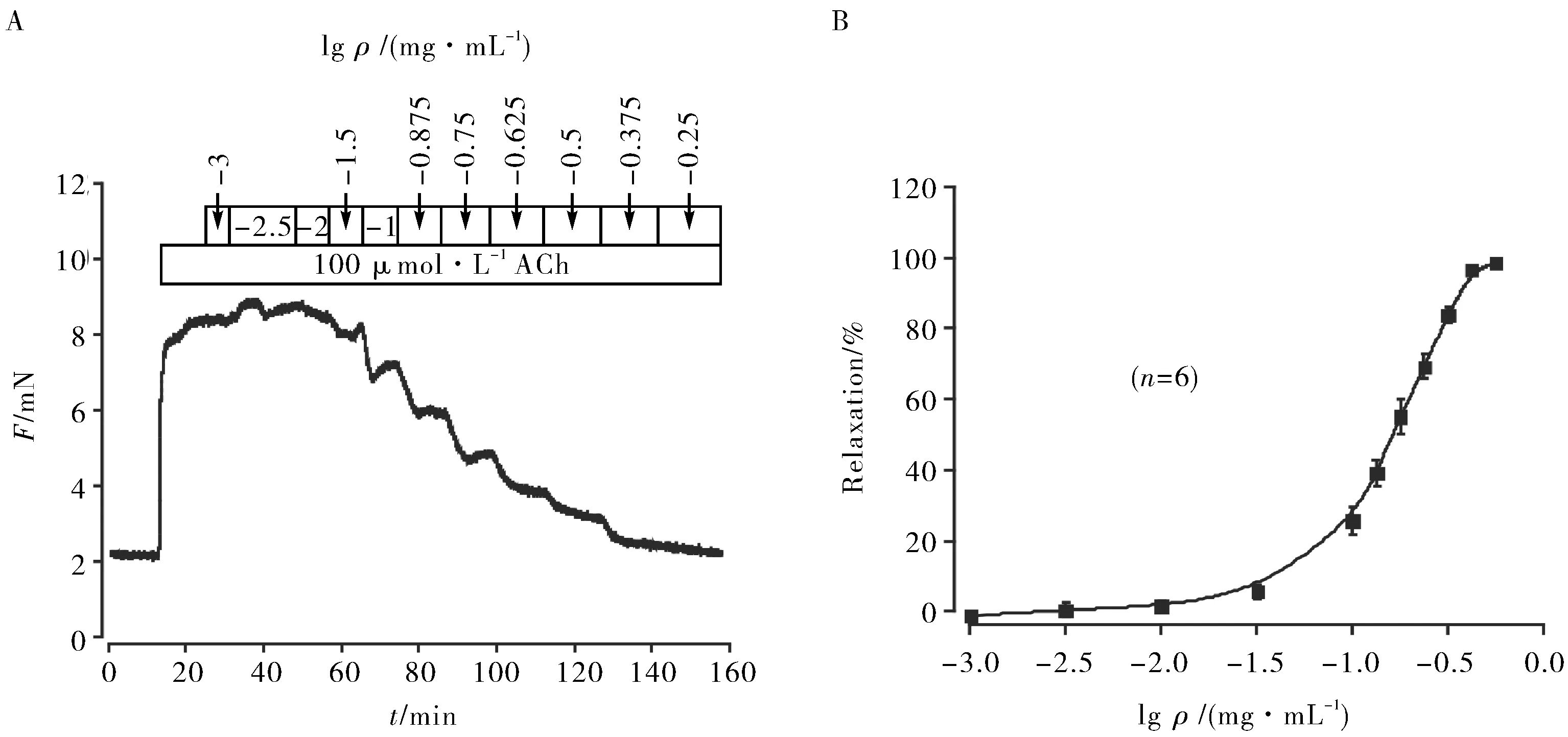
A.EECC剂量依赖地舒张ACh诱导收缩的主气管;B.EECC舒张ACh诱导收缩的主气管的量效曲线(n=6)A.EECC relaxed the main trachea induced by ACh in a dose-dependent manner;B.Dose response curve of EECC in relaxing the main trachea induced by ACh (n=6)图4 EECC对ACh诱导预收缩的小鼠气道平滑肌的舒张作用Fig.4 Relaxation effect of EECC on ACh-induced pre-contraction mouse airway smooth muscle
2.5 排除VDLCCs 后,EECC依然能够舒张气道平滑肌
用高钾诱导小鼠主气管收缩并达到稳定后,加入Nifedipine,小鼠主气管完全舒张,再加入0.129 mg·mL-1EECC,发现小鼠主气管的张力值没有发生变化(图5A). 先用 Nifedipine阻断VDLCCs后,加入高钾,小鼠主气管没有发生收缩,再加入0.129 mg·mL-1
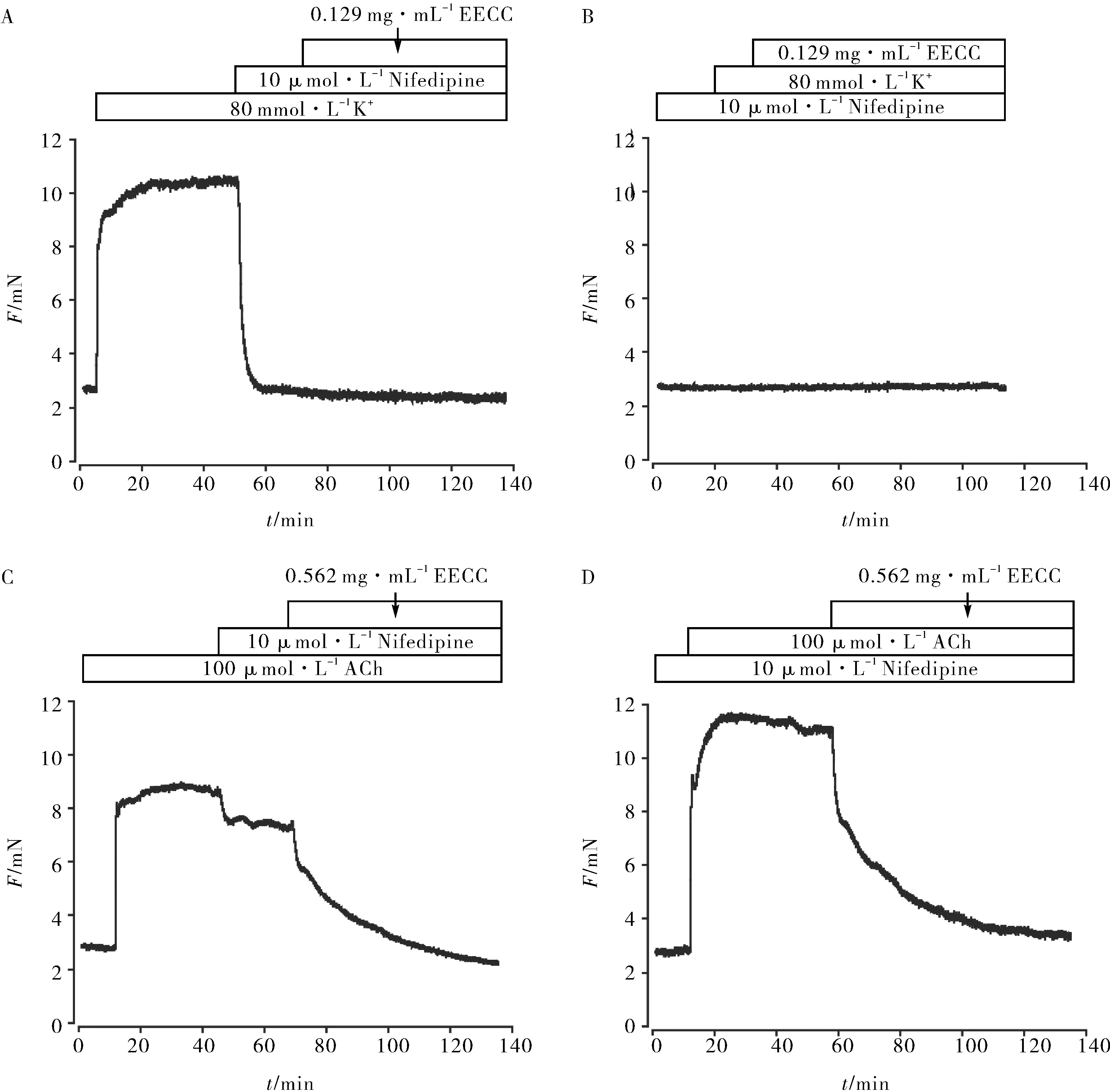
A.10 μmol·L-1 Nifedipine完全舒张主气管后,EECC对主气管的影响;B.提前孵育10 μmol·L-1 Nifedipine,EECC对高钾刺激的主气管的影响;C.10 μmol·L-1 Nifedipine部分舒张主气管后,EECC对主气管的影响;D.提前孵育10 μmol·L-1 Nifedipine,EECC对ACh刺激的主气管的影响A.The effect of EECC on the main trachea was observed after complete relaxation of the main trachea by 10 μmol·L-1 Nifedepine;B.Effects of early incubation with 10 μmol·L-1 Nifedipine and EECC on high potassium stimulated main trachea;C.The effect of EECC on the main trachea was observed after partial relaxation of the main trachea by 10 μmol·L-1 Nifedepine;D.Effects of early incubation with 10 μmol·L-1 Nifedipine and EECC on ACh stimulated main trachea图5 排除VDLCCs后,EECC对ACh诱导预收缩的小鼠气道平滑肌的舒张作用Fig.5 Relaxation effect of EECC on ACh-induced pre-contraction mouse airway smooth muscle without VDLCCs
EECC,小鼠主气管的张力值依然没有变化(图5B). 用ACh诱导小鼠主气管收缩并达到稳定后,加入Nifedipine,小鼠主气管部分舒张,再加入0.562 mg·mL-1EECC,小鼠主气管完全舒张(图5C). 先用 Nifedipine抑制VDLCCs后,再加入ACh,小鼠主气管仍能收缩并达到稳定,该收缩可被0.562 mg·mL-1EECC抑制(图5D). 实验结果说明:EECC可以通过阻断VDLCCs从而使气道平滑肌舒张,并且EECC不仅抑制VDLCCs,还可能通过抑制其它通道从而舒张小鼠气道平滑肌.
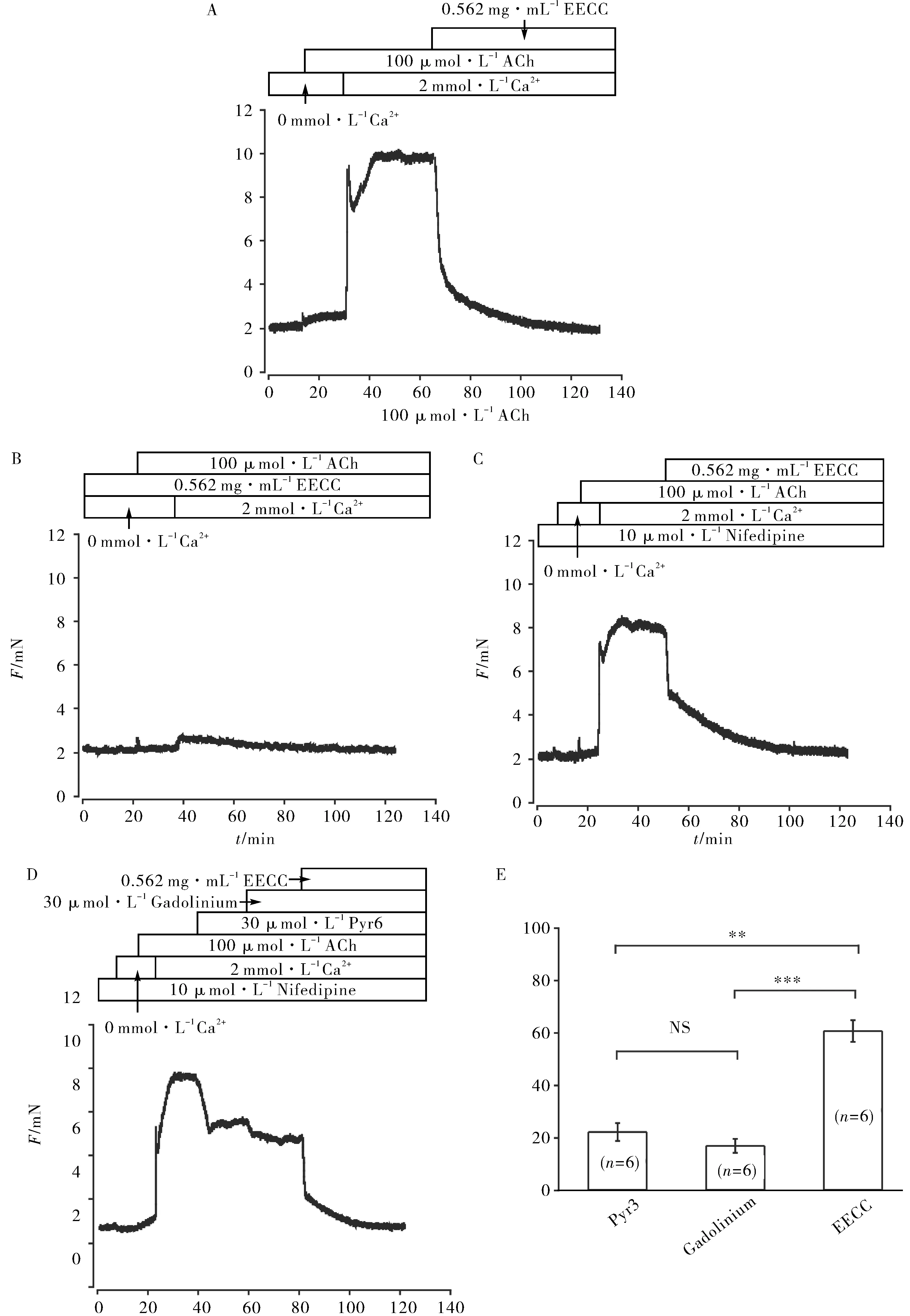
A.EECC阻断了ACh诱导的钙内流;B.孵育EECC可以抑制钙内流引起的主气管收缩;C.排除VDLCCs后,EECC对ACh诱导预收缩的主气管的影响;D.三种不同通道阻断剂作用后,EECC仍能舒张ACh诱导预收缩的主气管;E) Pyr 3,Gadolinium和EECC舒张作用统计图A.EECC blocked the calcium influx induced by ACh; B.EECC inhibited the contraction of main trachea induced by calcium influx;C.Effect of EECC on ACh-induced pre-contracted main trachea after excluding VDLCCs; D.EECC relaxed ACh pre-contracted main trachea after three different channel blockers; E.Statistical chart of relaxation of Pyr 3, Gadolinium and EECC注:*、**、***分别表示p<0.05,p<0.01,p<0.001;NS表示无显著性差异.下图同.图6 EECC对ACh引起的外部钙内流和内部钙释放的抑制作用Fig.6 Inhibitory effect of EECC on ACh-induced external calcium influx and internal calcium release
2.6 EECC抑制ACh诱导的外部钙内流和内部钙释放
在0 mmol·L-1Ca2+条件下,加入ACh,主气管只能产生微弱的收缩,当实验溶液中Ca2+浓度恢复到2 mmol·L-1时,主气管发生持续收缩并达到稳定,加入0.562 mg·mL-1EECC能抑制这种收缩(图6A). 提前孵育0.562 mg·mL-1EECC,即使加入ACh,实验溶液中的Ca2+浓度由0 mmol·L-1恢复到2 mmol·L-1时,主气管也只产生短暂微弱的收缩(图6B). 根据以上结果推测:EECC通过阻断VDLCCs和NSCCs,抑制ACh诱导的内部钙释放和外部钙内流.
为了验证以上推测,首先用Nifedipine阻断VDLCCs. 在0 mmol·L-1Ca2+条件下,加入ACh,主气管只产生了微弱的收缩,当实验溶液中Ca2+浓度恢复到2 mmol·L-1时,主气管发生持续稳定收缩并达到最大收缩值. 直接加入0.562 mg·mL-1EECC,小鼠主气管可以完全舒张(图6C). 依次加入NSCCs中两种TRP通道的特异性阻断剂Pyr 3和Gadolinium,再加入EECC,发现两种阻断剂和EECC各舒张一部分预收缩的小鼠主气管(图6D、6E). 以上实验结果说明:VDLCCs和NSCCs参与ACh引起的气道平滑肌的收缩,EECC可以通过阻断VDLCCs和NSCCs从而抑制内部钙释放和外部钙内流.
2.7 EECC抑制Na+/Ca2+交换
Na+/Ca2+交换体(Na+/Ca2+exchangers,NCX)是一种介导Ca2+内流的重要离子通道,气道平滑肌的基础张力可通过连续调节细胞内Ca2+和Na+浓度来保持[13]. 当实验溶液为含Na+的PSS时,加入ACh,小鼠主气管会收缩,此收缩可以被0.562 mg·mL-1EECC抑制(图7A). 当实验溶液为Li-PSS(用Li+替Na+)致使实验溶液中无Na+时,小鼠主气管的基础张力升高,加入ACh,
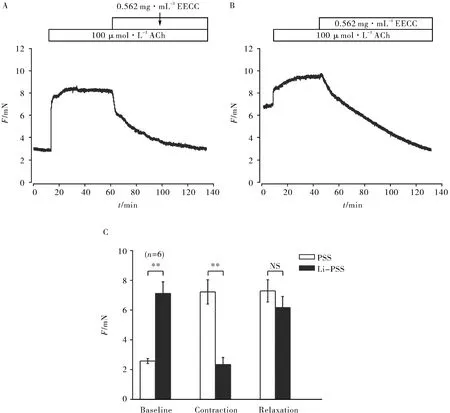
A.EECC抑制ACh引起的主气管收缩;B.EECC抑制Na+/Ca2+交换;C.是A)和B)中的基础张力值、ACh收缩值和EECC舒张值的统计图A.EECC inhibited the contraction caused by ACh; B.EECC inhibited Na+/Ca2+ exchange;C.A statistical map of the basic tension values, ACh contraction and EECC relaxation values in A. and B.图7 EECC对Na+/Ca2+交换的抑制作用Fig.7 Inhibitory effect of EECC on Na+/Ca2+ exchange
小鼠主气管产生收缩,0.562 mg·mL-1EECC可将此收缩舒张到基础张力以下(图7B). 两组实验对比并统计数据可知,小鼠主气管的基础张力及收缩值有显著性差异(图7C). 以上实验说明:EECC可以通过抑制NCX通道,从而抑制ACh引起的气道平滑肌的收缩.
2.8 EECC对组织活性的影响
为了研究EECC对小鼠组织活性的影响,设计以下实验:加入EECC舒张高钾或ACh预收缩的主气管,用PSS洗脱EECC后,再加入高钾或ACh刺激主气管,主气管可以再次收缩并达到稳定(图8A、8C). 经过6次实验统计数据可得,用ACh或高钾刺激主气管前后两次的收缩值具有明显差异(图8B、8D). 实验结果说明:EECC对小鼠组织活性有一定的影响.
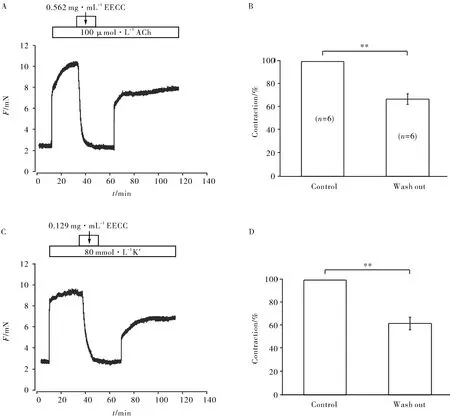
A-B.EECC对ACh预刺激的组织活性的影响(n=6);C-D.EECC对高钾预刺激的组织活性的影响(n=6)A-B.The effect of EECC on tissue activity stimulated by ACh (n=6); C-D.The effect of EECC on tissue activity stimulated by high potassium (n=6)图8 EECC对气管组织活性的影响Fig.8 Effect of EECC on airway tissue activity
2.9 EECC对呼吸系统阻力(Rrs)的影响
上述实验在细胞和组织水平验证了EECC可以舒张小鼠气道平滑肌,为了进一步验证EECC在活体水平上对小鼠影响,设计如下实验:麻醉的小鼠吸入雾化的ACh(浓度梯度为0~50 mg·mL-1),小鼠气管收缩,Rrs升高. 加入5.62 mg·mL-1EECC,利用肺功能仪检测药物对小鼠Rrs的影响. 经6次实验统计数据可得:EECC能够显著降低ACh引起的小鼠Rrs的上升(图9). 实验结果说明:在活体水平上,EECC也可以舒张小鼠气道平滑肌.
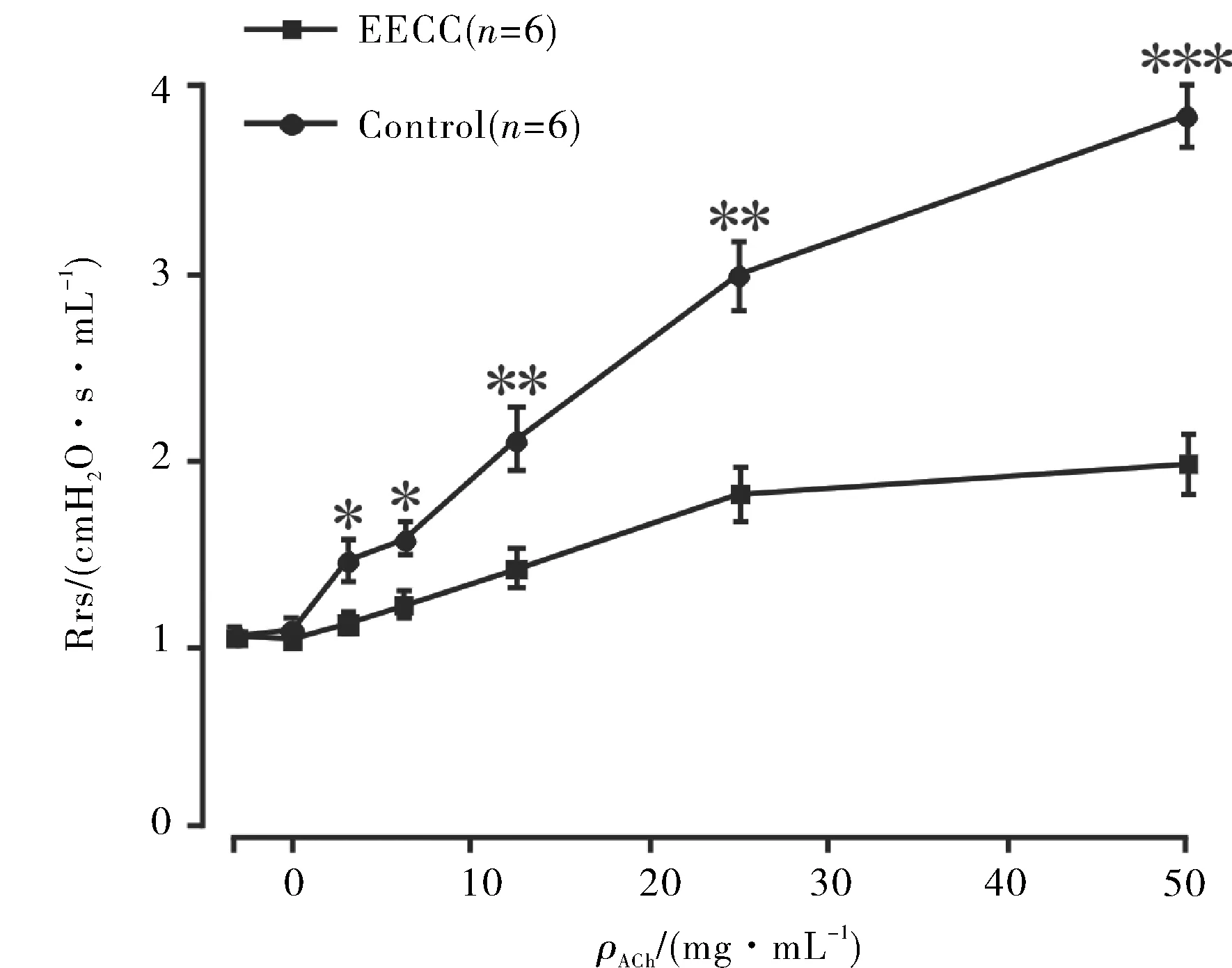
图9 EECC对小鼠呼吸系统阻力的影响Fig.9 Effect of EECC on mouse respiratory system resistance
3 结论
哮喘是一种很难治愈的慢性支气管疾病,病理特征是气道重塑、气道炎症和气道高反应性[14-15]. 由于目前常用的药物无法治愈哮喘并具有一定副作用,因此,通过探究哮喘的发病机制及药物的作用机理来开发用于治疗哮喘的新型药物极其重要. 本文以中药鸡骨香为研究材料,从细胞、组织和活体水平探讨其对气道平滑肌的舒张作用及作用机制.
哮喘的重要症状之一是气道平滑肌的过度收缩[16]. 本文通过实验研究发现EECC以浓度依赖的方式舒张高钾或ACh诱导预收缩的气道平滑肌. 气道平滑肌收缩是一个复杂的电生理过程,涉及多种离子通道,这些离子通道参与调节细胞内Ca2+水平和气道平滑肌舒张与收缩[17]. 组织水平实验发现EECC通过阻断VDLCCs、NSCCs和NCX,抑制高钾或ACh引起的外部钙内流和内部钙释放. 细胞水平实验证明EECC可阻断VDLCCs电流. 活体实验进一步证实EECC能够显著降低小鼠的Rrs. 一系列实验结果表明,EECC具有舒张气道平滑肌的作用. 上述实验结果提示鸡骨香有望成为一种新型的用于治疗哮喘的中药,进一步丰富了防治哮喘的天然药物的研究基础. 本文初步探讨了EECC舒张气道平滑肌的作用机理,但仍可对其进行深入研究:一方面,可以建立哮喘模型深入研究EECC对哮喘相关的炎症因子及蛋白表达的影响;另一方面,可以进一步探究EECC中的化学成分如chettaphanin Ⅰ等对气道平滑肌的舒张作用及作用机制.
