淡水养殖水体细菌群落结构与硝化速率的关系
2022-04-18何梦莹
何梦莹, 熊 英, 程 凯
(湖北工业大学资源与环境工程学院, 河湖生态修复与藻类利用湖北省重点实验室, 武汉 430068)
氮污染是淡水养殖水体中主要污染问题之一,由于饵料投放量大,水产品代谢产物及粪便增多,水体中的氨氮浓度会明显升高[1],而当硝化过程受到抑制时,亚硝氮作为硝化过程的中间产物,可在水体中大量积累,当其浓度超过0.1 mg·L-1时,即会对水产品造成危害[2].
通常,氨的氧化分为两步:亚硝化和硝化.其中,亚硝化是将氨氮转化为亚硝氮,主要是通过氨氧化菌(ammonia-oxidizing bacteria,AOB)及氨氧化古菌(ammonia oxidizing archaea,AOA)等实现的;硝化则是将亚硝氮转化为硝氮,主要是通过亚硝酸盐氧化菌(nitrite-oxidizing bacteria,NOB)等实现的[1].具体而言,Jennifer等[3]通过电子显微及荧光定量PCR技术研究了淡水低温循环养殖系统中的硝化作用,发现起主要硝化作用的细菌是Nitrotoga;而李敬源等[4]通过克隆测序,发现在对虾养殖水体中起硝化作用的细菌是硝化杆菌(Nitrobacter);Papitchaya等[5]采用分子探针技术,发现在养虾池塘中起硝化作用的细菌是硝化螺菌(Nitrospira).
上述研究均采用的是传统的分子生物学技术,而这些技术由于通量很低,往往会低估了养殖水体中细菌的多样性.目前,高通量测序方法越来越受到关注,Sharada等[6]采用高通量测序,在半咸水生物膜反应器中发现硝化速率随硝化细菌的丰度增加而提高;Cai等[7]通过高通量测序,发现生物滤池富集培养物中的硝化作用增强是由亚硝酸盐氧化菌(NOB)及氨氧化菌(AOB)的共同作用所致;而Huepeden等[8]则通过高通量测序发现,循环养殖系统中的硝化作用是由NOB和其他未知的细菌共同作用.目前为止,上述高通量测序的研究都是以富集培养物或工厂化养殖的循环水处理系统为研究对象,而缺乏对无循环系统的淡水养殖水体“原水”的研究.
对此,本文选取了三种养殖品种和管理方式均不相同的常见淡水养殖水体(分别为精养虾蟹池、湖泊养殖水体和精养鱼池),通过高通量测序获得了15个淡水养殖水体的细菌群落结构,并同步测定了水样的硝化速率,有助于深入认识不同养殖水体中细菌群落结构与硝化速率的关系.
1 材料与方法
1.1 水样采集
在本地选择了3类具有代表性的养殖水体,从以下三类养殖水体中取样:A)精养虾蟹池;B)湖泊养殖水体;C)精养鱼池.分别于春季(4月份)及夏季(8月份)采取水样.采用YSI Pro Plus多参数水质检测仪现场测定溶解氧(DO)、pH、温度、电导率、氧化还原电位(ORP),采用塞式盘测量透明度.

表1 各养殖水体类型的基本情况
1.2 水质指标的测定
所采集水样的氨氮、亚硝氮、硝氮、CODMn、总氮、总磷及叶绿素a的测量方法如表2所示.
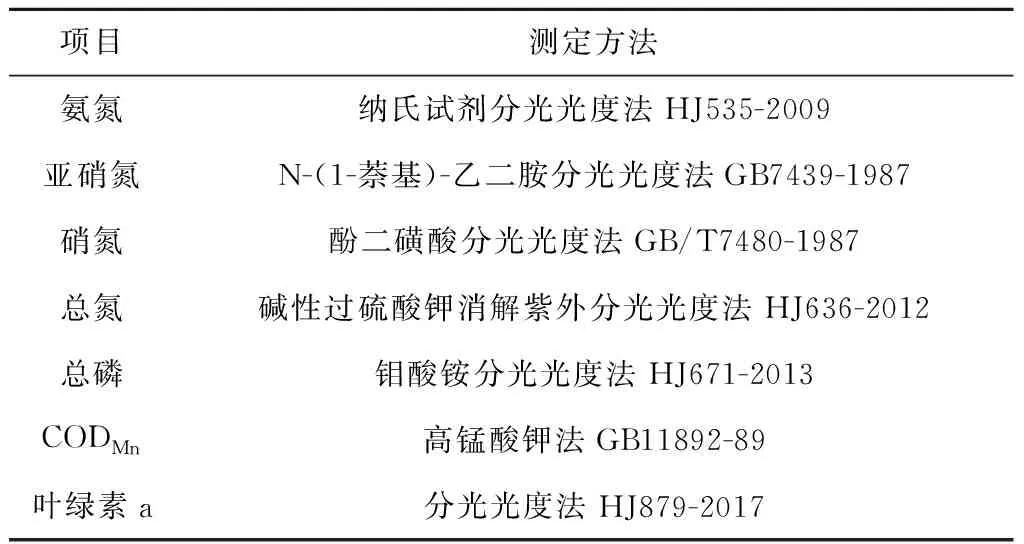
表2 水质测量方法
1.3 总菌数的测定
采集水样后立即加入最终浓度为2%的戊二醛固定,经用2 000目(孔径为8 μm)筛网过滤的水样,取1 mL过滤后的水样,加入SYBR Green I染料[9]使其浓度为1/10 000,放入40 ℃水浴锅遮光加热10 min,在黑暗中冷却到室温,采用BD FACS Calibar Flow Cytometer流式细胞仪(激发光为488 nm)测量BLPs (bacterium-like particles)的数量.
1.4 高通量测序
将所采集的水样,使用HiPure Soil DNA Kit B试剂盒提取DNA,并用Qubit® dsDNA HS Assay Kit检测DNA浓度.
采用上游引物F-CCTACGGRRBGCASCAGKVRVGAAT和下游引物R-GGACTACNVGGGTWTCTAATCC对原核生物16S rDNA的V3和V4区[10]进行PCR扩增[11],PCR产物由江苏金唯智生物科技有限公司测序.序列相似性设为97%,比对的16S rRNA参考数据库是Silva 132.然后用RDP classifier (ribosomal database program)贝叶斯算法对OTU的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成.
1.5 硝化速率测定
水样采集后的24 h内,取100 mL原水至250 mL灭菌锥形瓶中,添加亚硝氮使其初始浓度达到20 mg·L-1,150 r·min-1振荡培养8 d后测定亚硝氮浓度,并据此计算平均硝化速率[12].此外,还在实验终点时测定了硝氮浓度,确认了亚硝氮被转化为硝氮的效率达92%~100%.
1.6 数据处理
采用Microsoft Excel 2016、Origin 2017及SPSS 2.0统计分析数据及作图,用Spearman相关性分析了硝化速率与细菌丰度之间的关系,用t检验分析了水体类型及季节之间的差异.
2 结果与分析
2.1 基本水质情况
各采样点的水质情况见表3.从季节上看,春季的pH、溶解氧、透明度、总氮均高于夏季(p<0.05),而夏季的水温、CODMn则高于春季(p<0.05).从养殖水体类型上看,湖泊养殖水体的电导率和亚硝氮高于另两类水体,而精养虾蟹池塘的透明度则较高.
2.2 细菌群落结构组成
春夏季细菌总数见表3,春夏季总菌数的范围为9.3×105~8.1×106BLPs·mL-1,不同季节和不同水体类型的总菌数均无显著性差异(p>0.05).
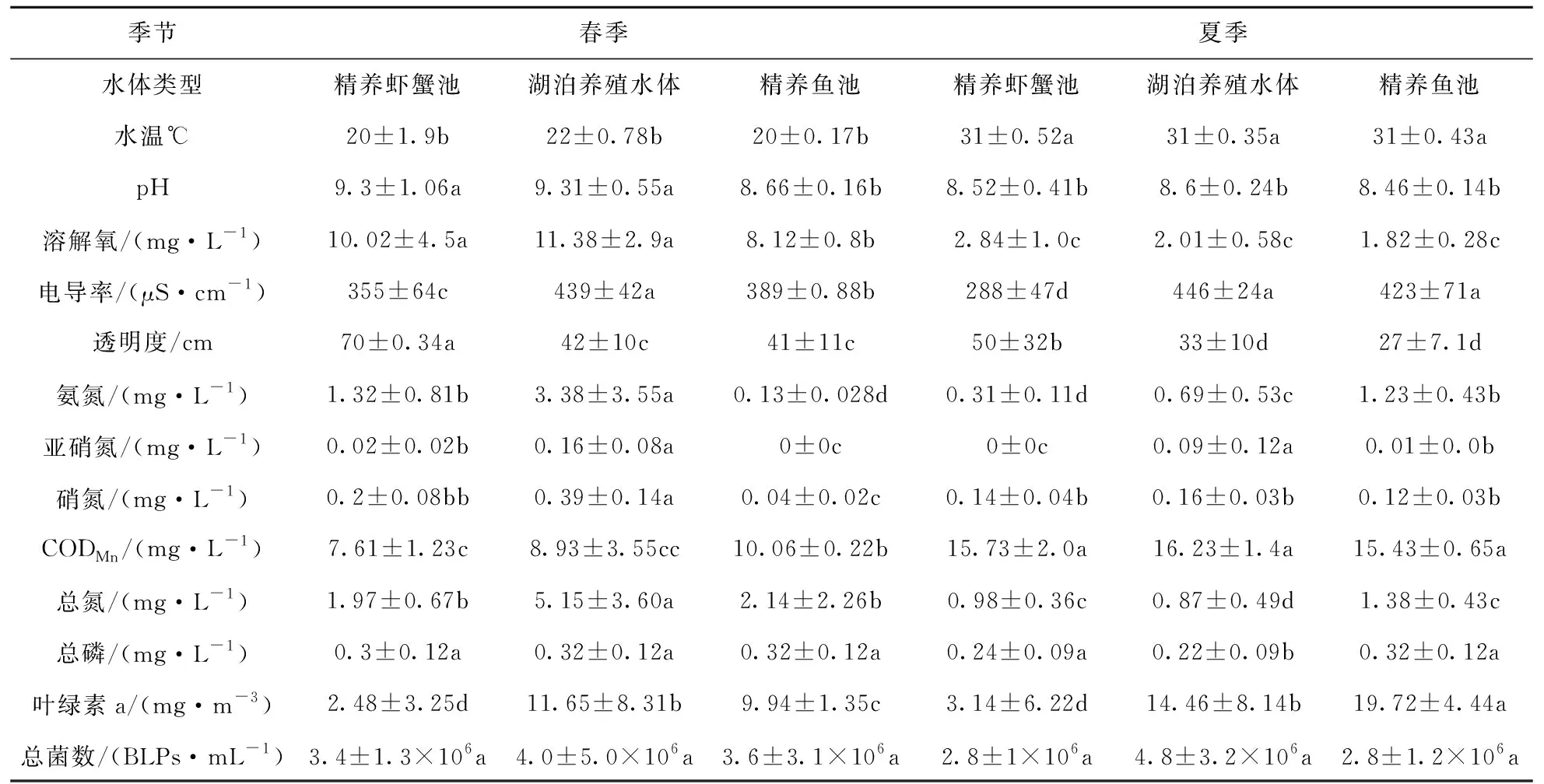
表3 水质情况
养殖水体中的细菌种类涵盖31门,83纲,180目,281科,289属(表4).其中优势菌群门为变形菌门(Proteobacteria,其丰度为22.54%~75.33%)、放线菌门(Acidobacteria,其丰度为11.85%~47.28%)和拟杆菌门(Bacteroidetes,其丰度为17.41%~39.05%),见图1.
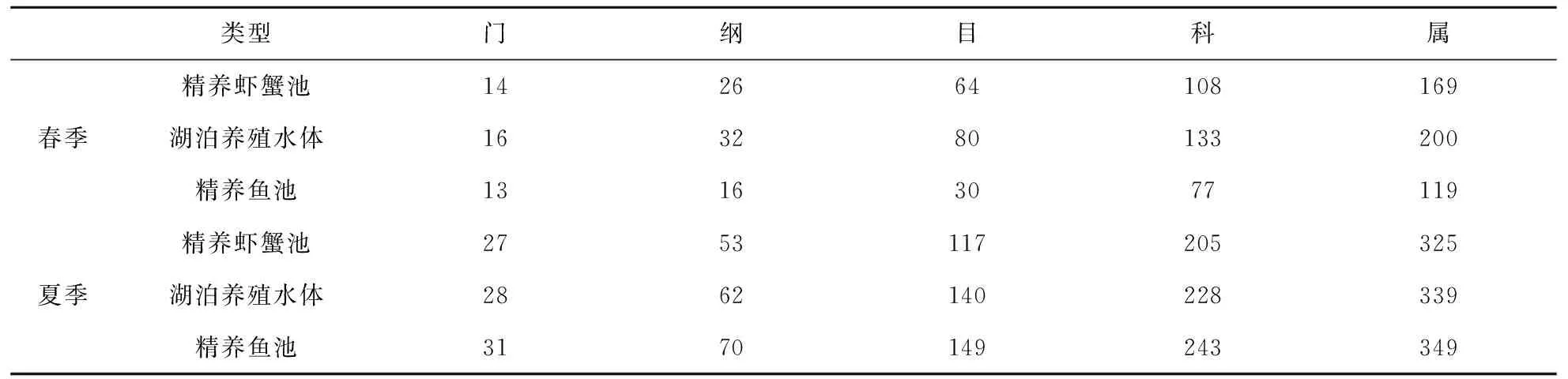
表4 细菌的分类结果
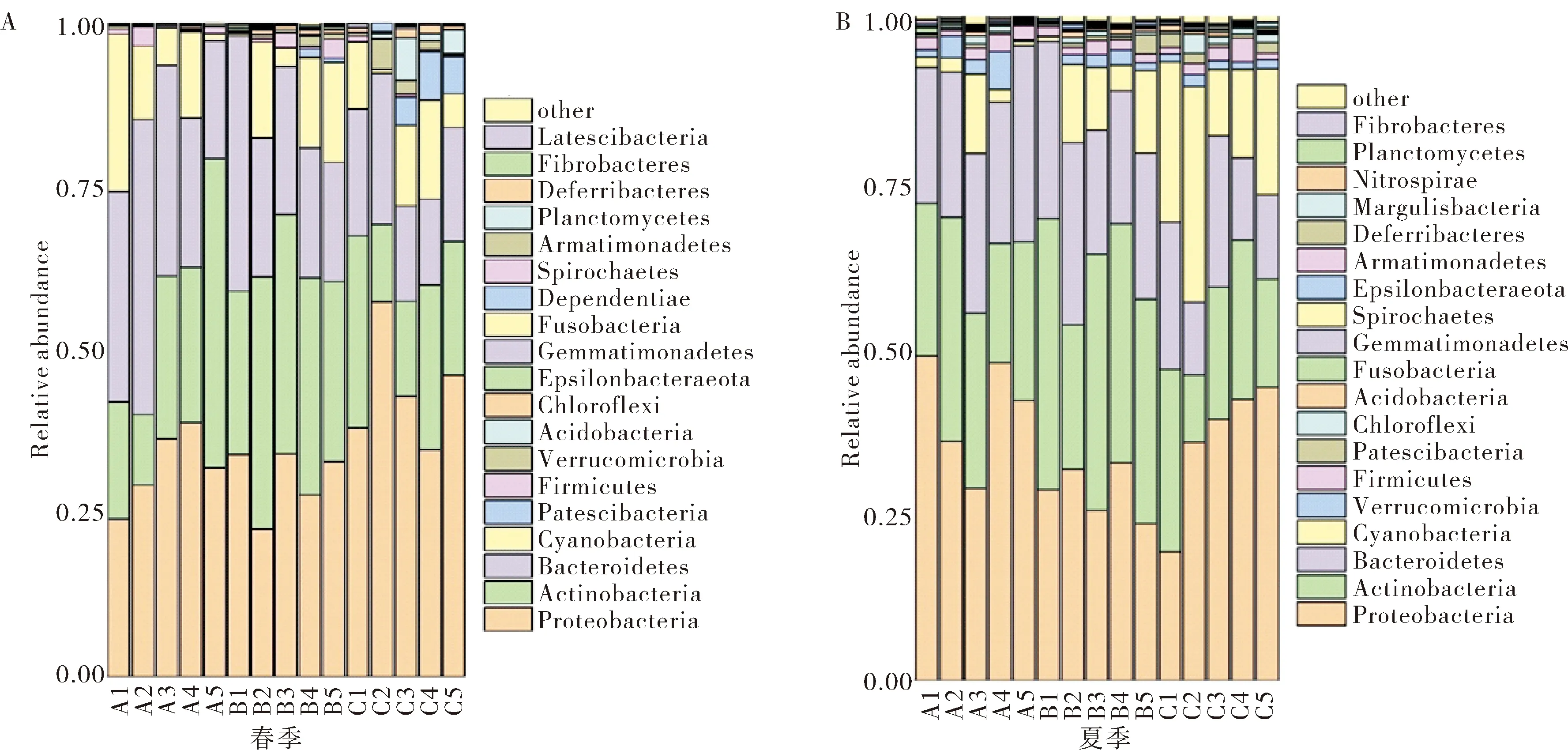
图1 春夏季的优势门Fig.1 The dominant Phylum in spring and summer
从季节上看,春季的主要优势目为β变形杆菌目Betaproteobacteriales(7.70%~30.69%)、黄杆菌目Flavobacteriales(0.48%~28.06%)和Frankiales(0.21%~25.08%).而夏季的主要优势目为β变形杆菌目Betaproteobacteriales(8.16%~30.58%)、Frankiales(9.46%~25.25%)和Chitinophagales(4.47%~8.86%),见图2.
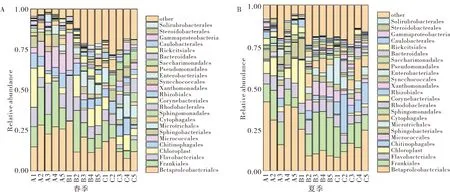
图2 春夏季的优势目Fig.2 The dominant order in spring and summer
春夏季相对丰度排序前30位的属如图3所示,可见两个季节均有超过60%的测序结果无法鉴定到属.从时间上看,两季优势属的差异主要是:春季优势属为栖湖菌属Limnohabitans(0.05%~11.35%)、多核杆菌属Polynucleobacter(0.42%~11.67%)及黄杆菌属Flavobacterium(0.02%~11.36%);夏季优势属则为多核杆菌属Polynucleobacter(1.11%~24.24%)、Candidatus_Aquiluna(0.22%~20.58%)及Acinetobacter(0.03%~13.09%).
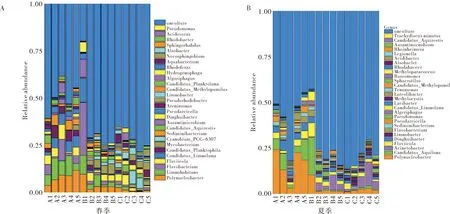
图3 春夏季的优势属Fig.3 The dominant genus in spring and summer
从养殖水体类型上来看,多核杆菌属Polynuclebacter、栖湖菌属Limnohabitans及黄杆菌属Flavobacterium在三种类型水体中均是优势属.其中精养虾蟹池及湖泊养殖水体中的栖湖菌属Limnohabitans及黄杆菌属Flavobacterium丰度显著高于精养鱼池,精养虾蟹池的多核杆菌属Polynucleobacter丰度也显著高于另两类水体.
进一步,在OUT水平上(表5),从时间上看,夏季的ACE指数、Chao1指数及Shannon指数均显著高于春季,说明夏季细菌群落的丰富度及多样性均高于春季.从养殖水体类型上看,春季湖泊养殖水体的ACE指数和Chao1指数均显著高于其他两类水体,夏季则是精养鱼池水体的ACE指数和Chao1指数显著高于其他两类水体.说明春季时,湖泊养殖水体细菌多样性显著高于其他两类水体,夏季时,则是精养鱼池的细菌多样性最高.
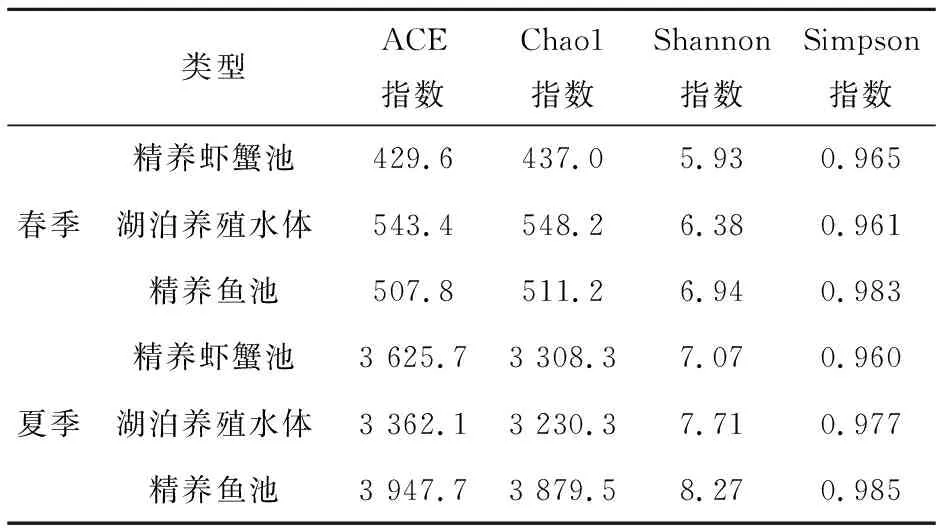
表5 在 OTU 水平上的α 多样性指数
此外,尽管春夏季的NOB平均丰度均较低(低于0.05%),但春季的NOB丰度显著高于夏季(p<0.05).春季NOB主要为Nitrotoga及少量的硝化杆菌,其中:所检出的Nitrotoga的序列与Nitrotogafabula KNB的相似度为99.77%,硝化杆菌的序列与Nitrobactersp. NBW2的相似度为100%.夏季NOB以硝化螺菌为主,仅在湖泊养殖水体中检测到极少的Nitrotoga,其中:所检出的硝化螺菌有两种,分别与Nitrospirasp. clone CK-103及Nitrospirasp. clone 3d_59402的相似度为98.41%及98.44%,而Nitrotoga则与CandidatusNitrotogasp. AM1的相似度为99.54%.
从养殖水体类型上来看,结合总菌数的测定结果,春季时,1 mL水体中精养鱼池的Nitrotoga的菌数(6 157 BLPs)显著高于湖泊养殖水体(780 BLPs)和精养虾蟹池塘(211 BLPs),而3种类型水体中的硝化杆菌数则无显著差异(精养虾蟹池塘104 BLPs,湖泊养殖水体297 BLPs,精养鱼池121 BLPs).夏季时,湖泊养殖水体的硝化螺菌数(211 BLPs)则显著高于精养鱼池(27 BLPs)和精养虾蟹池塘(2 BLPs)(p<0.05).
2.3 硝化速率
各样点硝化速率见表6.从季节上来看,春夏季的平均硝化速率分别为2.24±1.8 μg·L-1·h-1和2.32±2.27 μg·L-1·h-1,二者之间无显著性差异(p>0.05).
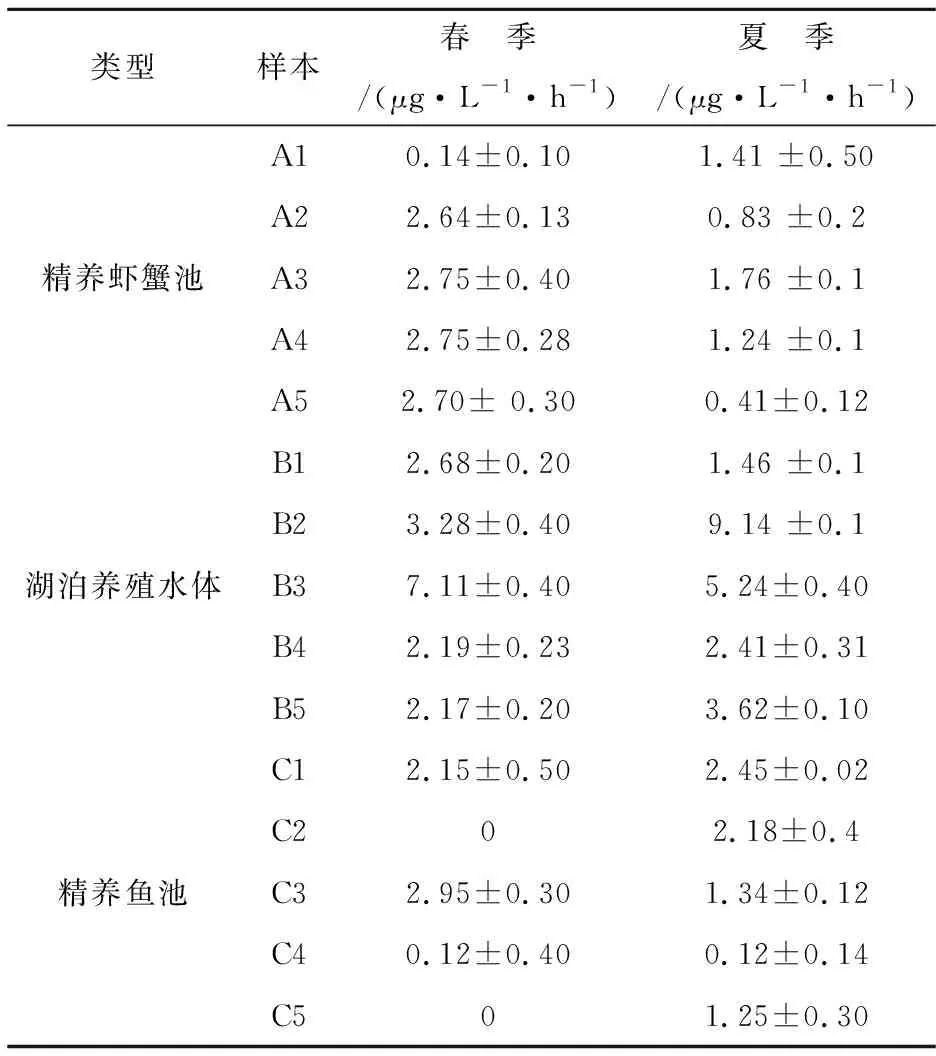
表6 春夏季的硝化速率
从养殖水体类型上看,3种类型水体的硝化速率(图3)存在显著性差异(p<0.05),其中,春夏季湖泊养殖水体的硝化速率均显著高于精养鱼池及精养虾蟹池塘的硝化速率(p<0.05),见图4.

图4 平均硝化速率Fig.4 Average nitrification rate
2.4 细菌群落结构与硝化速率的关系
3种类型的水体中,湖泊养殖水体的硝化速率高于其他两类水体.同时,湖泊养殖水体中的硝化杆菌属的丰度显著高于另两类水体,而黄单胞杆菌目也是湖泊养殖水体中的优势目,其丰度可达1.28%.
如图5、6所示,总菌数与春夏季的硝化速率均呈显著正相关,其中,黄单胞杆菌目Xanthomonadales的丰度(两季的平均丰度分别为1.1%和0.6%)均与春夏季的硝化速率显著正相关(p<0.05).春/夏季时,仅硝化杆菌和硝化螺菌丰度分别与硝化速率显著正相关(p<0.05).

右侧的3个纵轴依次指示硝化杆菌、黄单胞杆菌目和总菌的丰度The three axes at right side indicate the abundance of Nitrobacter, Xanthomonadales and total bacterial count, respectively图5 春季时硝化速率与细菌群落结构的关系Fig.5 Relationship between nitrification rate and bacterial community structure in spring
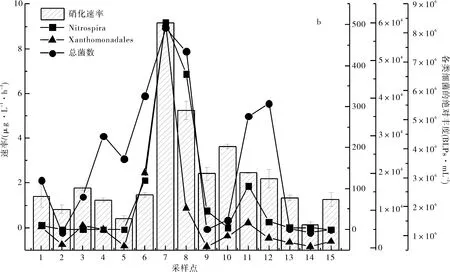
右侧的3个纵轴依次指示硝化螺菌、黄单胞杆菌目和总菌的丰度The three axes at right side indicate the abundance of Nitrospira, Xanthomonadales and total bacterial count, respectively图6 夏季时硝化速率与细菌群落结构的关系Fig.6 Relationship between nitrification rate and bacterial community structure in summer
3 讨论
3.1 养殖水体中的水质情况
本文测得的氨氮、亚硝氮、总氮、总磷等水质指标基本符合我国淡水养殖标准(NY5051—2001),这也与王金毅等[13]在养殖池塘检测的水质状况基本一致.此外,本文测得的总菌数均值为每毫升水体3.6±0.2×106BLPs,这与Del等[14]在养殖水体测得的总菌数相当.
3.2 养殖水体中的细菌群落结构
变形菌门是各类型水体中最丰富菌群,是河流湖泊及海水中的主要菌群[15-16].李倩等[17]在养殖水体中也发现变形菌门为其优势菌群,这与本文观测到结果是一致的.
细菌群落组成受多方面影响,其中水温是影响养殖水体细菌群落结构的重要因子[18].如循环养殖水体的细菌群落丰度和多样性会受水温的显著影响[19],张雅洁等[20]在北海湖也发现春夏季细菌多样性存在显著差异,夏季高于春季,这与本文的观测结果是吻合的(夏季细菌的多样性显著高于春季).
通常,细菌有两种典型的生存策略:K-策略和r-策略.K-策略是指细菌能够适应较低的底物浓度而生长,但生长缓慢,r-策略是指细菌在较高的底物浓度下快速生长[21].其中,硝化杆菌是污水处理系统中的优势NOB,其通常被认为是r-策略者,而硝化杆菌也分布在土壤[22]、沉积物[23]、养殖水体[24-25]及本文所研究的淡水养殖水体等亚硝氮浓度较低的环境中,说明部分硝化杆菌可能会适应低浓度亚硝氮而生长.与硝化杆菌不同,Nitrotoga和硝化螺菌均能在较低底物浓度下生长[26-27],说明其对底物的亲和力较强[12],适合于低浓度亚硝氮环境中生长.淡水养殖水体中的亚硝氮普遍较低,硝化螺菌通常是淡水养殖系统中较常见的NOB[25].类似的,本文发现Nitrotoga和硝化螺菌分别是春季和夏季的优势NOB.
NOB的分布不仅仅受底物浓度的影响,还与水温、溶解氧有关[28-29].本文中,春季的NOB丰度显著高于夏季,说明水温对NOB丰度有显著影响:NOB的丰度随温度升高而降低[30].具体而言,本研究中所观测到的春季NOB优势种Nitrotoga多分布于低温环境中[31-32],其能够分布于0 ℃冰川冻土中[33],甚至是冰下湖泊中能检测到的唯一NOB[34].本文发现,夏季NOB以硝化螺菌为主,而硝化螺菌是唯一已知嗜热NOB[35],其甚至能够分布于温泉等水温较高(但亚硝氮浓度较低)的环境中.
硝化螺菌与其他NOB的区别还在于其能够适应低溶解氧而生长[25,27].相比之下,硝化杆菌则更适于高溶解氧环境[29].本研究中,夏季NOB以硝化螺菌为主,且完全未检出硝化杆菌,可能与夏季较低的溶解氧有关(夏季溶解氧显著低于春季).
3.3 硝化速率与细菌种群结构的关系
有报道指出,硝化杆菌和硝化螺菌与养殖水体中的硝化作用均有关[11,36],类似的,本研究发现硝化杆菌与硝化螺菌的丰度和分别于春/夏的硝化速率呈显著正相关(p<0.05).而且,根据测得的总菌数(9.3×105~8.1×106BLPs·mL-1)和NOB的丰度(0.028%±0.0007%),及已知NOB的硝化速率范围在0.01~23.0 fmol·cell-1·h-1之间[35,37],计算得到NOB所能贡献的硝化速率可达0.08~0.73 μg·L-1·h-1,考虑到测试8天的时间内NOB的生长(NOB的代时多为13 h~54 h[38,39]),将有可能接近或达到实测的硝化速率(2.28±2.02 μg·L-1·h-1).此外,本文发现黄单胞杆菌目在养殖水体中的优势度较高,且其丰度在春夏季均与硝化速率呈显著正相关(p<0.05),故推测如此稀少的NOB不太可能是硝化作用的主力军或是淡水养殖水体中NOB硝化性能远高于已知的NOB.此外,本文发现黄单胞杆菌目是养殖水体中优势度较高的种类,且其丰度在春夏季均与硝化速率呈显著正相关(p<0.05),根据本文中所测得的总菌数及黄单胞杆菌目的丰度(0.85%±0.35%),类比单个硝化细菌的硝化速率,计算得到黄单胞杆菌目可贡献的硝化速率可达2.049 μg·L-1·h-1,这与实际所测得的硝化速率基本吻合(2.23±1.79 μg·L-1·h-1),故推测黄单胞杆菌有可能在硝化过程中发挥了重要作用.尽管目前对于养殖水体中黄单胞杆菌目的硝化性能研究尚未见报道,但Colin等[40]在对污水处理系统中的研究中发现,黄单胞杆菌目中的藤黄色杆菌属(Luteibacteryeojuensis)在自养和异养条件下均表现出了一定的硝化活性.此外,Baskaran等[41]在半咸水中,通过结合高通量测序与基因组功能预测,也推测黄单胞杆菌目中黄单胞杆菌科(Xanthomonadaceae)具有潜在的硝化活性.除了可能直接进行硝化作用外,黄单胞杆菌目的细菌也可能通过某些间接作用而加强硝化活性,如崔丽慧等[42]在好养活性污泥中发现黄单胞杆菌科的细菌可分泌酰基高丝氨酸内酯促进形成菌胶团,而硝化细菌则更适于粘附在生物膜上生长[43],Dong等[44]也发现固定化能够同时提高黄单胞杆菌目的丰度和硝化活性,说明黄单胞杆菌目也有可能通过复杂的菌种间的相互作用而促进硝化.
4 结论
养殖水体中的优势细菌为变形菌门,且夏季细菌多样性显著高于春季.春季的NOB中包括Nitrotoga及硝化杆菌,夏季的NOB丰度显著低于春季,且以硝化螺菌为主.硝化杆菌与硝化螺菌的丰度分别于春季和夏季的硝化速率正相关,而黄单胞杆菌目的丰度则与春夏季的硝化速率均呈正相关.
