猪链球菌临床分离株对利奈唑胺的耐药性及耐药机制研究
2022-04-18杨影影易开放张俊锴罗行炜刘佩仪韩荣嘉胡功政
杨影影,易开放,张俊锴,罗行炜,刘佩仪,韩荣嘉,胡功政
(河南农业大学动物医学院,河南 郑州 450002)
猪链球菌(Streptococcus suis)是引起猪感染的一种重要的革兰氏阳性致病菌,多数为兼性厌氧、少数为专性厌氧[1-2]。猪链球菌不仅可以引起猪关节炎、败血症、脑膜炎、心内膜炎、流产和猝死等疾病,而且可导致人发病,引起败血症型休克,严重时可导致患者死亡[3]。猪链球菌的流行给世界公共卫生安全带来了巨大的威胁。青霉素类、四环素类、大环内酯类及氟喹诺酮类等是治疗猪链球菌感染的首选药物。随着抗菌药物的不规范使用,猪链球菌临床分离株的耐药问题日益严重。此外,猪链球菌对四环素类药物(高达90%)和大环内酯类药物(高达70%)的高耐药现状在世界各地均有报道[4]。
利奈唑胺(Linezolid)是第一代恶唑烷酮类抗菌药物,对革兰氏阳性致病菌,特别是多重耐药的革兰氏阳性致病菌,具有较强的抗菌活性[5-6],包括耐青霉素的肺炎链球菌(PRSP)、耐甲氧西林的葡萄球菌(MRSA)和耐万古霉素的肠球菌(VRE)等,也被称为治疗由多重耐药革兰氏阳性致病菌感染的最后一道防线。利奈唑胺可通过与细菌50S核糖体的肽基转移酶中心(PTC)结合,抑制细菌蛋白质的合成,从而发挥抗菌作用[7]。但利奈唑胺在被获准用于临床后不久,便有报道分离出了耐利奈唑胺的金黄色葡萄球菌(MRSA)。利奈唑胺未用于食品生产动物,但已有报道动物源的利奈唑胺耐药菌株的出现[8]。前人研究发现,利奈唑胺耐药机制主要为突变介导的耐药(23S rRNA V 区突变和核糖体蛋白L3、L4 突变等)和耐药基因(cfr、optrA和poxtA等)介导的耐药[9-12]。HUANG 等[13]关于从江苏省收集的107 株猪链球菌分离菌株对利奈唑胺耐药性的调查发现,在2013—2016 年,猪链球菌对利奈唑胺的耐药率在逐渐增加(0~38.3%)。同时还发现,利奈唑胺耐药菌株100%携带optrA基因。有研究发现,optrA基因位于猪链球菌所携带的可转移的遗传元件上(质粒、转座子等),具有水平转移利奈唑胺抗性的风险[5]。值得注意的是,optrA基因在国内呈现广泛流行的趋势。利奈唑胺耐药菌株的出现将会导致利奈唑胺在临床治疗中的失败,尤其是利奈唑胺耐药基因的出现和快速传播,将严重危害人类健康和畜禽养殖业的发展,应该引起人类的高度重视。
为此,对从河南及周边等7 个省份分离的猪链球菌临床菌株进行相关研究,调查分析这7 个省份猪链球菌对利奈唑胺的耐药情况,以及其相关耐药机制,旨在为猪链球菌中利奈唑胺耐药性的研究奠定基础。
1 材料和方法
1.1 材料
1.1.1 菌株来源 2016—2019 年,分别从河南、江西、湖南、湖北、安徽、山西及陕西7个省份收集得到178株猪链球菌[14]。
质控菌株:肺炎链球菌ATCC 49619,大肠杆菌ATCC 25922。
1.1.2 试剂 心脑浸出液(BHI)培养基购自北京奥博星生物技术有限责任公司;胎牛血清(四季青)购自杭州四季青有限公司;2×PCRTaqMaster Mix、DSTM 2000 DNA Marker 购自康为世纪(北京)生物科技有限公司;蛋白酶K、溶菌酶均购自宝日医生物技术(北京)有限公司。水系微孔滤膜(0.22 μm)购自郑州久是生物技术有限责任公司。
1.1.3 药物 阿米卡星(含量80%)、庆大霉素(62.3%)、阿奇霉素(80%)、氟苯尼考(85%)、杆菌肽(60 U/mg)、多西环素(98%)均购于河南牧翔药业有限公司;红霉素(80%)、克林霉素(100%)、氯霉素(98%)均购于索莱宝生物科技有限公司;利奈唑胺(98%)购于上海麦克林生化科技有限公司。以上药物均在有效期内。
1.2 方法
1.2.1 利奈唑胺抗性菌株的初筛 用接种环将178株猪链球菌接种于BHI 固体培养基(含10%的胎牛血清),于37 ℃恒温培养箱培养18~24 h,然后用一次性接种环挑取单个菌落于5 mL 的BHI 液体培养基(含10%的胎牛血清),180 r/min 摇床培养18~24 h,最后分别吸取100 μL 菌液均匀涂布于含有利奈唑胺(4 mg/L)和10%胎牛血清的BHI固体培养基上,在培养箱中过夜培养,从而进行利奈唑胺耐药菌株的初筛。
1.2.2 细菌基因组提取 用一次性接种环挑取单个菌落于5 mL的BHI液体培养基(含10%的胎牛血清),180 r/min 摇床培养18~24 h 后,使用细菌基因组提取试剂盒(北京天根生化科技有限公司)提取全基因组DNA。严格按照试剂盒说明书操作,提取的DNA于-20 ℃保存备用。
1.2.3 耐药基因PCR 检测 利奈唑胺耐药基因optrA、cfr、poxtA、cfr(B)及cfr(C)引物参照相关文献进行设计[12,15-17],由生工生物工程(上海)股份有限公司合成。PCR 体系:DNA 模板2 μL,上、下游引物各1 μL,2×PCRTaqMaster Mix 10 μL,加灭菌双蒸水(ddH2O)补至20 μL。分别以ddH2O、258S 菌株为阴性、阳性对照。取6 μL PCR 扩增产物进行1%的琼脂糖凝胶电泳,然后将PCR 阳性产物送至生工生物工程(上海)股份有限公司测序,所获序列提交NCBI网站进行目的基因验证分析。
1.2.4 药物敏感性试验 参照美国CLSI 标准[18],采用微量肉汤稀释法测定optrA/cfr阳性菌株对利奈唑胺、阿米卡星、庆大霉素、红霉素、阿奇霉素、杆菌肽、多西环素、氟苯尼考、氯霉素和克林霉素10种抗菌药物的敏感性,统计各药物的最小抑菌浓度(MIC)。
2 结果与分析
2.1 耐利奈唑胺的猪链球菌分离株筛选结果
耐利奈唑胺的分离株筛选显示,178 株猪链球菌中有13 株在利奈唑胺抗性平板上呈灰白色不透明的、表面光滑的圆形均匀小菌落,这说明该13株菌对利奈唑胺不敏感,即利奈唑胺对其的MIC 值均大于4 mg/L。
2.2 猪链球菌分离菌株利奈唑胺耐药基因的PCR检测结果
PCR 检测结果表明,13 株利奈唑胺耐药菌株均携带optrA基因,其中,有2 株菌(1077S 和1113S)同时携带optrA和cfr基因。阳性菌株的PCR 扩增产物经1%琼脂糖凝胶电泳显示,与目的基因条带大小一致(图1),测得的序列与目的基因序列的同源率达99%以上,符合预期。
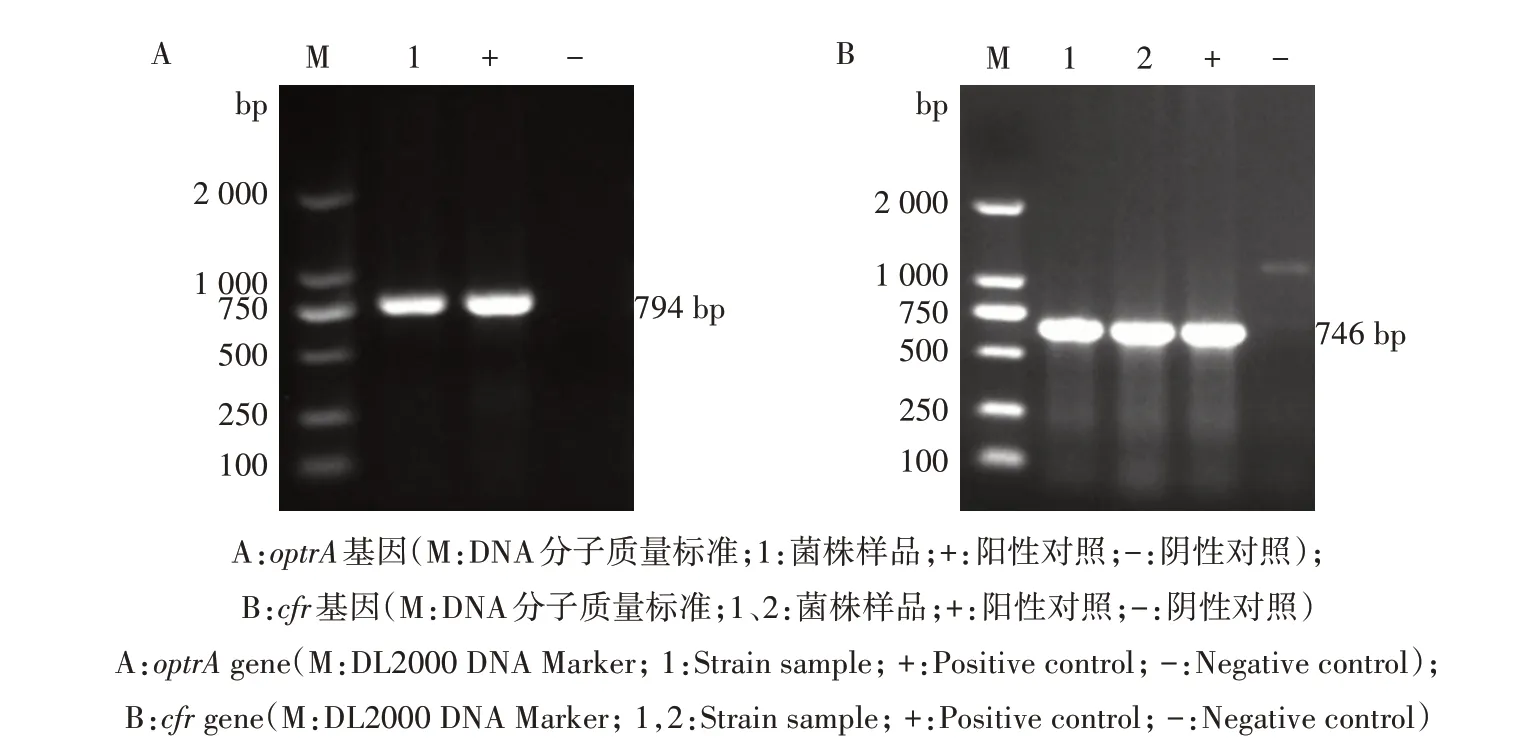
图1 猪链球菌分离菌株optrA和cfr基因的PCR扩增结果Fig.1 PCR amplification results of optrA and cfr genes from S.suis
2.3 猪链球菌分离菌株药敏结果
药敏试验结果表明,13 株optrA/cfr阳性菌株为利奈唑胺耐药菌株,利奈唑胺的MIC 值在8~16 mg/L(表1)。对于2 株同时携带optrA和cfr基因的菌株,利奈唑胺的MIC 值均为16 mg/L,高于仅携带optrA菌株的MIC 值(8 mg/L)。此外,该13 株菌对其他类的抗菌药物表现出不同水平的耐药,如对多西环素和克林霉素全部耐药,MIC值分别分布在2~16 mg/L和4~256 mg/L。然而,存在3 株杆菌肽耐药菌株。且有12 株菌对红霉素和阿奇霉素表现为较高程度的耐药,MIC 值达到512 mg/L。此外,对阿米卡星耐药的菌株(10 株)要多于对庆大霉素耐药的菌株(8株),其中,4 株庆大霉素耐药菌株,MIC 值在512 mg/L 以上。氟苯尼考和氯霉素耐药菌株均为10 株,但是对氟苯尼考耐药的菌株,可能对氯霉素敏感,反之亦然。
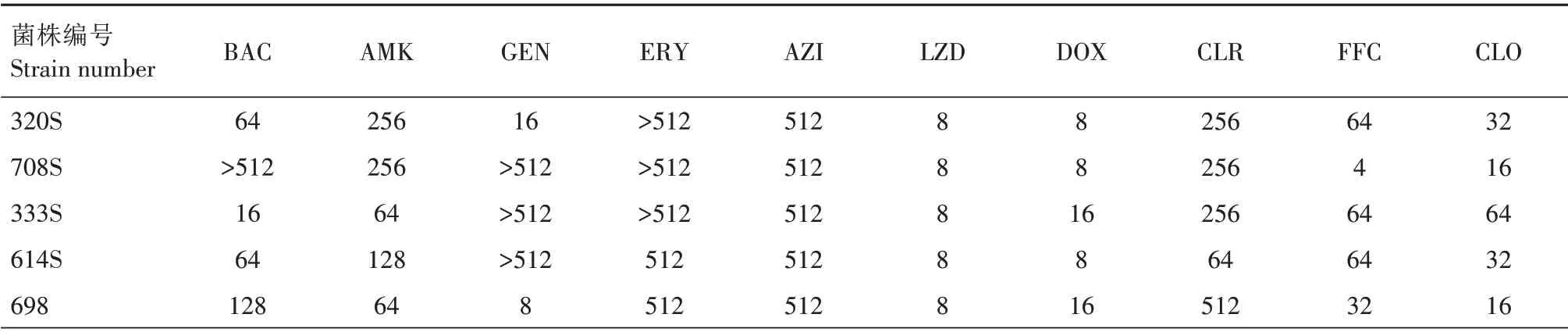
表1 猪链球菌对药物的敏感性及MICTab.1 Sensitivity and MIC distribution of S.suis to drugsmg/L
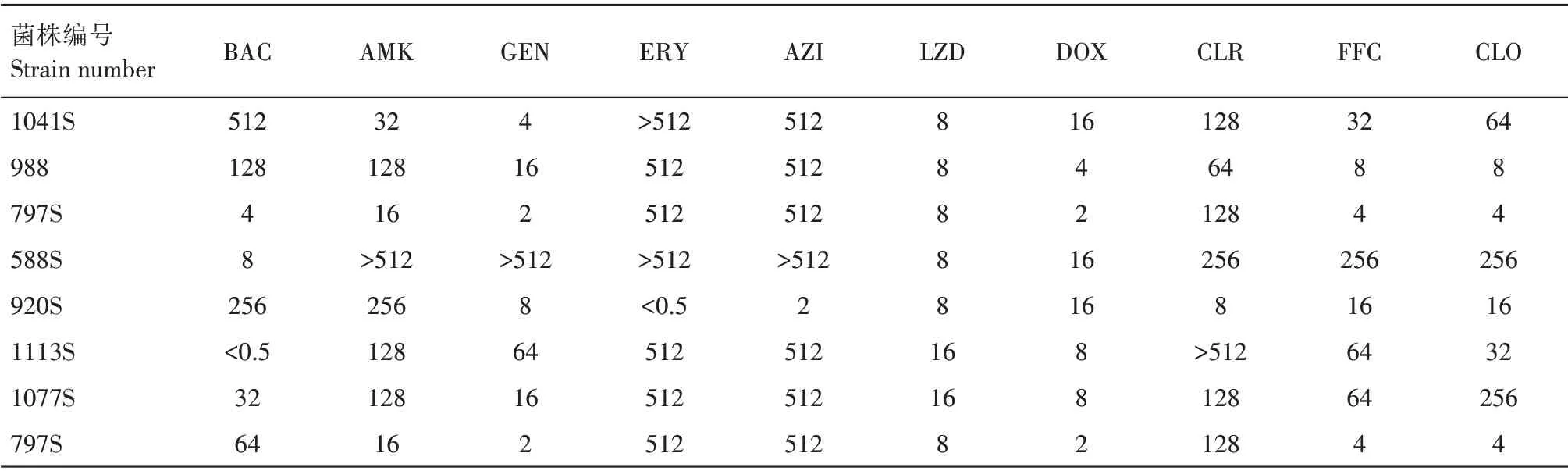
续表1 猪链球菌对药物的敏感性及MICTab.1(Continued) Sensitivity and MIC distribution of S.suis to drugsmg/L
可见,这13 株菌株至少对3 种药物表现为耐药,对4 种药物耐药的有2 株,对7 种药物耐药的有2 株,对6 种药物耐药的有9 株,占比最高。未检出对所测试药物均耐药的菌株(图2)。
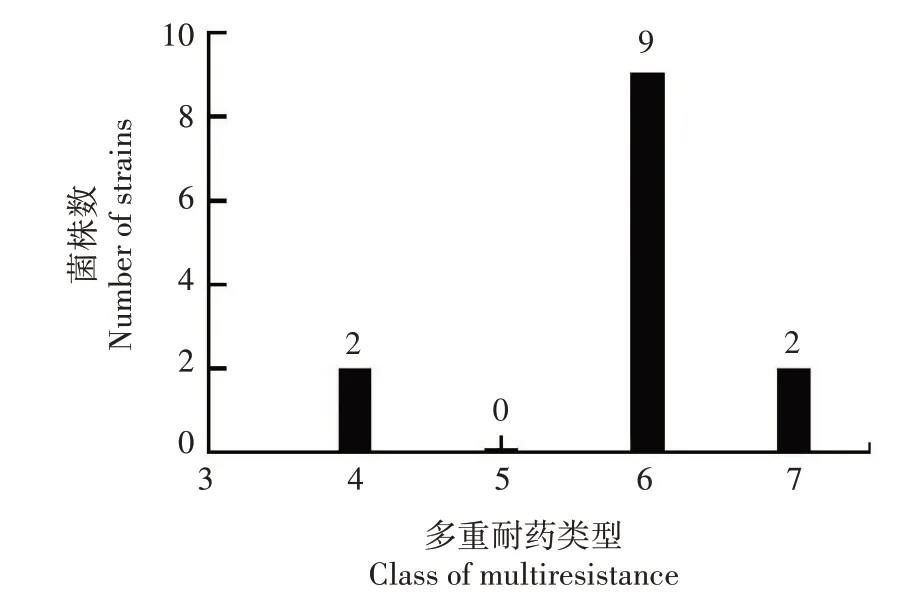
图2 13株optrA/cfr阳性菌株的多重耐药情况Fig.2 Multidrug resistance of 13 strains of optrA/cfr positive S.suis
3 结论与讨论
利奈唑胺是美国食品药品监察局(FAD)在2000 年批准用于人医临床的一种抗菌药物,用于治疗革兰氏阳性球菌引起的感染。尽管其尚未批准用于动物治疗,但是在许多国家均出现了动物源的利奈唑胺耐药菌株[19]。KANG 等[19]对于来自韩国2 547 株金黄色葡萄球菌对利奈唑胺的耐药性进行调查发现,有25 株菌对利奈唑胺耐药,耐药率为1.0%。CAVACO 等[20]在556 株肠球菌中发现有3 株利奈唑胺耐药菌株,耐药率为0.54%。HUANG 等[13]调查了来自江苏省的猪链球菌分离株对利奈唑胺的耐药性,发现其耐药率达38.3%。本研究对7 个省份178株猪链球菌临床分离株的利奈唑胺耐药性进行调查,结果显示,有7.3%的耐药菌株;分析相关耐药基因发现,对利奈唑胺耐药的菌株中,有2株同时携带cfr和optrA基因,而未检出携带cfr(B)、cfr(C)和Poxt A基因的菌株。HUANG 等[13]对江苏省猪链球菌利奈唑胺耐药性进行调查发现,所有利奈唑胺耐药的菌株均携带optrA基因,而只有1株菌携带cfr基因,这表明optrA基因在介导利奈唑胺抗性中可能发挥了主要作用。
在13 株optrA/cfr阳性菌株中,利奈唑胺对2 株同时携带optrA和cfr菌株的MIC值(16 mg/L)高于仅携带optrA菌株的MIC 值(8 mg/L),这可能是由于cfr基因可介导高水平的利奈唑胺抗性[21]。此外,这些阳性菌株不仅对利奈唑胺耐药,而且对多西环素、氯霉素、氟苯尼考、红霉素、阿奇霉素、克林霉素、阿米卡星和庆大霉素耐药,甚至表现为较高程度的耐药,这表明optrA/cfr阳性菌株可表达多重抗性。optrA和cfr基因均为多重耐药基因,既可介导利奈唑胺耐药,又可介导对四环素类和酰氨醇类等抗菌药物耐药。尤其当optrA或cfr基因在传播过程中与其他耐药基因,如erm家族基因[erm(A)、erm(B)和erm(C)]、氨基糖苷类耐药基因(aadD、aacA-aphD)或四环素类耐药基因[tet(A)、tet(B)和tet(O)]共定位时,则会出现多重耐药性的情况[22]。目前,optrA和cfr基因在猪链球菌中不断被检出,且具有地域性及跨种属传播的趋势,应持续检测包括猪链球菌在内的革兰阳性菌对利奈唑胺等临床重要抗菌药的耐药性发展情况。
耐药猪链球菌作为抗生素耐药基因库,可水平转移到人致病链球菌中,如化脓性链球菌、肺炎链球菌和无乳链球菌,从而导致抗生素耐药性的广泛传播[4]。因此,应加强抗菌药物在养猪业中的规范使用,以减缓猪链球菌耐药性的产生。
