低温处理对牡丹花瓣细胞核形态及生理指标的影响
2022-04-18刘会超贾文庆何松林郭英姿朱小佩王艳丽杜晓华
陈 悦,刘会超,贾文庆,何松林,郭英姿,朱小佩,王艳丽,杜晓华,王 政
(1. 河南科技学院,河南 新乡 453000;2. 河南农业大学,河南 郑州 450002)
衰老是一个以细胞程序性死亡(Programed cell death,PCD)结束的高度调控的过程[1-2]。细胞核是植物细胞遗传与代谢的调控中心,细胞正常的生理活动依赖于细胞核的完整性,其形态是反映植物细胞衰老程度的重要指标,可反映细胞的PCD 进程。曹慧等[3]在对八棱海棠和平邑甜茶的研究中发现,植物死亡与细胞核状况具有显著相关性;在小麦胚乳细胞[4]、月季花瓣细胞[5]、黄瓜根尖细胞[6]、烟草花冠细胞[7]研究中也发现了类似现象。植物自由基、活性氧产生和消除之间的平衡,是通过2 个抗氧化机制维持的:一类是酶系统,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)和过氧化物酶(POD)等;另一类是非酶的小分子化合物系统,如酚类物质、黄酮类化合物和果糖。当遭受外界环境胁迫时,植物细胞的2 个抗氧化系统将开启,合成酶及非酶清除物质,从而减轻活性氧对细胞生物膜的侵蚀,保护细胞结构,如越橘[8]、云南含笑[9]、甜樱桃[10]、玉蝉花[11]等植物在冷应激下SOD 和CAT 活性显著增加。保护酶活性和非酶物质含量一定程度上是植物细胞受伤害程度或者细胞衰亡进程的重要指标[12-14]。
牡丹(Paeonia suffruticosa)为芍药科芍药属多年生落叶小灌木,是世界著名花卉,其花大色艳,雍容华贵,是富贵祥和的象征。随着人们生活水平的提高,作为高档切花的牡丹市场需求量越来越大,探讨牡丹切花衰老的机制对于推进牡丹切花产业化发展具有重要意义。目前,仅史国安等[15]、王荣花[16]、孟海燕[17]、曹满等[18]对牡丹鲜切花贮藏技术方面进行研究探讨,关于牡丹鲜切花花瓣细胞程序性死亡的细胞学、生理学机制方面的系统研究尚未见报道。牡丹凤丹粉株型高大,当年生枝条及花梗长达25~30 cm,直立,是牡丹切花最有前景的材料之一。为此,以牡丹凤丹粉切花为试材,研究低温对其切花细胞核形态、切花寿命、保护酶活性、丙二醛(MDA)含量、可溶性蛋白含量及O-·2产生速率等的影响,以期解析低温下牡丹花瓣衰老的生理及细胞学机制,确定牡丹切花保存最佳温度,为牡丹切花的保鲜及开发利用提供理论依据。
1 材料和方法
1.1 材料及处理
试验在河南省园艺植物资源利用与种质创新工程研究中心进行。以生长一致、健康无病虫害的7 年生凤丹粉切花为材料,采集的切花花蕾直径为2~3 cm,长度为15~20 cm,基部带木质。将切花带回实验室,基部斜剪后放入盛有蒸馏水的水瓶,每瓶6 枝,然后分成4 份,每个处理5 瓶、30 枝,分别置于2 ℃、4 ℃、8 ℃、(25±1)℃(室温,对照)瓶插,每2 d 取样测定一次,取材周期为17 d,直至花瓣萎蔫凋谢为止。每处理随机取样,重复测定3次。
1.2 测定指标及方法
1.2.1 切花瓶插寿命和最大花径的统计 牡丹凤丹粉切花瓶插寿命计算参照张玉等[19]的方法,以最外层花瓣展开与花托垂直到花瓣萎蔫失色、凋谢作为瓶插寿命。用游标卡尺测定花径,每2 d 测定一次,取最大值作为最大花径。
1.2.2 凤丹粉花瓣细胞核的形态观察 细胞核的形态观察参考曹慧等[3]的方法并加以改进。切片采用新鲜花瓣制作,第1层花瓣边缘向内1/3处切取长7~8 mm、宽4~5 mm 的小块,置于10 mL 70%乙醇中固定2 h后,取出用PBS缓冲液反复冲洗3次。将冲洗干净的切片材料置于载玻片上,用滤纸擦干净,滴加20 μL 浓度为0.029 mol/L 的DAPI 染液,盖好盖玻片,于黑暗处染色15~20 min,置于OLYMBUS 荧光倒置显微镜下观察拍照,荧光激发波长为330~380 nm。以20 倍物镜观察载玻片上、下、左、右、中5个视野,用图像分析软件IMAGEN 对细胞核进行计数,取平均数。判断细胞核正常的标准:当细胞核正常时,细胞核位于细胞正中央,细胞核形态完整,边缘清晰圆滑,为标准的球形,排列整齐。细胞核正常率计算公式为:细胞核正常率=正常细胞核数/新鲜花瓣荧光细胞核数×100%。
1.2.3 6 个生理指标的测定 酶液的提取:准确称量1.000 g 牡丹花瓣,放入预冷研钵中,加入少许PVP、石英砂,然后加入10 mL 0.05 mol/L 磷酸缓冲液(pH=7.0),匀速研磨30~40 s,然后将混合液倒入试管中,于10 000×g冷冻离心机里离心20 min,上清液即为酶液。
SOD 活性采用氮蓝四唑法(NBT)[20]测定;CAT活性采用紫外吸收法[21]测定;POD 活性采用愈创木酚显色法[21]测定。MDA 含量采用硫代巴比妥酸法测定[21];可溶性蛋白含量采用考马斯亮蓝法测定[22];O-·2含量采用羟胺氧化法[20]测定。
1.3 数据处理
数据均采用DPS 软件进行分析,邓肯新复极差法(SSR)检测各数据间的差异,显著性水平为P<0.05,采用EXCEL 2010处理数据及制图。
2 结果与分析
2.1 低温处理对牡丹凤丹粉切花瓶插期观赏品质的影响
由表1 可知,不同温度处理间瓶插寿命差异性显著,4 个温度处理下凤丹粉瓶插寿命依次为4 ℃=2 ℃>8 ℃>对照,4、2 ℃处理下凤丹粉瓶插寿命最长,达17 d,对照最短,仅为7 d。4 个温度处理下最大花径依次为4 ℃>8 ℃>对照>2 ℃。对照最大花径为12.8 cm,7 d 时花瓣全部凋谢;8 ℃处理凤丹粉瓶插寿命为13 d,最大花径为13.2 cm;4 ℃处理凤丹粉瓶插寿命为17 d,最大花径达到13.3 cm;2 ℃处理凤丹粉在衰老过程中出现萎蔫、失水现象,影响切花观赏性,最大花径为12.4 cm。4 ℃下较2 ℃下花瓣平展,形态好,观赏价值高,有效延长了瓶插期并保障了凤丹粉的观赏性。

表1 低温处理对牡丹凤丹粉切花瓶插期观赏品质的影响Tab.1 Effects of low temperature treatment on ornamental value of peony Fengdanfen
2.2 低温处理对牡丹凤丹粉切花花瓣细胞核形态及正常率的影响
植物细胞中细胞核和各种细胞器在细胞内结构稳定及有序分布是进行正常代谢的前提,花瓣细胞在衰老过程中其成分、结构均会出现异常,细胞核的形态在一定程度上是花瓣PCD 进展的标志物,通过DAPI 染色后显微镜下观察,可以确定细胞核的完整情况[23]。由图1A1—2可知,对照早期处理的花瓣细胞核荧光明亮,形态呈现标准的圆形,边界清晰;由图1A3—5 可知,随着处理时间增加,细胞核向两级拉伸变形程度增加,造成正常细胞核的数量减少,细胞核逐渐向两端拉长变形,后期细胞核分解逐渐消失。由图1B2 可以看出,2 ℃处理有少数花瓣细胞核在瓶插3 d 开始向两端拉长变形;由图1B3—5 可知,随着处理时间增加,细胞核向两级拉长变形的数量越来越多,且逐渐模糊消失,正常细胞核数降低;由图1C2—3可知,4 ℃处理花瓣细胞核在3 d 出现变形;由图1C4—5 可知,4 ℃处理细胞核随时间的增加而向两级拉伸变形,逐渐分解消失。由图1D2—3可以看出,8 ℃处理花瓣细胞核在3 d开始变形,5 d 仅有少数细胞核正常;由图1D4—5 可知,8 ℃处理7~13 d,仅能看到极少数正常花瓣细胞核。由此看出,随着花瓣细胞逐渐凋亡,花朵逐渐衰败,且低温处理对花瓣细胞PCD有显著影响。

图1 低温处理下牡丹凤丹粉切花花瓣DAPI荧光染色细胞核形态变化Fig.1 Nuclear shape changes of peony Fengdanfen petals treated by DAPI under low temperature
由图2 可知,随处理时间增加,4 个温度处理下花瓣细胞核正常率基本呈下降的趋势,但下降幅度不同。对照细胞核正常率下降最快,瓶插3 d 下降52.39 个百分点,8 ℃下降48.47 个百分点,而2 ℃下降36.22 个百分点,4 ℃则下降30.66 个百分点,2 ℃和4 ℃下花瓣细胞核正常率下降速度较缓慢。瓶插7 d,对照细胞核正常率仅为1.25%,花朵已经萎蔫,花瓣大面积皱缩,出现卷翘现象,失去观赏价值;而2、4、8 ℃处理细胞核正常率分别达30.83%、48.35%、21.44%,细胞核形态较完整,花朵形态直立,花瓣正常,未出现皱缩卷翘。瓶插时间越长,细胞核向两端拉长变形的数量越多,2、4 ℃瓶插17 d仅有极少数细胞核完整,细胞核正常率为0.81%、2.33%。4个温度处理细胞核形态变化的趋势一致,但同一天细胞核变形程度却不相同,表明低温对花瓣细胞核正常率有显著影响。综合来看,与其他3个温度处理相比,4 ℃下花瓣细胞核正常率下降缓慢,是凤丹粉切花保存的最佳温度。
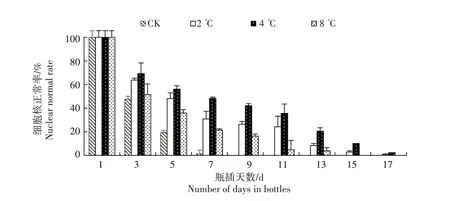
图2 低温处理下牡丹凤丹粉切花花瓣DAPI荧光染色细胞核正常率变化Fig.2 Nuclear normal rate changes of peony Fengdanfen petals treated by DAPI under different temperature
2.3 低温处理对牡丹凤丹粉切花花瓣保护酶活性的影响
2.3.1 SOD 活性 由图3A 可知,不同贮存温度及处理时间对SOD 活性有显著影响(P<0.05)。随着处理时间的增加,对照SOD 活性呈先升后降再升趋势,峰值出现在7 d,此时花瓣出现萎蔫失色,丧失瓶插价值。4 ℃处理5 d降到最低值,但仍高于其他温度处理,11 d 达到峰值。4 ℃处理SOD 活性在瓶插期间(1~17 d)保持较高水平,且4 ℃处理花瓣平展,形态较好,观赏价值较高。8 ℃处理凤丹粉花瓣SOD活性呈升-降-升-降趋势,11 d达到峰值。综合来看,牡丹凤丹粉切花萎蔫失色时SOD 活性达到峰值或处于高水平,此时可能是花瓣细胞活性氧、自由基产生过多,需要提高SOD 活性来清除,但随着时间的延长,SOD活性不足以抵御伤害,最后造成牡丹切花萎蔫死亡。
2.3.2 POD 活性 由图3B 可知,随着处理时间的增加,对照和2、4 ℃处理POD 活性呈先升高后降低趋势,8 ℃处理POD 活性呈降-升-降趋势。瓶插5 d,对照和8 ℃处理POD 活性分别为0.388、0.326 U/g。8 ℃处理POD 活性整体低于对照,与SOD 活性变化一致,这2 个酶活性较低可能是8 ℃下凤丹粉切花寿命较短的原因。2 ℃和4 ℃处理凤丹粉POD 活性峰值出现时间较晚,均在7 d 出现,2 ℃与4 ℃相比POD 活性上升或下降速度都较为缓慢。瓶插中期(5~7 d),4 ℃处理POD 活性较高,降低活性氧、自由基引起的氧化胁迫能力较强,这可能是4 ℃下瓶插品质较好的原因。

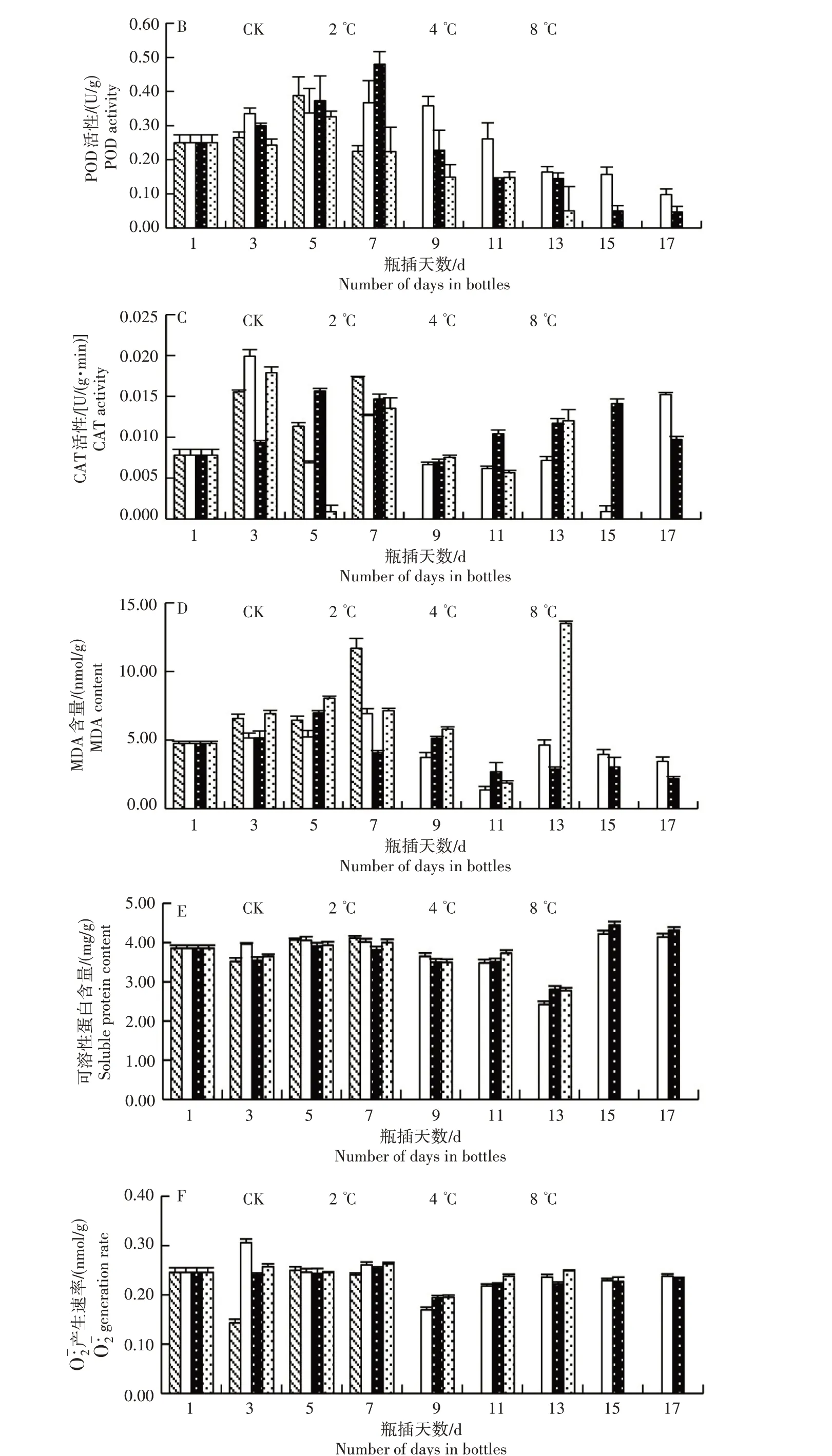
图3 4个温度下牡丹凤丹粉切花生理指标的变化Fig.3 Changes of physiological indexes of peony Fengdanfen at four temperatures
2.3.3 CAT 活性 由图3C 可知,2 ℃与8 ℃处理CAT 活性变化幅度剧烈,引起瓶插品质下降,进而缩短瓶插寿命。对照CAT 活性呈升-降-升变化趋势,在瓶插7 d 出现峰值。4 ℃处理CAT 活性呈升-降-升-降趋势,瓶插15 d 时CAT 活性仍为瓶插1 d的1.75 倍。表明在瓶插期间(1~17 d),4 ℃处理凤丹粉花瓣抗氧化系统与自由基、活性氧处于平衡状态,并且在瓶插后期仍然具有较强的清除H2O2能力,能够有效减轻花朵受到的胁迫伤害,保持花瓣形态。
2.4 低温处理对牡丹凤丹粉切花MDA含量的影响
由图3D 可知,对照MDA 含量随着时间延长呈增加趋势,瓶插7 d 出现峰值,达到11.686 nmol/g;8 ℃处理切花MDA 含量呈先升高后降低随后急剧增加趋势,13 d 出现峰值,达到13.503 nmol/g。对照、8 ℃处理下,伴随着MDA 含量峰值的出现,切花萎蔫失色,表明花瓣膜脂过氧化是其花瓣衰亡的原因之一。2 ℃处理MDA含量变化幅度较大,瓶插7 d出现峰值(6.929 nmol/g),而4 ℃下MDA 含量5 d 达到峰值(6.982 nmol/g),整体变化较2 ℃下平缓,说明在瓶插过程中膜脂过氧化程度较轻,膜系统较完整,这可能是4 ℃下凤丹粉切花形态较好的原因。
2.5 低温处理对牡丹凤丹粉切花可溶性蛋白含量的影响
由图3E可以看出,不同温度处理之间可溶性蛋白含量整体变化趋向相同,仅2 ℃处理下略有不同。对照可溶性蛋白含量在瓶插7 d 达到峰值(4.111 mg/g)。4 ℃处理在15 d 出现峰值,在瓶插后期可溶性蛋白含量均高于瓶插1 d时,可能是因为在4 ℃下有新的蛋白质产生。2 ℃处理在15 d 出现峰值,与4 ℃处理下瓶插后期变化一致,说明2 ℃和4 ℃低温处理有可能诱导新的蛋白质产生。8 ℃处理可溶性蛋白含量在瓶插7 d 最高,为3.998 mg/g,13 d 最低,为2.772 mg/g。
2.6 低温处理对牡丹凤丹粉切花O-·2产生速率的影响
从图3F 可知,不同温度处理下O-·2产生速率变化不同。对照O-·2产生速率呈降-升-降变化趋势。2、8 ℃处理分别在瓶插3、7 d 出现峰值,2 ℃处理O-·2产生速率变化幅度大,引起瓶插品质降低。4 ℃处理O-·2产生速率变化平缓,瓶插17 d 时O-·2产生速率为瓶插1 d 时的0.967 倍,说明在瓶插过程中,受到的氧化胁迫较小,因此瓶插寿命较长。
2.7 牡丹凤丹粉切花生理指标及细胞核正常率的相关性分析
从表2 可以看出,凤丹粉细胞核正常率与POD活性呈极显著正相关关系(P<0.01),与O-·2产生速率、可溶性蛋白含量呈显著正相关关系(P<0.05),说明低温处理下POD 是主要的抗氧化酶,其降低凤丹粉的活性氧水平,消除H2O2和酚类、胺类、醛类、苯类等物质对细胞的毒害,使细胞代谢保持在平衡状态。

表2 牡丹凤丹粉切花生理指标和细胞核正常率的相关性分析Tab.2 Correlation analysis physiological indexes and nuclear normal rate of cut flower Fengdanfen
3 结论与讨论
3.1 低温对牡丹凤丹粉切花瓶插寿命的影响
温度是影响植物细胞衰老速度的主要因素,低温处理可以减缓细胞活动。低温处理增加了蓝莓[24]、猕猴桃[25]等的保鲜时间,延缓了唐菖蒲[26]和百合[27]、金鱼草[28]、牡丹[18]花朵的衰老进而延长了其适销期。本试验结果也证实了这一点,低温处理较对照有效地保持了凤丹粉的花色、形态,延长了观赏期,4、2 ℃处理下凤丹粉瓶插寿命最长,达17 d,4 ℃观赏性最佳。
3.2 牡丹凤丹粉切花细胞核正常率与瓶插寿命的关系
切花在细胞程序性死亡过程中,花瓣状态等表观特征的健康程度较难量化,而细胞核是细胞代谢和遗传的调控中心,是细胞能够进行正常代谢维持生命的重要标志物。细胞核正常率是衡量切花健康程度的主要指标,在矮牵牛、金鱼草[29-30]的研究中发现,花瓣中细胞程序性死亡伴随着DNA 降解,绝大部分细胞核弥散、裂解,在干旱胁迫下小麦胚乳细胞[31]以及月季、鸢尾和密花石斛花瓣[5,32]的研究中同样发现了类似现象。本研究结果表明,2、4 ℃低温处理下花瓣细胞核正常率与花朵的姿态、花瓣的形态呈明显正相关。细胞核正常率高,细胞核边缘清晰,呈现标准的圆形,此时花瓣细胞排列整齐一致,花瓣形态直立,平展无卷翘。细胞核正常率低时,花瓣出现卷翘或萎蔫。这表明细胞核正常率可以作为牡丹切花健康程度量化的代表性指标,花朵萎蔫凋零的原因可能是细胞核的大量变形、弥散,引起细胞核代谢调控失调,导致细胞核调控细胞器等合成相关保护酶、氨基酸及蛋白质的能力大幅降低,不能抵御外界环境的胁迫,从而造成活性氧大量积累,MDA 含量增多,膜脂过氧化程度加深,最终引起细胞死亡,花瓣萎蔫。
3.3 牡丹凤丹粉切花细胞核正常率与保护酶活性、MDA和可溶性蛋白含量、O-·2产生速率的关系
本试验结果表明,在瓶插过程中花瓣细胞核正常率与抗氧化系统具有相关性,POD 活性是影响花瓣细胞核正常率的主要因素,其次是O-·2产生速率、可溶性蛋白含量;低温处理可以减缓H2O2、O-·2等对花瓣细胞的侵蚀引起的花瓣细胞PCD,延长瓶插寿命。4 ℃为凤丹粉切花短期贮藏的适宜温度;切花花瓣细胞核正常率是牡丹凤丹粉花瓣健康状况的直观反映,可作为切花质量的一个评价指标;氧化胁迫加剧引起细胞核正常率降低是导致凤丹粉瓶插寿命缩短的重要原因之一;切花细胞核弥散过快,细胞核完整率快速降低、细胞解体数过多是对照凤丹粉切花寿命较短的细胞学原因,切花细胞核弥散慢、正常细胞核较多是4 ℃下凤丹粉切花寿命较长的细胞学原因。切花瓶插寿命与保护酶活性具有相关性,SOD、CAT、POD 活性保持较高水平,切花细胞能有效清除过多的活性氧、自由基,代谢基本保持平衡是4 ℃下切花寿命较长的生理原因。
