新型碱金属高碘酸盐纳米铝热剂的反应特性
2022-04-16万早雁易镇鑫叶迎华朱顺官
万早雁,李 晨,李 燕,易镇鑫,叶迎华,张 琳,朱顺官
(南京理工大学化学与化工学院,江苏 南京 210094)
1 引言
纳米铝热剂是一种由还原剂和氧化剂组成的活性物质,依靠燃料和氧化剂之间发生的氧化还原反应瞬间释放大量的热。与传统铝热剂相比,纳米铝热剂的氧化剂和燃料在纳米尺度下紧密结合,降低了物质间质量传递的距离,因而具有更高的能量输出、更快的能量释放速率等优势[1]。纳米铝热剂中氧化剂是非常重要的组分,目前对氧化剂的研究主要分为3 类:(1)金属或非金属氧化物[2-6],如氧化铁(Fe2O3)、氧化铜(CuO)、氧化铋(Bi2O3)、氧化碘(I2O5)等;(2)氧化性盐[7-9],包括高氯酸盐(ClO4-)、高锰酸盐(MnO4-)、溴酸盐(BrO3-)和硫酸盐(SO42-)等;(3)复合/混合型氧化剂[10-11],如CuO@Fe2O3、KClO4@Fe2O3、CoFe2O4和Fe2O3/MWCNT(多壁碳纳米管)等。相较于金属氧化物,氧化性盐含有更大质量比的氧,并且含有的氧更容易置换,铝热反应过程更剧烈,Al/氧化性盐纳米铝热剂表现出更高的反应活性。复合/混合型氧化剂的复合体系整合了集成了两种氧化剂的性质并且互相补充各自的不足。在当前的研究中,金属氧化物的研究多为与燃料复合结构的构建如核壳结构、层状结构、多孔结构等,对于大幅度提升纳米铝热剂体系的能量密度和反应活性不是十分有效[12]。氧化性盐(KClO4、K2S2O8等)表现出的强氧化性、光敏性、吸湿性和毒性等,使其发展也受到一定的限制。更重要的是,有研究表明氧在纳米铝热剂中的点火和燃烧起关键作用,要获得高反应活性必须依赖加热粉体空隙间的气体来加速对流传质[13-16]。Comet 等[17]使用不同的碳材料提高Al/WO3纳米铝热剂的产气性能,罗庆平等[18]制备的Al/Fe2O3/RDX 可以作为绿色起爆药,Ahmed Fahda等[7]在Al/KClO4中添加硝化棉和石墨烯提高反应性能。铝热剂配方中添加含能或者非含能的物质以增加纳米铝热剂反应时的产气量从而提高铝热反应活性是一种有效的方法,这种复合药剂的反应性能受添加物的性能影响较大。因此,寻找新的含氧量高、低毒、稳定性好的氧化剂对纳米铝热剂朝着高能量密度、高反应活性和高稳定性的方向发展会非常有利。
碱金属高碘酸盐主要是指高碘酸钠(NaIO4)和高碘酸钾(KIO4),含氧量分别为30%和28%。其中高碘酸钠的氧密度为1.16 g∙cm-3,与高氯酸钾(KClO4)的氧密度(1.15 g ∙cm-3)相当,而且NaIO4和KIO4是KClO4的结构类似物[19],因此是高氯酸钾良好的替代品,NaIO4和KIO4作为KClO4的替代物最早是用在烟火药剂中[20-22]。同时,碱金属高碘酸盐具有低毒和低吸湿性[23]的优势,非常有利于运输的安全和长期储存的可靠。研究表明[24],碱金属高碘酸盐受热分解过程大致分3 步,每步分解过程均产生大量的氧化性气体I2、O2,可以有效弥补纳米铝热剂反应过程中产气量不足的缺陷,同时释放的碘具有高效的杀菌能力[25],在含能反生物战剂方面有潜在的应用价值。Zachariah等[26]尝试将NaIO4和KIO4作为铝热剂中的氧化剂,制备的Al/NaIO4和Al/KIO4两种纳米铝热剂均表现出较高的反应活性和较低的反应温度,并且他们强调了高碘酸盐纳米结构对反应活性的重要性。Grobler 等[27]通过物理混合方式制备的微米Al/KIO4铝热剂同样表现出较低的点火温度,而且燃速可以达到1000 m∙s-1。实际上从碱金属高碘酸盐固有的优势考虑,较高的能量密度、分解时生成较多的气体产物,碱金属高碘酸盐纳米铝热剂的反应活性有望得到进一步提高,甚至可以用来点火、起爆,取代部分起爆药剂。
碱金属高碘酸盐纳米铝热剂反应特性的详细研究,对于寻找有效的策略以提升碱金属高碘酸盐纳米铝热剂的反应活性具有重要意义。根据前期的研究工作[28],室温下将纳米铝粉悬浮在水中1~4 h,其活性铝的含量仅降低2%~6%。因此,本研究将纳米铝粉悬浮在水中作为前驱液,采用喷雾干燥的方法制备得到Al@NaIO4和Al@KIO4两种核⁃壳结构的纳米铝热剂,然后对其形貌结构和成分进行分析,同时探究了两种纳米铝热剂的热性能、定容燃烧性能和吸湿性,最后将两种纳米铝热剂作为起爆药装填在8#工业雷管中评估其起爆性能。
2 实验部分
2.1 试剂与仪器
试剂:NaIO4,99.5%,AR,上海迈瑞尔化学技术有限公司;KIO4,99.5%,AR,上海迈瑞尔化学技术有限公司;纳米氧化铜(粒径50 nm),纯度为99.9%,北京易金新材料科技有限公司;纳米氧化铁(粒径30 nm),纯度为99.9%,北京易金新材料科技有限公司;去离子水,实验室自制;纳米铝粉(粒径100 nm),标称粒径为100 nm,纯度为99.9%,焦作伴侣纳米材料工程有限公司。
仪器:超声清洗仪(KH100⁃DB),昆山超声仪器有限公司;喷雾干燥仪(B⁃290),瑞士步琦有限公司;X⁃射线衍射(XRD)采用D8 Advance 型X 射线衍射仪德国Bruker;场发射扫描电子显微镜(FESEM,型号S⁃4800),日本Hitachi 公司;透射电子显微镜(TEM,型号JEM⁃1200EX),日本JEOL 公司;同步热分析仪(DSC/TG,NETZSCH STA 449C),德国耐驰;高速摄像机(PCO. dimax HD),德国PCO 公司;密闭爆发器主要由压力传感器(FST800⁃ZQ⁃Y1,湖南宇航科技有限公司)、示波器(Tektronix MDO 3034,美国)、13 mL 密闭爆发器和供电电源组成。
2.2 纳米铝热剂的制备
2.2.1 Al@NaIO4纳米铝热剂的制备
利用喷雾干燥法制备Al@NaIO4纳米铝热剂的过程和方法很简单和安全,如图1 所示,具体步骤如下:
图1 制备流程示意图Fig.1 Schematic diagram of preparation process
(1)称取1.98 gNaIO4溶解在150 mL 的去离子水中,超声10 min 形成均一透明溶液。
(2)向(1)中溶液缓慢加入0.66 g nano⁃Al,超声20 min,形成均匀的悬浮液。在该悬浮液中,纳米铝粉的含量为25%,高碘酸钠的含量为75%。
(3)采用喷雾干燥仪对(2)中悬浮液进行喷雾。喷雾主要分为两个步骤,悬浮液的雾化和溶剂的挥发。喷嘴处的温度为115 ℃,气体流速为500 L∙h-1,进料速率为3 mL∙min-1,整个喷雾体系中气体循环速度为38 m3∙h-1,出口处的温度为40 ℃。
(4)喷雾干燥完成以后,在收集器中轻轻刮取制备的粉末,收集在防静电瓶中备用。
2.2.2 Al@KIO4纳米铝热剂的制备
利用喷雾干燥法制备Al@KIO4纳米铝热剂的具体步骤如下:
(1)称取1.4 g KIO4加入到100 mL、70 ℃的去离子水中,搅拌使其充分溶解,形成均一透明溶液。
(2)向(1)中溶液加入0.6 g nano⁃Al,继续搅拌20 min,形成均匀的悬浮液。在该悬浮液中,纳米铝粉的含量为30%,高碘酸钾的含量为70%。
(3)利用B⁃290 喷雾干燥仪对(2)中悬浮液进行喷雾。
(4)喷雾干燥完成以后,在收集器中轻轻刮取制备的粉末,收集在防静电瓶中备用。
2.2.3 Al/CuO 和Al/Fe2O3纳米铝热剂的制备
利用超声混合法制备Al/CuO 和Al/Fe2O3纳米铝热剂,具体步骤如下:
(1)称取0.96 g 粒径为50 nm 的纳米CuO 加入到30 mL 正己烷中,超声分散5 min。
(2)向(1)中溶液加入0.54 g nano⁃Al,继续超声20 min,形成均匀的悬浮液。在该悬浮液中,纳米铝粉的含量为36%,CuO 的含量为64%。
(3)将(2)得到的悬浮液在50 ℃下真空干燥4 h。
(4)同样采用超声法将0.99 g 纳米Fe2O3与0.51 g nano⁃Al 混合得到质量分数为34% nano⁃Al 和66% Fe2O3的Al/Fe2O3纳米铝热剂。
2.3 表征测试方法
XRD测试:铜靶(λ=0.15406 nm),扫描速率4o·min-1,步长0.02o,扫描范围2θ为20o~80o。FESEM 测试:采用日本Hitachi 公司的S⁃4800 型场发射扫描电子显微镜观察样品形貌,样品均匀分散在导电胶上,经喷金后测试。TG⁃DSC 测试:20~1000 ℃,吹扫气是N2,升温速率为10 ℃·min-1,进气速率为20 mL·min-1,坩埚为Al2O3坩埚,样品量2~3 mg。密闭爆发实验:密闭爆发器容积约为13 mL,爆发器一端安装点火装置,试验样品装填在点火端,另一端安装压电传感器。样品量为300 mg,被测粉末松散地包裹住点火药头。起爆能力:采用8#工业雷管和厚度为5 mm 的铅板,实验中起爆雷管使铅板穿孔,测量铅板被穿孔后的孔径。
3 结果与讨论
3.1 形貌成分分析
为获取样品的物相信息,对喷雾干燥法制备的纳米铝热剂进行XRD 分析,结果如图2 所示。从XRD 图谱中可以看出,KIO4的特征衍射峰2θ分别为25.92o、31o、42.49o、52.3o,与标准PDF 卡片(#00⁃008⁃0472)良好吻合;NaIO4的特征衍射峰2θ分别为27.94o、33.52o、45.41o、56.56o,与标准PDF卡片(#00⁃008⁃0496)良好吻合;纳米铝粉的特征衍射峰2θ分别为38.33o、44.56o、64.97o、78.14o与标准 PDF 卡片(ICDD 85⁃1372)良好吻合。XRD 谱图基线平稳,特征衍射峰突出,无其它杂峰存在,说明该纳米铝热剂中只含有结晶度高的KIO4或NaIO4和Al,无其它杂质。对比原料nano⁃Al 和铝热剂中nano⁃Al 的衍射峰强度,可以看出nano⁃Al 的特征衍射峰被保留在相同的位置,但是衍射峰强度大幅度减弱,说明nano⁃Al 被高碘酸盐基体封装包覆,形成了核⁃壳结构纳米铝热剂。

图2 Al@KIO4和Al@NaIO4纳米铝热剂的XRD 曲线Fig.2 XRD curves of Al@KIO4 and Al@NaIO4 nanothermites
Al@NaIO4和Al@KIO4两种纳米铝热剂的SEM 结果如图3 所示。从图3 可清晰地观察到两种样品的形貌均较规则,呈球形或类球形,表面不光滑,粒径分布为500 nm~2 μm,一些未被完全包覆的纳米铝粉团聚在铝热剂的周围。对比两种样品的形貌,Al@NaIO4样品更均匀、球形结构更规则,这与NaIO4和KIO4两种碱金属盐的溶解性有关,NaIO4易溶解在水中,随着温度的升高溶解度增加,而KIO4溶于热水,在喷雾干燥的过程中,前驱液只有在流经喷嘴处时瞬间加热到115 ℃,在进料管中,KIO4已部分析出悬浮在溶液中,故在经过喷嘴后KIO4与纳米铝粉的混合程度不如完全溶解在水中的NaIO4与纳米铝粉混合的均匀。在Al@KIO4纳米铝热剂中任意选取一个微球进行能谱扫描,以确定复合结构中Al 粒子和KIO4粒子的分布情况,所得能谱图如图4 所示。EDS 图中Al(蓝色)、K(绿色)、I(紫色)、O(红色)4 种元素随机均匀分布,没有明显的元素堆积或分隔存在,说明Al、K、I、O 元素均匀分布在铝热剂微球中。利用喷雾干燥法制备的纳米铝热剂能够形成以氧化剂为基质,纳米铝粉为核的核⁃壳结构,该结构可以有效增加Al 粒子与氧化剂之间的接触面积,这非常有利于二者铝热反应的发生,对提升铝热剂的放热性能和燃烧性能有很大的促进作用。

图3 Al@KIO4和Al@NaIO4两种纳米铝热剂的SEM 图Fig.3 SEM images of Al@NaIO4 and Al@KIO4 nanothermites

图4 Al@KIO4纳米铝热剂的EDS 图Fig.4 EDS images of Al@KIO4 nanothermite
3.2 热性能分析
为了评估碱金属高碘酸盐纳米铝热剂的热性能,对样品进行TG⁃DSC测试,结果如图5所示。从图5中可以看出,Al@KIO4铝热剂的总放热量为1262.12 J∙g-1,伴随3 个阶段的质量总损失为76.31%;Al@NaIO4铝热剂的总放热量为1414.7 J∙g-1,伴随3 个阶段的质量总损失为64.09%。
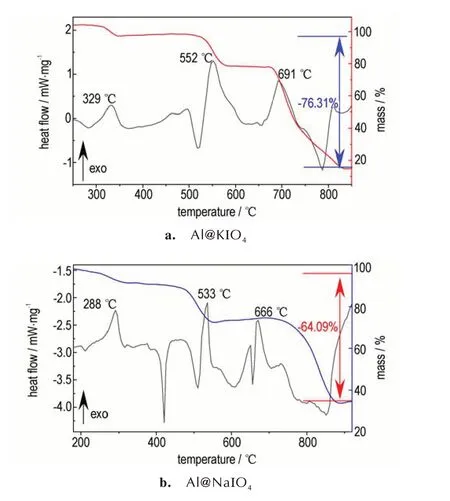
图5 Al@KIO4和Al@NaIO4纳米铝热剂的DSC⁃TG 曲线Fig.5 DSC⁃TG curves of Al@KIO4 and Al@NaIO4 nanother⁃mites
根据图5a中的DSC曲线变化,将Al@KIO4铝热剂的反应过程分为3 个主要阶段:(Ⅰ)KIO4的分解,307.5 ℃左右开始分解为KIO3与O2,对应式(1)。(Ⅱ)主要是铝热反应的进行并且伴随着KIO3的持续分解,从497.9 ℃开始KIO3先熔化分解为KI、O2、I2氧化性气体,加速与nano⁃Al 发生剧烈的铝热反应,大约在552 ℃,反应以(2)为主,其中在685 ℃左右,部分KI熔化,随之分解反应更加剧烈,在700 ℃出现尖峰,式(3)所示反应也可能在这一阶段发生。这一阶段中KIO3分解产生的O2透过氧化铝壳层与固态nano⁃Al 反应,随着氧化铝壳层的加厚,反应逐渐减弱。(Ⅲ)KI 分解生成K(≥728.2 ℃),吸热挥发,对应式(4)。综上,可以看出该铝热反应速率主要取决于KIO4的分解、O2透过氧化铝壳层的速率以及氧化铝壳层的破裂。
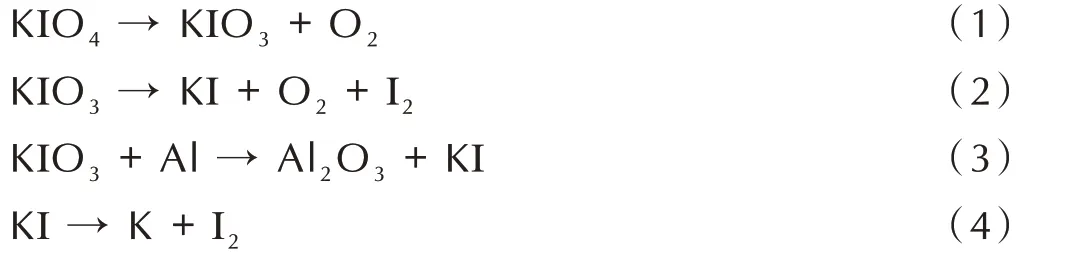
同样,从图5b 中Al@NaIO4纳米铝热剂的DSC 曲线可以看出,NaIO4从288 ℃开始分解放热,在533.3 ℃和666 ℃均有明显的放热峰,在445.6 ℃和655.6 ℃均有很尖锐的吸热峰。结合TG⁃DSC 曲线,分解反应和铝热反应是连续、不间断的过程。碱金属高碘酸盐纳米铝热剂的反应呈多步进行,其中碱金属盐的分解温度较低,发生在铝热主反应之前,分解产生大量氧化性气态产物在固相中快速扩散,气体携带的热量使火焰区的压力和燃烧速度在燃烧前沿到达前点燃未反应的药剂,使得燃烧阵面后的压力和温度持续增长,增加燃速和能量的积累。同时喷雾干燥法构建的核⁃壳结构使铝热剂中氧化剂和燃料的均匀性和接触面积增加,在它们的共同作用下纳米铝热剂的能量释放更快、更彻底,这使得碱金属纳米铝热剂在降低点火温度、提高反应速率和增大放热量方面更具有优势。
3.3 定容燃烧分析
铝热剂在反应过程中的压力变化是影响其燃烧性能的关键因素,若燃烧过程中无气体产物,则燃烧过程平稳;若燃烧过程中产生较多气体产物,并且在高温条件下气体产物排放不及时,则部分气体产物迅速越过燃烧前沿进入未反应的材料区域空隙,使得燃烧阵面后的压力和温度持续增长,最终燃烧可转变为爆轰,所以测试纳米铝热剂燃烧过程中的压力变化可以作为判断纳米铝热剂在点火或者起爆方面的应用依据。
铝热剂燃烧过程中压力的变化规律常采用定容燃烧实验获得,实验中可以得到铝热剂燃烧时的升压持续时间(Δt)、压力峰值(pmax)和升压速率(dp/dt)。为了评价碱金属高碘酸盐纳米铝热剂的定容燃烧性能,对Al/CuO 和Al/Fe2O3纳米铝热剂进行了测试,不同纳米铝热剂燃烧过程中压力随时间的变化规律如图6 和表1 所示。
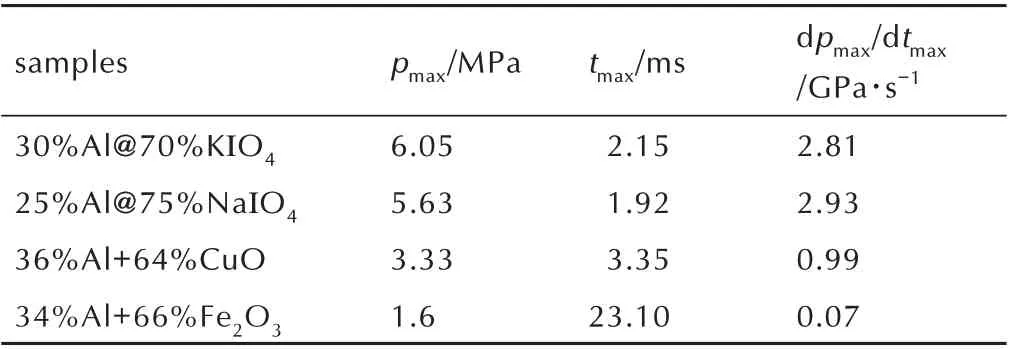
表1 不同纳米铝热剂的定容燃烧参数对比Table 1 Constant⁃volume combustion parameters of differ⁃ent kinds of nanothermites

图6 不同纳米铝热剂的p⁃t 曲线Fig.6 p⁃t curves of different kinds of nanothermites
图6 显示,在相同药量和测试条件下,Al@KIO4、Al@NaIO4、Al/CuO 和Al/Fe2O3纳米铝热剂经点燃后,反应过程中的最大压力依次为6.05,5.63,3.33 MPa和1.6 MPa,升压速率依次为2.81,2.93,0.99 GPa∙s-1和0.07 GPa∙s-1。对比可知,Al@NaIO4和Al@KIO4纳米铝热剂的升压速率和压力峰值均大于Al/CuO 和Al/Fe2O3纳米铝热剂,这是因为碱金属纳米铝热剂在燃烧过程中释放的气体产物多,产生的压力大。同时结合热分析的结果,KIO4和NaIO4分别自307.5 ℃和288 ℃左右开始分解产生气体后,其不断多步分解产生大量气体产物并伴随着反应的全过程。反应过程中释放气体产物速率越快,升压速率越快,最终使得Al@KIO4和Al@NaIO4两种碱金属盐纳米铝热剂表现出较好的定容燃烧性能。
3.4 吸湿性分析
在实际使用过程中常要求含能材料应具有良好的耐潮湿能力。碱金属盐NaIO4和KIO4作为纳米铝热剂中重要的氧化剂,其吸湿性对纳米铝热剂的整体性能有决定性的影响。按照国军标GJB5891.9-2006 方法《火工药剂实验方法第9 部分:吸湿性测定》评估Al@NaIO4和Al@KIO4两种纳米铝热剂的吸湿性能。
实验中选取空磨口称量瓶作为空白对照组,Al@NaIO4和Al@KIO4样品分别进行两组平行实验,其余样品设置一组进行实验,得到的吸湿曲线如图7所示。图7a 反映了Al@NaIO4纳米铝热剂、纳米铝粉、高碘酸钠在30 ℃,相对湿度≥91%条件下质量变化随时间的关系,可以看出,纳米铝粉在16 天的质量增加为0.027%,说明纳米铝粉几乎不吸湿。NaIO4在16 天的质量增加为0.35%。Al@NaIO4纳米铝热剂在前10 天时,质量持续增加约0.64%;10 天以后,基本稳定达到平衡。图7b 中显示KIO4在12 天质量增加不明显,仅为0.08%。Al@KIO4经过大约6 天后达到吸湿平衡,两组平行实验中的吸湿率分别为0.65% 和0.93%。对比数据发现,Al@NaIO4和Al@KIO4的吸湿量要略高于单独的铝粉和NaIO4/KIO4的吸湿量,这是由于喷雾得到的铝热剂的复合结构更加蓬松,使得原本团聚在一起的粒子分散开来,与空气中的O2、H2O分子等的接触面积变大,从而吸湿增重加多,1 g 水、原料NaIO4、喷雾的NaIO4的体积对比如图8 所示。
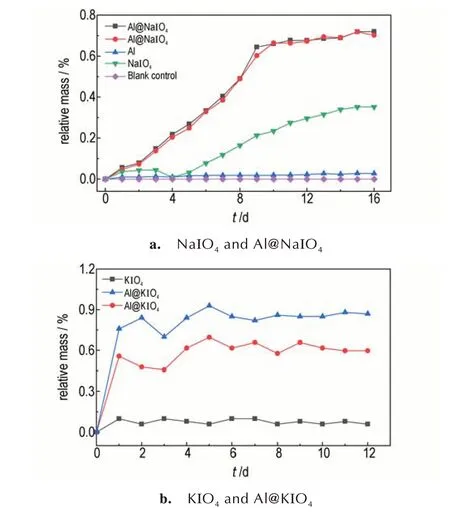
图7 不同物质的吸湿曲线Fig.7 Moisture curves of different samples

图8 1 g 水、原料NaIO4、喷雾的NaIO4实物图Fig.8 The physical pictures of water,raw NaIO4,and sprayed NaIO4
整体而言,NaIO4和KIO4虽然是一种碱金属盐,但是耐吸湿性能良好,将其作为含能材料中的氧化剂具有广阔的应用前景。对比Al@KIO4纳米铝热剂的吸湿结果,Al@NaIO4的吸湿时间较长,但是其吸湿增长过程更稳定,吸湿率更小。综合比较,Al@NaIO4和Al@KIO4两种纳米铝热剂的耐潮湿环境能力良好,这对于药剂的制备、使用和储存有重要的意义。
3.5 起爆能力测试
由上述分析可知,碱金属高碘酸盐纳米铝热剂在燃烧过程中,氧化剂碱金属高碘酸盐的分解温度较低并且分解过程中产生大量气态产物,使得铝热剂配方在弱约束条件下表现出优良的燃烧性能,这些优势是否能用来代替起爆药起爆炸药是非常值得关注的。为了评估上述两种碱金属高碘酸盐纳米铝热剂的起爆性能,将Al@NaIO4和Al@KIO4两种纳米铝热剂作为起爆药装填在8#工业雷管中进行起爆能力测试。8#工业雷管的管壳材质为钢,内径为6 mm,加强帽为铁质,传火孔直径为1.5 mm。雷管中的详细装药结构如图9 所示:管壳底部主装药为450 mg 黑索今,压药压力为40 MPa;中间过渡药为260 mg 太安,轻轻点平,再装入96 mg 纳米铝热剂,轻轻敲击管壳使药剂均匀,盖上加强帽,用10 MPa 压力压合。利用起爆器起爆,以厚度为5 mm、直径为30 mm 的铅板穿孔直径来评价起爆性能,结果如图10 所示。为了比较,在相同装药条件下,对常用起爆药斯蒂芬酸铅(LTNR)和叠氮化铅(LA)也进行了起爆能力测试。

图9 装药结构示意图1─点火头,2─橡胶塞,3─加强帽,4─铝热剂,5─太安,6─钝化黑索今,7─雷管壳,8─铅板Fig.9 Illustration of the charge structure 1─igniter,2─rubber tube,3─stiffened cap,4─thermites,5─PETN,6─RDX,7─detonator shell,8─lead plate
从图10中可以看出,Al@NaIO4、Al@KIO4和叠叠氮化铅可以成功起爆黑索今,使5 mm 厚的铅板穿孔,穿孔直径依次为9.45,9.2 mm 和9.98 mm,而斯蒂芬酸铅则未能使黑索今完全爆轰。对比铅板的穿孔直径,可知这4 种药剂的起爆能力为:LTNR 图10 起爆雷管后的铅板图Fig.10 The lead plates after detonating experiments (1)将纳米铝粉悬浮在碱金属高碘酸盐水溶液中作为前驱液结合喷雾干燥的方法可以构建出具有核⁃壳结构纳米铝热剂Al@KIO4和Al@NaIO4,制备方法安全,样品的结晶度高、纯度高。 (2)热分析表明,Al@KIO4和Al@NaIO4纳米铝热剂的总放热量分别为1262.12 J∙g-1和1414.7 J∙g-1。该配方的分解反应和铝热反应是连续、不间断的过程。反应呈多步进行,反应过程中产生大量氧化性气态产物的快速扩散使得铝热剂的能量释放更快、更彻底。碱金属纳米铝热剂在降低点火温度、提高反应速率和增大放热量方面更具有优势。 (3)碱金属高碘酸盐纳米铝热剂在燃烧过程中释放的气体产物多,产生的压力大,Al@KIO4和Al@NaIO4两种碱金属盐纳米铝热剂表现出良好的定容燃烧性能。 (4)NaIO4和KIO4在吸湿达到平衡前的质量增加分别为0.35%和0.08%,碱金属高碘酸盐具有优秀的耐潮湿环境能力,将其作为含能材料中的氧化剂具有广阔的应用前景;Al@NaIO4和Al@KIO4纳米铝热剂分别在第10 天和第6 天达到平衡,质量增加约0.64%和0.65%,这两种铝热剂的耐潮湿环境能力良好,对于药剂的制备、使用和储存有重要的意义。 (5)将96 mg Al@NaIO4或Al@KIO4作为起爆药装配到8#工业雷管中能成功使RDX 完全爆轰,使5 mm 厚的铅板穿孔,穿孔直径几乎到达起爆药剂LA的水平。在一些领域,碱金属高碘酸盐纳米铝热剂有望可以部分取代起爆药使用。
4 结论
