高分辨率核磁共振在评估脑梗死患者斑块稳定性及成分的应用观察*
2022-04-16吴经纬吴水仙陈斌
吴经纬 吴水仙 陈斌
(海南医学院第二附属医院,海南 海口 570311)
动脉粥样硬化(Atherosclerosis,AS)形成血栓及管腔狭窄是引发脑梗死的重要原因之一,患者早期有头晕、头痛、言语不清、四肢麻木甚至意识障碍等临床症状[1]。脑梗死救治不及时易引起严重后遗症甚至死亡,故及时诊断在脑梗死的治疗中起关键性作用。传统核磁共振血管造影只能显示动脉血管的狭窄程度,无法明确狭窄血管壁结构及造成血管狭窄的因素[2]。目前,高分辨率核磁共振成像(High-resolution magnetic resonance imaging,HRMRI)因较高的软组织分辨率,被认为是唯一可活体检测颅内动脉血管壁结构的无创成像技术,并逐渐应用于颅内AS血管壁和斑块特征的诊断研究中[3]。本研究旨在运用HRMRI检测脑梗狭窄动脉血管壁斑块分布及成分,探究斑块稳定性与脑梗死的关系,为脑梗死的临床评估及诊治提供参考依据,现报告如下。
1 资料与方法
1.1 一般资料 收集2019年6月~2021年6月我院行HRMRI检测的脑梗死及短暂性脑缺血发作(Transient ischemic attack,TIA)130例患者。纳入标准:①有两个以上引起AS的危险因素。②入院1周内行HRMRI成像检查。③HRMRI血管成像提示单侧大脑中动脉(Middle cerebral artery,MCA)及劲内动脉(Internal carotid artery,ICA)狭窄[4-5]。排除标准:①合并血液循环系统疾病、自身免疫性疾病。②有HRMRI检査禁忌证。③有非AS血管病变者,如血管炎症、冠状动脉肌纤维发育不良等。④栓塞风险的患者,如房颤、深静脉血栓等[6-7]。按上述标准收集2019年6月~2021年6月入院行HRMRI检测的脑梗死及TIA患者的临床病例资料130例,将72例脑梗死患者作为观察组,58例TIA患者作为对照组。
1.2 研究方法 所有患者均采用Ingenia Ⅱ 3.0T磁共振扫描仪(飞利浦公司,荷兰,国械准字20153282757)仰卧位进行动脉扫描[8]。设置扫描参数包括重复时间(Repetition time,TR)、回波时间(Echo time,TE)、激励次数(Number of excitation,NEX)、矩阵、厚度及间距等[9]。MCA的颅内HRMRI行黑血技术中的T1加权成像序列(T1 weighted imaging,T1WI),T2加权成像序列(T2 weighted imaging,T2WI),液体衰减反转恢复序列(Fluid attenuated inversion recovery,FLAIR)及弥散加权成像(diffusion weighted imaging,DWI)。扫描参数:①T1WI序列TR 1000 ms、TE 9 ms、NEX 2次、矩阵为180 mm×144 mm、层厚2 mm、层间距0 mm。②T2WI及FLAIR序列TR 8000 ms、TE 105 ms、NEX 1次、矩阵为180 mm×144 mm、层厚2 mm、层间距0 m。③DWI序列TR 6000 ms、TE 72 ms、NEX 1次、矩阵为128 mm×128 mm、层厚6 mm、层间距1 mm。ICA采用8通道专用线圈行“亮血”技术中的三维时间飞跃法(3D-time of flight,3D-TOF)及磁共振血管成像(MR angiography,MRA)。扫描方式:先行3D-TOF进行动脉血管成像扫描定位,然后于MCA狭窄横轴位处行黑血高分辨率T1WI、T2WI序列扫描。扫描参数:①TOF-MRA的TR 22 ms、TE 3.5 ms、NEX 1次、矩阵为330 mm×220 mm、层厚0.6 mm、层数140。②T1WI序列TR 800 ms、TE 10 ms、NEX 2次、矩阵为180 mm×144 mm、层厚2 mm、层间距0 mm。③T2WI及FLAIR序列TR 4000 ms、TE 50 ms、NEX 1次、矩阵为180 mm×144 mm、层厚2 mm、层间距0 mm。利用规格为20 mL(0.5 mol/L)的X线造影剂钆喷酸二甲葡胺(康臣药业有限公司,广州,国药准字H10950270)静脉注射,0.1 mmoL/kg。注射后5 min强化成像,再注射等量0.9%氯化钠注射液(福星生物药业有限公司,武汉,国药准字H42022222)进行冲洗。所得图像均进行相应处理,由2名专业影像科医师进行阅片,评估、分析患者动脉血管斑块情况。
1.3 观察指标 ①斑块位置。根据HRMRI图像分析动脉血管壁斑块的位置,将其分为前、后、上、下壁。②动脉斑块分型标准[10]。Ⅰ~Ⅱ型:血管壁厚度近似正常,无钙化;Ⅲ型:血管内膜弥漫性或偏心性增厚或有较小斑块,无钙化;Ⅳ~Ⅴ型:可见较大斑块且内含纤维包裹的脂质核心,可见少量钙化;Ⅵ型:斑块成分复杂,表面溃疡出血或内部形成血栓;Ⅶ型:斑块呈钙化;Ⅷ型:无脂核核心纤维斑块,可见少量钙化。其中Ⅰ~Ⅲ型、Ⅶ~Ⅷ型为稳定性斑块,Ⅳ~Ⅵ型为不稳定性斑块,易破损出血导致脑缺血。③动脉斑块负荷参数:对比两组最狭窄处血管总面积(Total vascular area,TVA)、管腔面积(Lumen area,LA)、管壁面积(Wall area,WA)、管壁标准化指数(Normalized wall index,NWI)、血管重构指数(Remodeling index,RI)。④记录两组坏死脂质核心、斑块内出血、纤维帽破裂及管腔狭窄发生情况。
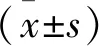
2 结果
2.1 两组一般资料比较 将脑梗死患者作为观察组,共72例,TIA患者为对照组,共58例。观察组中男性47例,女性25例;平均年龄(55.86±15.57)岁;高血压60例,糖尿病15例,冠心病5例;吸烟35例;饮酒31例;对照组中男性35例,女性23例;平均年龄(56.12±16.33)岁;高血压42例,糖尿病11例,冠心病3例;吸烟26例;饮酒20例。两组患者在性别、年龄、合并症、吸烟及饮酒史等比较无统计学意义(P>0.05)。
2.2 两组斑块位置比较 观察组斑块多集中于后壁及上壁,对照组集中在前壁及下壁,两组斑块位置比较差异有统计学意义(P<0.05),见表1。
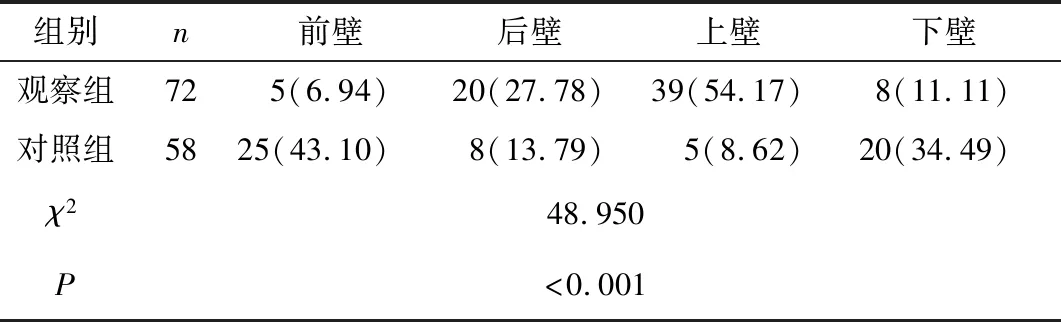
表1 两组斑块位置对比[n(×10-2)]Table 1 Comparison of plaque location between the two groups
2.3 两组斑块稳定性比较 观察组不稳定性斑块的占比明显多于对照组,差异具有统计学意义(P<0.05),见表2。
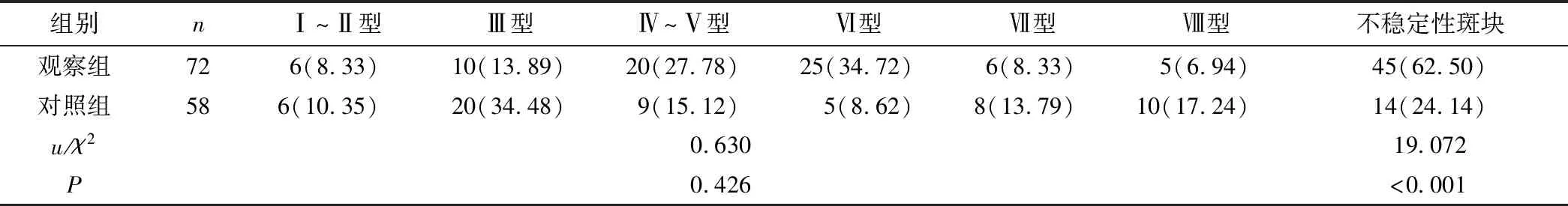
表2 两组斑块稳定性对比[n(×10-2)]Table 2 Comparison of plaque stability between the two groups
2.4 两组动脉斑块负荷参数比较 观察组LA明显小于对照组,NWI、RI明显高于对照组(P<0.05);两组TVA、RI比较差异无统计学意义(P>0.05),见表3。
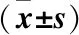
表3 两组动脉斑块负荷参数对比Table 3 Comparison of arterial plaque load parameters between the two groups
2.5 两组血管成分比较 观察组坏死脂质核心、斑块内出血及纤维帽破裂的例数及比率明显高于对照组(P<0.05);两组管腔狭窄率比较差异无统计学意义(P>0.05),见表4。
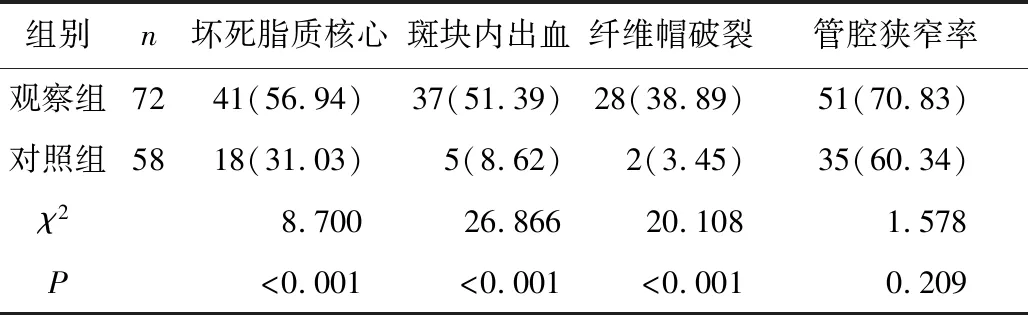
表4 两组斑块位置对比[n(×10-2)]Table 4 Comparison of plaque location between the two groups
2.6 典型脑梗死HRMRI成像 大脑中动脉(MCA)的HRMRI成像(图1),颈动脉(ICA)的HRMRI成像(图2)。
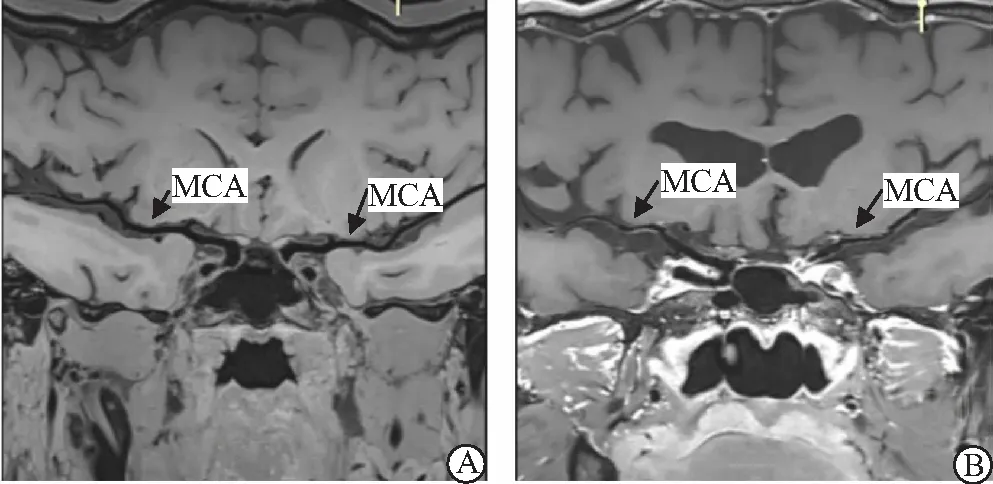
图1 大脑中动脉HRMRI成像Figure 1 HRMRI imaging for middle cerebral artery注:A.正常双侧大脑中动脉成像,管壁无增厚、管腔无狭窄及斑块;B.男性患者,年龄58岁,诊断为左侧大脑中动脉脑梗死,HRMRI成像显示大脑中动脉M1段管壁增厚,管腔狭窄,上壁斑块呈钙化
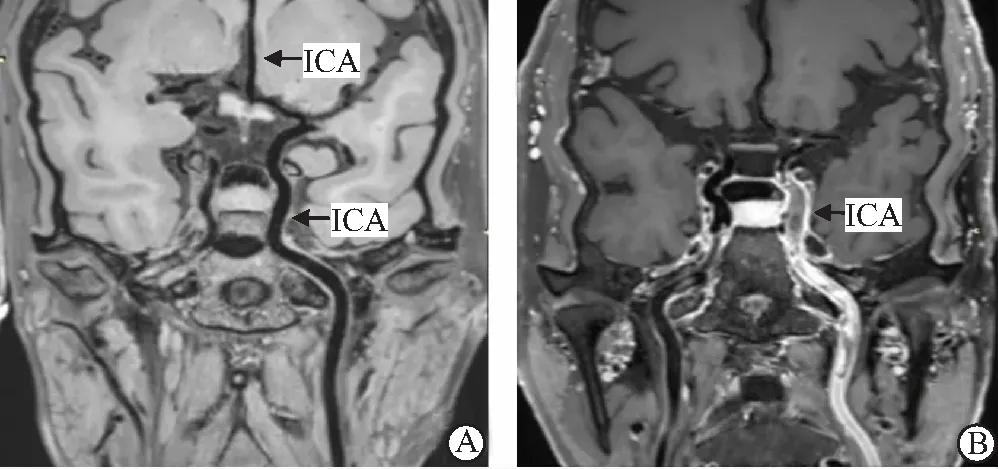
图2 颈动脉HRMRI成像 Figure 2 HRMRI imaging of internal carotid artery注:A.正常左颈内动脉及大脑前动脉成像,管壁无增厚、管腔无狭窄及斑块;B.男性患者,年龄61岁,诊断为左颈内动脉脑梗死,HRMRI成像显示左颈内动脉管壁增厚,血流动力学变化,斑块呈高信号,管腔内血栓且提示血栓增强
3 讨论
AS指动脉血管壁内皮组织因各种损伤而发生管腔狭窄或形成血栓的一种慢性炎症反应,是脑梗死和TIA最常见病因[11]。AS造成MCA或ICA狭窄、血流动力学改变、血栓等情况的出现,易引发血管内形成斑块,脑梗死及TIA除具有相同的病因及危险因素外,皆有血管内斑块的存在引起缺血性事件发生,且TIA易继发脑梗死[12]。HRMRI不仅能反映斑块形态及成分,也能呈现斑块具体分布特性,为AS疾病的评估提供更全面、准确的斑块相关内容。临床研究多用MRI或HRMRI对脑梗死及TIA进行影像学特征的对比分析[13]。故早期对AS患者的斑块特性进行明确的影像学诊断,不仅可以鉴定非TIA继发性脑梗死,而且有助于脑梗死的防治,减轻斑块对患者的损害[14]。
研究[15]表明,远端血管分支能受到斑块分布的潜在影响,特别是MCA、ICA等分支较多的血管,若此类血管分支开口处出现斑块,其脱落可导致分支开口处动脉血栓形成,增加脑梗死的风险,而临床传统血管影像学技术无法明确斑块在分支动脉开口处的位置,HRMRI可能弥补其在斑块诊断中的不足。本研究结果显示,脑梗死患者的斑块主要分布于后壁及上壁,TIA患者的斑块集中在与分支开口处相对的前壁及下壁,两者斑块位置位置比较差异有统计学意义(P<0.05),提示通过HRMRI检测到的斑块分布可以鉴别脑梗死或TIA,有利于诊断非分支开口处血管病变患者,对早期形成的AS斑块进行有效干预。可能原因为斑块形成于血管后壁或上壁时,阻塞分支小血管造成长期缺血梗死的可能性更大,而当斑块存在于分支开口相对处的前壁及下壁时,分支开口受阻风险小,伴随患者活动而出现阻塞动脉管腔引起局部缺血症状,与TIA的症状相符。以往研究[16]曾报道,斑块脱落与血管部位及血管狭窄程度互相成为促进因素,形成恶性循环,斑块在长期血流冲击下脱落,栓塞远端细小血管,引发TIA或脑梗死。因此,HRMRI可解释AS斑块分布位置及与动脉小血管分支开口的关系,帮助AS患者制定诊疗方案,为进一步确诊脑梗死提供诊断依据。
临床常根据HRMRI图像中呈现的斑块内钙化成分、脂质核心、纤维帽及出血等结果,评估斑块的稳定性[17]。陈伟红等[18]将HRMRI应用于后循环缺血性卒中的AS影像学分析中,通过高分辨率的斑块特征得出斑块出现高信号可能与血栓栓塞有关,他们认为炎性反应使内皮细胞通透性和细胞外间质体积增加致斑块钙化,这可能是同一血管区发生脑梗死的原因。本研究结果显示脑梗死患者AS斑块的不稳定性率比TIA患者高,管腔狭窄情况比TIA患者严重,NWI及RI都比TIA患者高,说明HRMRI可评估脑梗死患者AS血管内斑块情况,且脑梗死与TIA有不同斑块特性,脑梗死患者斑块稳定性更差。分析其原因可能为HRMRI的优势在于其拥有传统MRI欠缺的黑血序列技术及亮血序列技术。黑血技术中的T1WI序列所显示的图像更加清晰,能有效捕捉管腔内血流强弱信号,清晰呈现动脉管壁情况,精确对比斑块差异,提高医师对斑块成分鉴定、测量评估的准确率;亮血技术中的3D TOF及MRA扫描可定位斑块,尤其是动脉分叉处,可解释斑块分布于动脉分叉的关系,及早区分脑梗死及TIA,两种技术在诊断动脉粥样硬化方面具有较高的应用价值[19]。另外,本研究结果显示,脑梗死患者的斑块内岀血、纤维帽破裂及脂质核心坏死发生率比TIA高,说明早期检测斑块成分及特征情况对脑梗死的预防有重大意义。原因在于脂质核心坏死对斑块稳定性有较大影响,脂质核心占比高时斑块极易破裂,就病理特征而言,斑块内出血与脑梗死临床表现密切相关,纤维帽破裂或脱落阻塞颅内血管从而造成脑梗死,脂质核心、斑块出血及纤维帽破裂同为易损斑块的评价指标[20]。因此,早期通过HRMRI识别易损斑块,能及时进行有效干预,避免斑块严重病变。
4 结论
高分辨率核磁共振可以清晰呈现血管斑块的影像学特征,客观准确地对斑块的稳定性及成分进行多方位成像,对早期评估与诊断脑梗死具有重要意义,对及时改善患者脑梗死情况有全面参考价值,可广泛应用于临床中。
