脑胶质瘤细胞外泌体对血管新生的影响及其机制
2022-04-16许乐宜张敏孔令军王静予费智敏
许乐宜 张敏 孔令军 王静予 费智敏
(1.上海中医药大学附属曙光医院神经外科,上海 201203;2.上海中医药大学,上海 201203)
脑胶质瘤是发病于成人中枢神经系统的原发性实体瘤,占原发性中枢神经系统恶心肿瘤的46.1%,世界卫生组织(WHO)依据其病理特点将之分为4级,分别为Ⅰ级、Ⅱ级、Ⅲ级和Ⅳ级,恶性程度最高的恶性肿瘤患者的5年生存率极低,且中位生存期仅为12~15个月,预后极差,其主要的治疗方法为手术切除及放化疗,但是外科手术难以完全切除肿瘤,并且手术后放化疗效果不佳,肿瘤复发严重[1-2]。因此,深入探讨脑胶质瘤的发生发展机制从而寻找有效的治疗方法至关重要。抗血管新生是临床上肿瘤治疗的常用策略[3],但是脑胶质瘤微环境中含有大量的异质性新生血管,临床上针对血管内皮生长因子(Vascular endothelial growth factor,VEGF)的药物,如贝伐单抗等对于其治疗效果并不佳[4]。外泌体是一类由大多数活细胞分泌的纳米级囊泡,肿瘤细胞可分泌外泌体调控肿瘤微环境[5-6],而脑胶质瘤细胞外泌体是否能够作用于VEGF而调控肿瘤血管新生尚无明确研究。因此,本研究探讨了脑胶质瘤外泌体对血管新生的影响及机制。
1 材料与方法
1.1 材料 人脑胶质瘤细胞株U373、U87,人脐静脉内皮细胞HUVEC,人脑胶质细胞HEB(中科院上海生化细胞所),Transwell小室、Matergial胶(福麦斯生物技术有限公司),细胞凋亡检测试剂盒(沈阳万类生物技术有限公司),Bax、Caspase3、Caspase9、VEGF、VEGFR2、p-AKT、AKT、GAPDH一抗、山羊抗兔二抗(沈阳万类生物技术有限公司)。
1.2 细胞培养 取液氮保存的HEB、U373、U87细胞于37℃水浴锅中迅速解冻,离心后重悬于含10%胎牛血清的DMEM高糖培养基中,于37℃,5%CO2培养箱中培养;HUVEC细胞培养于含10%胎牛血清及1%的内皮细胞生长因子的DMEM高糖培养基中;当细胞生长至汇合率达80%时进行传代。
1.3 外泌体的提取与鉴定 将对数生长期的HEB、U373、U87细胞培养基更换为10%的无外泌体胎牛血清的DMEM培养基,培养48 h后收集细胞培养上清液,使用差速离心法提取细胞培养上清中外泌体,具体步骤:将上清液3000×g,4℃离心15 min去除死细胞;然后将上清液6000×g离心40 min,去除细胞碎片;10000×g离心1 h,取上清;100000×g离心1 h,收集沉淀即为外泌体,用400 μL PBS重悬外泌体,并放在-80℃保存。使用透射电镜拍照观察外泌体的形态结构:将透射电镜所用的铜网平放到称量纸上,滴加20 μL外泌体溶液,红外灯下烘烤10 min;烘干后再滴加2滴磷钨酸,继续烘烤10 min,用滤纸吸走多余液体,透射电镜下观察外泌体结构并拍照。Western blot鉴定外泌体标志蛋白的表达,具体步骤:取200 μL外泌体加入50 μL的RIPA蛋白裂解液,于冰上裂解30 min,12000×r,离心15 min后,取上清,即为外泌体总蛋白。采用BCA蛋白定量试剂盒进行蛋白定量,取外泌体蛋白裂解液进行SDS-PAGE凝胶电泳,经转膜,封闭后CD9、CD63、TSG101一抗孵育过夜,然后二抗孵育,洗膜后,曝光成像。
1.4 细胞迁移实验 用不含胎牛血清及血管内皮生长因子的DMEM培养基重悬HUVEC细胞,调整HUVEC细胞密度至5×104个/mL,并取200 μL上述HUVEC细胞接种至Transwell小室中,每个小室加入外泌体并使其终浓度为0.2 μg/μL,每组3个复孔,小室放置于含有600 μL完全培养基的24孔板,使其底部完全浸入培养基中,并将24孔板置于37℃,5%CO2培养箱培养24 h,取出小室用PBS清洗3次,小室倒扣,底部用甲醇固定30min,晾干后用结晶紫对小室底部染色10 min,清洗并晾干后,在显微镜下观察拍照。
1.5 细胞增殖 取对数生长期的HUVEC细胞,调整细胞密度至3×104个/mL,于96孔板中每孔加入100 μL上述细胞稀释液,并且设置24、48、72 h时间梯度,按相同的方法平行接种3块相同的96孔板;96孔板细胞完全贴壁后,每孔加入外泌体并使其终浓度为0.2 μg/μL,然后将3块96孔板放置在培养箱中培养,分别于24、48、72 h后取出对应的96孔板,避光向每孔中加入10 μL的CCK-8试剂,继续在培养箱中培养2 h,然后使用酶标仪在450 nm波长处检测每孔的吸光度,以空白组吸光度为背景值。
1.6 小管形成实验 4℃条件下融化Matrigel胶,96孔板中每孔加入50 μL Matrigel胶,轻轻摇晃96孔板,使Matrigel胶均匀覆盖于96孔板底部,37℃培养箱中放置30 min,使Matrigel胶充分凝固。取对数生长期的HUVEC细胞,调整细胞密度至3×105个/mL,于96孔板中每孔加入100 μL细胞稀释液,然后每孔加入外泌体并使其终浓度为0.2 μg/μL,每组3个复孔,于37℃,5%CO2培养箱中培养6 h,然后在显微镜下观察并拍照,使用Image J软件计算小管形成。
1.7 细胞凋亡 取3×105个对数生长期的HUVEC细胞接种于6孔板中,每孔加入外泌体并使其终浓度为0.2 μg/μL,每组3个复孔,共孵育48 h后进行细胞凋亡检测。根据细胞凋亡检测试剂盒,每孔取5×105个HUVEC细胞于离心管中,用500 μL的Binding Buffer重悬细胞成单细胞悬液,而后添加5 μL的Annexin V-FLTC和5 μL的PI染料,混匀后室温避光孵育15 min,并设置Annexin V-FLTC和PI单阳性管用于调荧光补偿,空白管用于调电压。使用流式细胞仪检测上述各样品的荧光值,使用FlowJo v5.573软件分析细胞凋亡数。
1.8 Western blot检测蛋白水平 取3×105个对数生长期的HUVEC细胞接种于6孔板中,每孔加入外泌体并使其终浓度为0.2 μg/μL,每组3个复孔,共孵育48 h后,每孔细胞加入120 μL的RIPA蛋白裂解液和1.2 μL的PMSF蛋白酶抑制剂,冰上裂解30 min后12000×r,4℃离心10 min,取上清,即为细胞总蛋白。BCA蛋白定量后蛋白沸水浴加热变性,然后进行SDS-PAGE凝胶电泳,转膜,用5%的脱脂牛奶对PVDF膜封闭2 h,然后以1:1000比例稀释后的VEGF、GAPDH一抗4℃孵育过夜,TBST洗膜后二抗室温孵育1.5 h,再用TBST洗膜后按照ECL试剂盒说明书配置发光液,并将PVDF膜浸入发光液中反应30 s,曝光并拍照,用Image J软件对曝光结果进行定量分析。
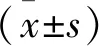
2 结果
2.1 外泌体鉴定结果 透射电镜观察外泌体结构显示,外泌体具有双层膜结构,形态呈“杯托”状,粒径在50~100 nm,符合外泌体的形态结构,见图1;Western blot检测结果显示,提取的外泌体表达标志蛋白CD63、CD9、Alix,见图2。
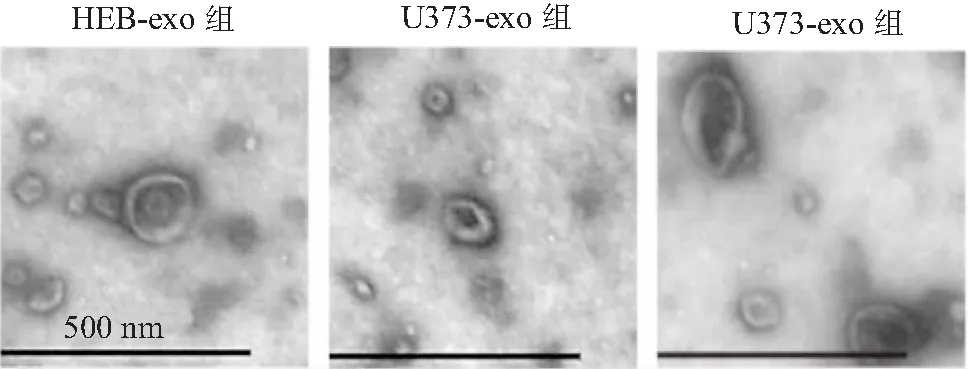
图1 透射电镜观察外泌体形态结构Figure 1 Observation of the morphology and structure of exosomes by transmission electron microscope
2.2 脑胶质瘤外泌体促进HUVEC迁移能力 细胞迁移检测结果显示,HEB-exo组HUVEC细胞迁移数目与PBS组比较差异无统计学意义(P>0.05);U373-exo和U87-exo组HUVEC细胞迁移数目显著高于PBS组(P<0.05),见图3。说明脑胶质瘤外泌体能够显著促进HUVEC细胞迁移能力。
2.3 脑胶质瘤外泌体促进HUVEC细胞增殖能力 CCK-8法检测细胞增殖能力结果显示,相比于PBS组,HEB-exo组HUVEC细胞增殖能力无显著变化(P>0.05);而U373-exo和U87-exo组HUVEC细胞24、48、72 h增殖能力显著高于PBS组(均P<0.05),见图4。这提示脑胶质瘤外泌体能够显著促进HUVEC细胞增殖能力,从而促进血管新生。
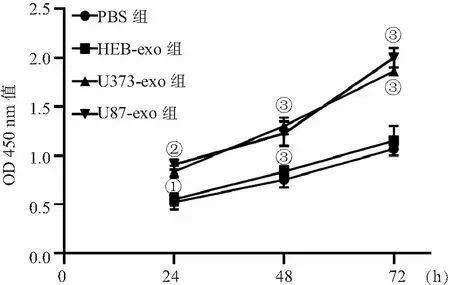
图4 CCK-8法检测脑胶质瘤外泌体对HUVEC增殖能力的影响Figure 4 CCK-8 method to detect the effect of glioma exosomes on the proliferation of HUVEC注:与PBS组相比,①P<0.05,②P<0.01,③P<0.001
2.4 脑胶质瘤外泌体促进HUVEC细胞小管形成 小管形成实验结果显示,HEB-exo组HUVEC小管形成与PBS组比较差异无统计学意义(P>0.05),而U373和U87细胞所分泌的外泌体能够显著促进HUVEC细胞体外小管形成(P<0.001),见图5。这说明脑胶质瘤外泌体能够显著促进体外小管形成。
图5 小管形成实验检测脑胶质瘤外泌体对小管形成的影响Figure 5 Tubule formation experiment to detect the effect of glioma exosomes on tubule formation注:与PBS组相比,①P<0.001
2.5 脑胶质瘤外泌体抑制HUVEC细胞凋亡 流式细胞术检测结果显示,HEB-exo组HUVEC细胞凋亡率与PBS组比较差异无统计学意义(P>0.05);U373-exo和U87-exo组HUVEC细胞凋亡率均显著低于PBS组(均P<0.01),见图6。Western blot检测结果显示,U373-exo和U87-exo组HUVEC细胞促凋亡蛋白Bax、Caspase3、Caspase9表达水平均显著低于PBS组(P<0.001),见图7。说明脑胶质瘤外泌体能够显著抑制抑制促凋亡蛋白的表达而抑制HUVEC细胞凋亡。

图6 流式细胞术检测脑胶质瘤外泌体对HUVEC凋亡的影响Figure 6 Flow cytometry to detect the effect of glioma exosomes on HUVEC apoptosis注:与PBS组相比,①P<0.01,②P<0.001
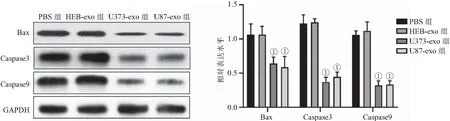
图7 Western blot检测脑胶质瘤外泌体对凋亡蛋白表达的影响Figure 7 Western blot to detect the effect of brain glioma exosomes on the expression of apoptotic proteins注:与PBS组相比,①P<0.001
2.6 脑胶质瘤外泌体对VEGF信号通路的影响 Western blot检测结果显示,相比于PBS组,HEB-exo组HUVEC细胞VEGF、VEGFR2表达水平及AKT磷酸化水平比较差异均无统计学意义(P>0.05);而U373-exo和U87-exo组HUVEC细胞VEGF、VEGFR2表达水平显著高于PBS组(P<0.001),AKT磷酸化水平亦显著高于PBS组(P<0.001),见图8。说明脑胶质瘤外泌体能够促进VEGF、VEGFR2的表达进而激活促血管生成的AKT信号通路。
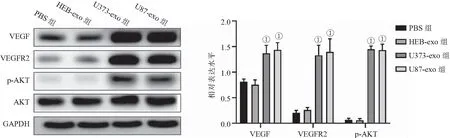
图8 Western blot检测脑胶质瘤外泌体对VEGF信号通路的影响Figure 8 Western blot to detect the effect of glioma exosomes on the VEGF signaling pathway注:与PBS组相比,①P<0.001
3 讨论
脑胶质瘤是一般来自于原始胚胎神经细胞或者为其他神经胶质细胞在颅内的原发肿瘤,临床上脑胶质瘤的主要治疗手段有手术治疗及放、化疗等[7-8],但由于脑胶质瘤血管密集,血运丰富,肿瘤细胞的浸润性极高,不能准确区分肿瘤组织的边界,为外科手术的治疗带来了极大的挑战,所以探究脑胶质瘤血管新生的机制,对于提高脑胶质瘤的治疗效果至关重要[9-10]。肿瘤微环境中的血管新生不仅可以为肿瘤的生长提供给氧气和营养物质,还参与肿瘤细胞的远端转移以及肿瘤的复发[11]。血管新生在正常生理条件下受到严格的调控,只有在病理条件或者特殊的情况下才能够被激活,并且血管过度的生成以及缺陷都会导致疾病的发生、发展。正常生理条件下的大部分血管呈现发育成熟静止状态,但是血管内皮细胞仍具有对生理刺激产生应答反应而快速增殖和迁移的能力,在接受外界信号刺激后,血管内皮细胞启动增殖迁移的应答反应,开始血管新生的生理过程[12-14]。外泌体是一种由细胞分泌的粒径在30~100 nm的纳米级囊泡,可包裹RNA、蛋白质、脂质等生物活性物质,能够与靶细胞受体结合或水平传递生物活性物质而发挥生物学功能,包括血管新生、免疫逃逸、肿瘤耐药等[15-18]。
已有研究[19-21]表明,肿瘤外泌体具有调控血管新生的功能,例如卵巢癌外泌体miR-205能够诱导血管新生而促进肿瘤的转移,胃癌外泌体miR-130a可靶向血管内皮细胞C-MYB而诱导血管新生,宫颈鳞状细胞癌外泌体miR-221-3p可靶向THBS2而诱导血管新生。本研究脑胶质细胞U373和U87细胞所分泌的外泌体相比于正常脑胶质细胞外泌体能够显著促进血管内皮细胞的增殖、迁移以及体外小管形成能力、抑制血管内皮细胞的凋亡能力,并且下调促凋亡蛋白Bax、Caspase3、Caspase9表达水平。说明脑胶质瘤细胞外泌体能够促进血管内皮细胞血管形成的能力。
血管新生受多种细胞因子的调控,如肿瘤坏死因子(Tumor Necrosis Factor,TNF)、VEGF、血管紧张素Ⅰ/Ⅱ(Angiotensin,AngⅠ/Ⅱ)等[22-24]。其中,VEGF是属于血小板源性生长因子家族超家族之一,是促血管活性因子中活性最强、特异性最高的血管生成因子,VEGF与其受体特异性结合后能够激活酪氨酸激酶信号通路,促进血管内皮细胞的生长和增殖,诱导血管新生,并且增加血管的通透性,促进肿瘤的转移[25]。脑胶质细胞U373和U87细胞外泌体可促进促血管生成因子VEGF及其受体VEGFR2的表达,促血管新生的PI3K/AKT信号通路中AKT的磷酸化水平显著增加,PI3K/AKT信号通路被激活。PI3K/AKT信号通路是调控血管新生的重要通路,激活PI3K/AKT信号通路可诱导膀胱癌、皮肤癌、非小细胞肺癌等肿瘤的血管新生[26-28]。本研究发现脑胶质瘤外泌体可调控VEGF表达和PI3K/AKT信号通路而促进血管新生。
4 结论
脑胶质瘤细胞U373和U87外泌体能够促进体外血管新生,其机制为上调VEGF的表达,激活PI3K/AKT信号通路。
