解脂耶氏酵母合成萜烯的进展:见微知著的改造策略
2022-04-15戴宗杰王钦宏
刘 琪,戴宗杰,王钦宏
(1.中国科学院 天津工业生物技术研究所 中国科学院系统微生物工程重点实验室,天津 300308;2.国家合成生物技术创新中心,天津 300308;3.天津科技大学 生物工程学院,天津 300457)
萜类化合物也称为类异戊二烯类化合物,是自然界广泛存在的一种次级代谢物,几乎在所有单细胞或多细胞生物(包括细菌,古细菌,原生生物和真核生物)中都有发现,并发挥着重要功能[1]。所有的萜类化合物均衍生自C5单元前体化合物异戊烯基二磷酸(IPP)及其异构体二磷酸二甲基烯丙酯(DMAPP),种类繁多且结构多样,根据C5单元数量的不同可以分为单萜(C10)、倍半萜(C15)、二萜(C20)、三萜(C30)和四萜(C40)等[2]。因萜类化合物在食品、医药、香料香精和生物燃料等领域具有重要价值,其需求量亦日益增加[3]。
传统上,萜类化合物主要通过化学合成或植物提取的方法进行生产。但萜类化合物具有杂环或手性碳等化学合成难度高的结构,导致化学合成效率低、成本高[4]。植物中萜类化合物的含量低,并且纯化时易受杂质影响导致难以获得纯提取物。此外,许多植物因受到严格的地理和气候条件限制而生长缓慢,原材料获取难度高,所以植物提取的方式不适合大规模工业生产萜类化合物[5-6]。融合了生物学、化学、物理学、信息学与人工智能等学科的代谢工程与合成生物学为利用异源底盘细胞进行萜类化合物大规模生产提供了新思路。
合适的底盘细胞对萜类化合物的生物合成至关重要。研究者们已经在模式菌株大肠杆菌和酿酒酵母中成功实现了多种功能性萜类及衍生物的生产[7-8]。但是,大肠杆菌存在内毒素、乙酸胁迫和缺乏转录后修饰与完整的内膜系统等缺点,限制了许多真核来源的基因表达和目标产物合成的效率[9-10]。与大肠杆菌相比,酿酒酵母虽然具有完整的翻译后修饰和细胞器及内膜系统,但酿酒酵母存在较高的培养基需求及以葡萄糖为碳源进行有氧发酵时存在合成乙醇的Crabtree效应等缺点,限制了其工业化应用[5,11]。
非传统酵母——解脂耶氏酵母因其高效的脂质积累和多底物利用能力且对多种有机溶剂、高渗透压和酸碱环境的耐受性而备受关注,日渐成为合成生物学研究与代谢工程改造的底盘菌株[12]。随着对解脂耶氏酵母生理代谢研究的不断深入和遗传改造技术(如,CRISPR/Cas、Cre/LoxP等)的快速发展,解脂耶氏酵母代谢工程改造的进程加快[13]。解脂耶氏酵母与酿酒酵母、大肠杆菌作为萜类化合物细胞工厂特性比较[5]见表1。

表1 3种萜类化合物细胞工厂的特征比较
充足的前体物质供应和优良的产物储存能力是解脂耶氏酵母进行萜类化合物合成的优势。近年来,解脂耶氏酵母已被工程化地用于合成多种萜类化合物,例如柠檬烯、芳樟醇、α-法尼烯、角鲨烯、β-胡萝卜素、番茄红素和虾青素等[14-36](表2),表现出巨大的工业化应用潜力(图1)[14]。
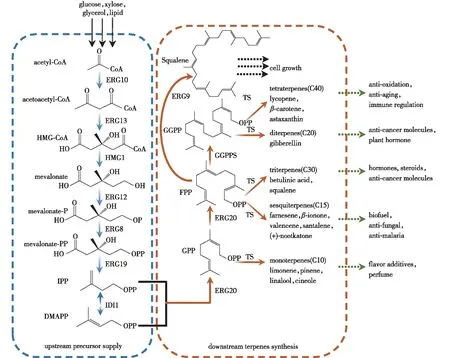
ERG10—acetyl-CoA acetyltransferase; ERG13—HMG-CoA synthase; HMG1—HMG-CoA reductase; ERG12—mevalonate kinase; ERG8—phosphomevalonate kinase; ERG19—mevalonate diphosphate decarboxylase; IDI1—IPP isomerase; ERG20—farnesyl pyrophosphate synthetase; ERG9—squalene synthase; TS—terpene synthase; GPP—geranyl diphosphate; FPP—farnesyl diphosphate; GGPP—geranylgeranyl diphosphate
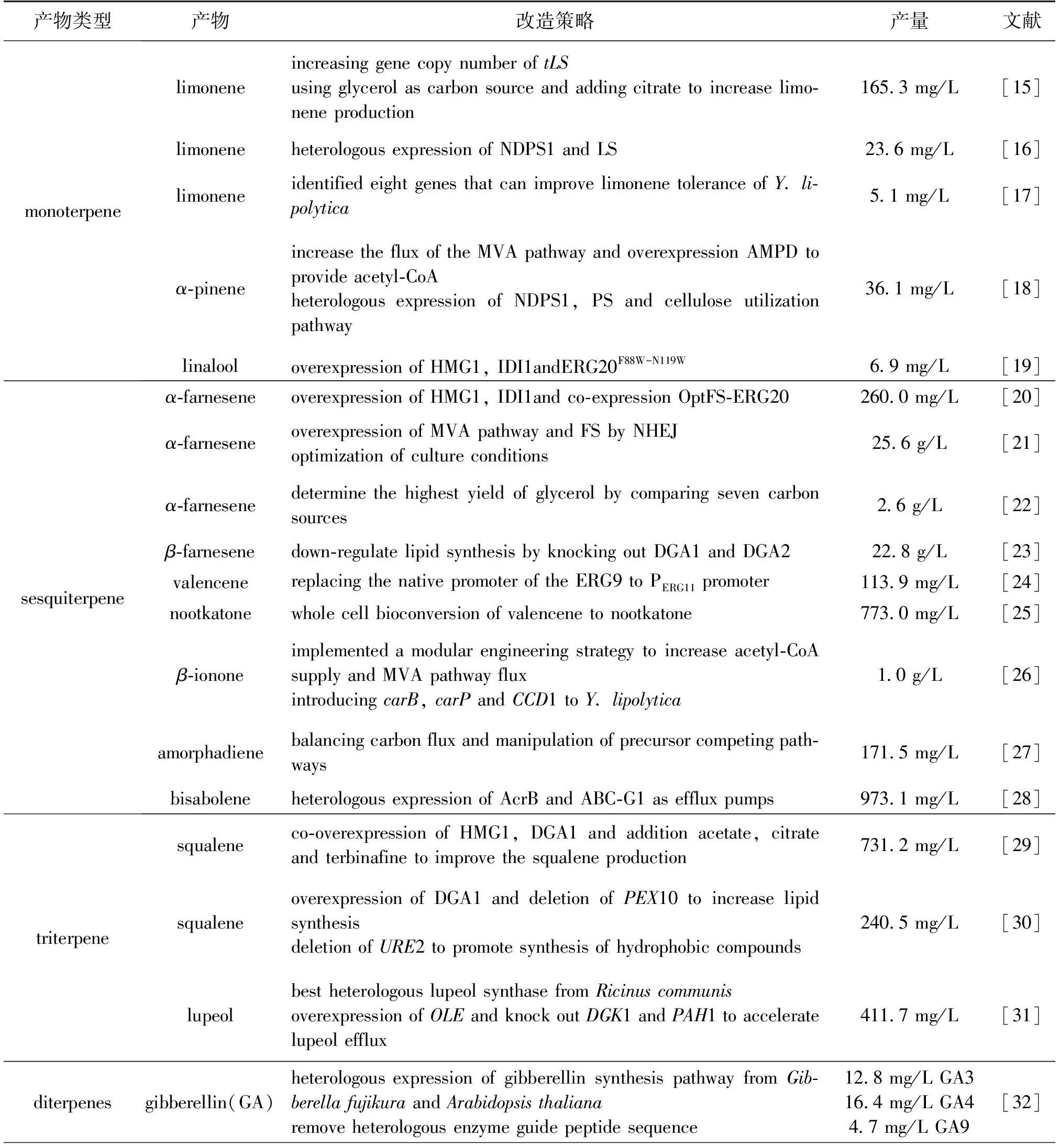
表2 解脂耶氏酵母中合成萜烯的代表性实例
因此,本文从关键酶挖掘与改造、代谢途径优化与设计、细胞器工程以及细胞全局水平调控这4个层次总结了现有解脂耶氏酵母中萜类化合物的合成策略,最后展望了进一步提高该宿主中萜类化合物产量的研究方向与工程方法,旨在为利用解脂耶氏酵母生产萜类化合物提供新的策略。
1 酶与途径工程
1.1 萜烯合酶的挖掘
目前已经分离鉴定出超过80 000种天然萜类化合物,功能多样的萜烯合酶(TS)是合成结构多样的萜类化合物的基础[37-38]。萜烯合酶的挖掘与产物合成一般在遗传操作工具成熟的模式菌株如酿酒酵母或大肠杆菌中进行。解脂耶氏酵母的萜烯合成所用萜烯合酶大都已经在大肠杆菌或者酿酒酵母中应用,如来自苹果的α-法尼烯合酶和来自天竺葵的柠檬烯合酶[15, 21]。然而,由于不同底盘细胞底物的供给水平以及内环境的差异,会导致同种萜烯合酶在不同底盘菌株中合成效率的差异化。因此,需要挖掘表征更多其他物种来源的萜烯合酶以提高解脂耶氏酵母萜类化合物的多样性与生产效率。
同一种萜烯化合物可由不同的底物经酶催化而来,筛选针对不同底物的萜烯合酶可以使萜类化合物的合成多样化。一般情况下,单萜由香叶基二磷酸(GPP)转化而来,但Schilmiller等[39]发现二磷酸橙花酯合酶(NDPS1)可催化DMAPP和IPP生成NPP(二磷酸橙花酯),而以NPP为底物可以生成多种单萜。将NDPS1引入解脂耶氏酵母,以NPP为底物合成单萜柠檬烯和蒎烯,丰富了单萜的合成路径[16, 18]。除了NPP、GPP外,解脂耶氏酵母中DMAPP和IPP融合还会产生不同的碳骨架,如菊花基二磷酸酯(CPP)、薰衣草基二磷酸酯(LPP)、马康内酯二磷酸酯(MPP)或二磷酸二磷酸酯(PPP)等化合物。针对这些特殊底物的萜烯合酶挖掘鉴定也能有助于进一步丰富萜类化合物家族[40]。鉴于解脂耶氏酵母为底盘具有萜类合成前体乙酰辅酶A和NADPH代谢通量高的优势以及遗传改造工具的不断发展,以解脂耶氏酵母作为底盘进行萜烯合酶挖掘表征与改造尤为必要。
1.2 合成途径设计与优化
萜类化合物生物合成可分为上游前体物质IPP、DMAPP供应和下游萜类物质合成两部分[41]。解脂耶氏酵母内源甲羟戊酸(MVA)途径不仅可以提供萜类合成所需前体物,而且还可提供细胞生长必需物质麦角甾醇的前体物。所以,优化上游前体物质供应、平衡下游萜烯合成与细胞生长之间的关系是利用解脂耶氏酵母生产萜类化合物的重要策略之一。
1.2.1 内源前体合成途径优化
解脂耶氏酵母中萜类化合物合成所需的前体物质由内源MVA途径提供,首先从乙酰辅酶A出发经过6步酶促反应产生IPP,然后通过异戊烯焦磷酸异构酶(IDI)将IPP异构化产生DMAPP,最后再以IPP和DMAPP为供体合成萜类物质的前体物质,如GPP、法尼基二磷酸(FPP)等(图1)。但是,较长的代谢途径存在两方面的缺点:一方面降低了目标产物的代谢通量;另一方面,较多的途径中间体更易受本源代谢网络的调控和限制。因此,过表达限速酶、强化代谢途径整体表达水平是增加MVA途径通量和前体供应的常用手段。
HMG1编码的HMG-CoA还原酶HMGR催化MVA的生成,这一反应是MVA途径的限速步骤[42]。在解脂耶氏酵母中单独过表达HMG1即可增加2倍的紫杉二烯产量和20倍的角鲨烯产量[27, 29]。IDI是MVA途径的另一个关键酶,它可催化IPP与DMAPP的相互转变。在解脂耶氏酵母中,过表达tHMG1(截短的HMG1)、IDI、ERG20和α-法尼烯合酶的基因后得到了260.0 mg/L的α-法尼烯[20]。此外,过表达HMG1和IDI的策略已被应用于提高柠檬烯、芳樟醇、法尼烯、角鲨烯、虾青素和胡萝卜素等萜类化合物,且取得良好效果[15-16,21,34,43]。
甲基赤藓糖-4-磷酸(MEP)途径是另一种合成天然萜类前体的途径,广泛存在于细菌、藻类和植物叶绿体中[44](图2)。一般认为酵母中不存在MEP途径,但近期Dissook等[45]证实解脂耶氏酵母中存在MEP途径。Yang等[46]在大肠杆菌中证实MVA途径与MEP途径存在协同作用,这可以提高两种通路的通量,其中MVA途径的通量提高了1.5倍,MEP途径的通量提高了4.8倍。辅因子需求差异可能是两种前体供应途径协同作用的原因。从葡萄糖出发,MVA途径合成1分子IPP/DMAPP会生成4分子NADPH,这些NADPH可以用于MEP途径的消耗。因此,协同优化解脂耶氏酵母MVA和MEP途径也许可以为改造解脂耶氏酵母生产萜类化合物提供崭新的思路。
1.2.2 异源前体供应途径设计
由于内源MVA途径存在酶促反应步骤多、碳原子转化率低等限制,所以有研究人员将目光转向人工设计萜类合成前体供应途径[47](图2)。Chatzivasileiou等[48]设计了一种两步法合成类异戊二烯前体的途径——异戊烯醇途径(IUP),该途径第一步将底物异戊二烯醇(isoprenol)和异戊烯醇(prenol)分别磷酸化形成异戊烯基单磷酸酯(IP)和二甲基烯丙基单磷酸酯(DMAP),IP和DMAP再次被磷酸化得到IPP和DMAPP。由于IUP途径存在反应步骤少、碳源利用率高且不与中心碳代谢竞争的优点,所以可规避内源前体供应途径的短板,从而解决萜类生物合成IPP和DMAPP供应不足的问题。之后,Luo等[36]将IUP途径引入解脂耶氏酵母后发现,与MVA途径相比,IUP途径将IPP和DMAPP产量提高了15.7倍,在解脂耶氏酵母中的番茄红素产量达4.2 g/L。

DXP—1-deoxy-D-xylulose 5-phosphate; CDP-ME—4-diphosphocytidyl-2C-methyl-D-erythritol; CDP-MEP—4-diphosphocytidyl-2C-methyl-D-erythritol-2-phosphate; MEC—2C-methyl-D-erythritol-2,4-cyclo-diphosphate; HMBPP—4-hydroxy-3-methyl-2-(E)-butenyl-4-diphosphate; IP—isopentenyl monophosphate; MG-CoA—3-methylglutaconyl-CoA; MB-CoA—3-methyl-2-butenoyl-CoA; MB—3-methyl-2-butenal
然而以石油化工来源的异戊烯醇作为反应底物不利于萜类化合物可持续生产。Clomburg等[49]受有机物逆合成概念启发,设计了以HMG-CoA为底物从头合成异戊烯醇的途径(IPA途径),并用于大肠杆菌中的柠檬烯生产。与MVA途径相比,IPA途径表现出更少的ATP需求,同时与中心代谢的直接联系赋予IPA途径适用于不同宿主的能力。
总之,在解脂耶氏酵母中引入人工设计前体供应途径,如IUP途径、IPA途径绕过内源途径限速步骤、减少还原力和ATP的消耗,可避免毒性中间产物积累,有助于提高萜类产量。
1.3 下游萜类化合物合成
不同于上游前体的供应过程,下游萜类化合物合成更复杂且与细胞生长竞争必需的底物。研究证实通过蛋白质工程和启动子工程精准调控关键酶活性和表达水平,可平衡产物生产与细胞生长[33, 50-52],如图3所示。

图3 平衡下游萜类化合物合成与细胞生长策略
利用蛋白质工程设计合理的突变体可以提高底物特异性和酶促反应速率。ERG20以IPP和DMAPP为底物顺序合成GPP和FPP(图1),但该酶促反应不积累GPP,阻碍了单萜的生物合成[53]。为了提高GPP积累能力和单萜产量,Ignea等[50]在模拟酿酒酵母ERG20蛋白模型时发现,ERG20F96W-N127W突变体在保留GPP合成能力的同时,FPP合成能力降低了约30倍,该突变体在提供菌株生长所需FPP的同时为单萜生产积累大量底物GPP;将双突变应用于解脂耶氏酵母ERG20(ERG20F88W-N119W)后,与未突变菌株相比,芳樟醇的产量提高了3.7倍[19]。进一步开发ERG20的多底物识别和顺序催化反应能力,构建的突变体ERG20F88C可以完成从GPP到FPP再到GGPP的转化,为解脂耶氏酵母二萜和四萜生产平台菌株提供了新的底物来源方式[24,54]。
用启动子工程控制基因转录水平的方法平衡萜类生产和细胞生长效果明显。FPP是角鲨烯、泛醌、麦角甾醇以及其他必需甾醇物质的前体,同时倍半萜、三萜和四萜的生物合成都需要以FPP为底物[55]。角鲨烯合酶(ERG9)负责解脂耶氏酵母中角鲨烯的生成,是与目标萜类竞争底物FPP的关键酶节点[29]。筛选弱启动子(如PBTS1)、基于麦角甾醇合成过程反馈抑制机制启动子(如PERG1和PERG11)、基于动态调控的启动子(如PALK1和PILC1)用于降低或调控ERG9的转录水平,促进FPP流向萜类化合物生产途径[35, 51-52]。Kildegaard等[33]将解脂耶氏酵母的ERG9启动子PERG9分别截短为50、100和500 bp并与反馈抑制启动子PERG1和PERG11比较后发现,截短50 bp的PERG9效果最优,使β-胡萝卜素产量提高了2.5倍。
2 细胞器工程
目前,解脂耶氏酵母的萜烯生产策略主要集中在细胞质空间中改造关键酶与代谢途径调控。但一方面萜烯的合成前体、酶、辅因子等分布在不同亚细胞区室中,不利于细胞质中合成萜烯化合物,另一方面利用不同细胞器的特性,有利于改善解脂耶氏酵母萜类化合物生产性能[56-57]。细胞器工程改造已经在酿酒酵母合成萜类化合物中取得显著效果。Liu等[58]在酿酒酵母中发现,油滴形态的过氧化物酶体可以作为二萜角鲨烯的动态储存仓库,并完整地将供应FPP的MVA途径定向在过氧化物酶体中,使角鲨烯产量达到1.3 g/L,与出发菌株相比,提高了138倍(图4),再将细胞质与过氧化物酶体进行双重调节,角鲨烯产量提高至1.7 g/L。另一项研究中,Lv等[59]将MVA途径整合至线粒体后,获得了2.5 g/L的异戊二烯(图4),这是单独细胞质途径无法比拟的。

图4 细胞器工程合成萜类化合物[58]
在解脂耶氏酵母中各细胞器区室具有不同的生理环境、生物反应过程以及酶与代谢物组成。在线粒体中,三羧酸循环(TCA)和氧化磷酸化供应辅因子和能量、过氧化物酶体β-氧化供应前体乙酰辅酶A、脂质体特殊疏水环境等都是不同细胞器区室为萜类物质生物合成提供的独特优势条件所在(图4)[60-62]。具有产油特点的解脂耶氏酵母会在胞内积累大量脂质体,由甘油三酯、甾醇酯和磷脂单分子层组成的脂质体具有高度疏水环境、利于储存极性的萜类化合物[62-63]。Barth课题组的Matthaeus等[64]通过敲除β-氧化相关基因(POX1~POX6和GUT2)使解脂耶氏酵母脂质体膨大,从而为番茄红素在胞内储存提供更多的疏水空间,在分批补料培养条件下最终得到16 mg/g的番茄红素。值得一提的是,脂质体的形成需要消耗大量碳源,因此必须平衡萜类合成与脂质体形成。虽然解脂耶氏酵母的细胞器工程改造研究仍处于起步阶段,随着对解脂耶氏酵母细胞器区室功能研究的逐渐清晰,可以对多细胞器进行协作改造,以提高萜类化合物合成效率。
细胞器工程在精细化改造解脂耶氏酵母增加萜类生产水平时具有明显优势,但在改造细胞器代谢时仍存在巨大挑战。首先,前体供应途径必须靶向适宜的细胞器,细胞器的选择依赖于目标代谢物合成路径,如利用解脂耶氏酵母的高尔基体的脂质合成能力,实现了脂肪酸乙酯和烷烃的高效合成[65]。其次,细胞器定位序列对相关酶活的负面影响值得关注。为了应对这一难题,需要对信号蛋白定位、输入以及细胞器的渗透性进行更系统的研究。近期,Dong等[66]挖掘靶向线粒体的无害定位标签(MTS),并在酿酒酵母线粒体中构建α-檀香萜合成途径,将该化合物产量提高了3.7倍。因此,需要挖掘新型蛋白定位标签扩大酵母细胞器区室化工程的工具箱。总之,细胞器工程有望成为解脂耶氏酵母合成萜类化合物甚至其他化合物的重要策略。
3 细胞水平调控
细胞整体水平的调控对于提高细胞工厂合成产物的合成效率至关重要,因此,从提高菌株萜类化合物耐受性、萜类产物外排和优化菌株发酵条件三个方面概述解脂耶氏酵母的细胞水平调控策略。
3.1 提高菌株萜类化合物耐受性
萜类化合物对微生物细胞普遍具有毒性,产品的细胞毒性是限制微生物高产萜类化合物的难题[67]。在萜类化合物中,单萜的细胞毒性最为显著,如柠檬烯会影响酵母细胞壁的生成,严重干扰细胞生长与代谢[68],所以有必要挖掘关键基因以提高解脂耶氏酵母的单萜耐受性。Li等[17]分析了在柠檬烯胁迫下的解脂耶氏酵母转录组学数据后,在82个上调表达基因中筛选出关键基因YALI0F19492g,将该基因与柠檬烯合酶基因共表达后,与出发菌株相比,柠檬烯的产量提高了8倍,而将该基因敲除后柠檬烯产量则降低1.5倍。
适应性实验室进化(ALE)和异源转运蛋白的引入对改善细胞萜类耐受性也有帮助[67]。ALE是通过将菌株暴露在环境压力下以提高其应变适应性。Niu等[69]将常压室温等离子体诱变(ARTP)后的大肠杆菌暴露在含有20 g/L蒎烯的培养基中进行多轮次ALE,最终得到可以在20 g/L蒎烯条件下正常生长的大肠杆菌;之后,在该大肠杆菌中分别过表达来自恶臭假单胞菌的MexF和Alcanivoraxborkumensis的AcrBDFa两种转运蛋白,结果发现,这两种转运蛋白增加了其对蒎烯的耐受性。由于萜烯化合物结构具有相似性,不同化合物间可能具有相同的耐受性机制,所以提高一种萜类化合物耐受性的策略也可能适用于另一种萜类化合物。所以ALE协同异源转运蛋白表达策略可能是最大限度解除萜烯对解脂耶氏酵母细胞毒性的方案之一。
3.2 萜类产物外排
耐受性研究可以提高宿主细胞对萜类化合物的耐受能力,而萜类产物外排则可有效减少有毒化合物在胞内积累并提高其产量[70]。大分子四萜类物质因不易运输至细胞外,存储于胞内脂质体中,而脂溶性的小分子萜类化合物则可以透过细胞被动扩散到胞外。根据萜类在有机相和水相的溶解系数不同,研究者开发了十二烷-水的两相萃取发酵体系用于促进解脂耶氏酵母中单萜和倍半萜跨膜外排[16, 23]。尽管两相发酵方式利于小分子萜类外排和分离纯化,但是细胞膜的低渗透性依然是萜类跨膜外排的障碍[71]。
外排泵是一种提高萜类转运的直接手段。目前在解脂耶氏酵母中尚未发现萜类转运蛋白,但Wang等[72]已实验证明,部分异源ATP依赖的转运蛋白能够将萜类转运至胞外。近期,Zhao等[28]在解脂耶氏酵母中分别引入了来自大肠杆菌的AcrB蛋白和Grosmaniaclavigera的ABC-G1蛋白,发现这两种蛋白均可以增加甜没药烯的外排水平,最终甜没药烯α、β和γ这3种同分异构体最高摇瓶产量分别达到973.1、68.2 和20.2 mg/L。
利用萜类化合物被动扩散跨膜的特性,对解脂耶氏酵母细胞膜组成进行改造是提高萜类外排水平的另一种手段。通过调控脂质代谢必需基因OLE1、PAH1和DGK1,Zhang等[31]将解脂耶氏酵母中不饱和脂肪酸含量提高了2倍,使椭球形细胞变得狭长的同时加速了三萜羽扇豆醇外排,最终有机相中羽扇豆醇产量达到381.6 mg/L,摇瓶中总产量为411.7 mg/L。该策略对其他三萜和倍半萜的外排效果也较显著,为改善解脂耶氏酵母中萜类产品的外排提供了新的思路。
3.3 发酵条件优化
代谢工程改造与发酵条件优化相结合可加速解脂耶氏酵母工业化生产萜烯的进程。解脂耶氏酵母具有广泛的碳源利用谱,能够利用葡萄糖、木糖、甘油和烷烃等多种碳源。此外,解脂耶氏酵母又是严格需氧型酵母,且对高渗透压和酸碱环境有高耐受性[12]。因此,根据解脂耶氏酵母的生理特性,来探索最佳的萜烯发酵条件。
倍半萜法尼烯在药物、化妆品、调味品和生物能源等方面具有巨大的经济价值,法尼烯发酵的最佳碳源和最适发酵工艺已经被较为广泛地研究[73]。Liu等[22]比较工程解脂耶氏酵母LSC17利用柠檬酸、果糖、甘油和葡萄糖等7种不同碳源生产β-法尼烯的能力,最后发现,以甘油为碳源时产量最高,以果糖为碳源时生物量最大,而以柠檬酸为碳源时得率最佳;进一步在5 L发酵罐中分批补料发酵后发现,以甘油为碳源的β-法尼烯产量比以葡萄糖为碳源时的高了60%。而Liu等[21]优化了解脂耶氏酵母菌株生产α-法尼烯的发酵工艺,确定了最优条件组合:30 ℃发酵、pH5.5、1.5 vvm的空气流量和500 r/min的搅拌速度,结合补料,最终α-法尼烯的产量为25.6 g/L,是已报道的解脂耶氏酵母中最高的萜类化合物产量。这些研究证实了优化解脂耶氏酵母发酵工艺的重要性。
另一方面,培养基中的碳源与氮源的含量对解脂耶氏酵母中萜类合成影响显著。培养基中碳源与氮源比例称为碳氮比(C/N),氮源含量不变时,较高的碳氮比会增强脂质或其他碳原子占比高的化合物(如,胡萝卜素、萜类化合物)生物合成过程[74-75]。Gao等[35]在限氮条件下培养解脂耶氏酵母,调控脂质的积累与β-胡萝卜素的生成,最终产量为3.7 g/L。Larroude等[34]对培养基的碳氮比和β-胡萝卜素之间的关系进行更全面研究时发现:在高碳氮比时,产物的产量最高,而在低碳氮比时,产物的得率最高,即低葡萄糖浓度下的分批补料方式利于提高解脂耶氏酵母的β-胡萝卜素产量与得率;在20 g/L酵母提取物、40 g/L蛋白胨和5 g/L葡萄糖培养基条件下,采用分批补料方式得到6.5 g/L的β-胡萝卜素,这是迄今为止工程酵母中最高的β-胡萝卜素产量。因此,探究解脂耶氏酵母最优的萜类产物发酵条件,是从细胞水平提高萜类产量促进工业应用最重要的策略之一。
4 解脂耶氏酵母生产萜烯的关键问题
解脂耶氏酵母因在乙酰辅酶A和还原力供给、底物利用和环境耐受性方面的优势,已被用于多种高价值萜类化合物的合成。但综合现有解脂耶氏酵母中萜类化合物的合成策略,我们认为充分发挥解脂耶氏酵母的特性,最大化提高萜类化合物合成效率,至少需要在功能基因组学、遗传操作工具开发和基因组尺度代谢模型(GEM)方面进行更深入研究。
目前,由于解脂耶氏酵母多数基因功能尚不明晰、基础代谢网络不明确,所以这限制了开发利用该菌的深度与进度。因此,利用功能基因组学完善解耶氏酵母的基因功能注释和代谢调控分析是必不可少的。Patterson等[76]通过Hermes DNA转座子诱变方式,将解脂耶氏酵母约22%的基因归类为必需基因,并评估了非必需基因在甘油和葡萄糖为碳源时的生长贡献。但与酿酒酵母相比,解脂耶氏酵母的功能基因组学研究还远远不够,因此进一步完善解脂耶氏酵母基因功能的注释与表征,建立类似酿酒酵母基因组数据库(SGD)的平台网站,是建立解脂耶氏酵母代谢调控网络和设计构建细胞工厂的重要基础。
高效的遗传操作工具是精细的代谢工程改造的基础。DNA水平的遗传修饰(如,基因敲除、插入和替换)的实现依赖于细胞DNA修复机制。解脂耶氏酵母倾向于利用非同源末端连接(NHEJ)而非同源重组(HR)进行DNA损伤修复,因此同源重组效率一直是对解脂耶氏酵母进行定点精准基因编辑的障碍[77]。Ku70/Ku80蛋白复合体负责DNA双链断裂时的NHEJ修复,敲除Ku70可以提高解脂耶氏酵母利用CRISPR/Cas9技术提高基因改造的效率[78-80],但Ku70基因敲除后细胞的生长变慢、抗逆性下降。而在毕赤酵母中,过表达基因Rad52并敲除MPH1,可避免NHEJ修复,同时将HR效率提高至68%~90%[81]。另一方面,利用解脂耶氏酵母的NHEJ修复能力,对甲羟戊酸途径进行染色体水平的随机整合也可以提高萜类化合物产量[21]。因此,对解脂耶氏酵母DNA修复机制进行深入研究,将有助于开发高效的遗传操作工具。
基因组尺度代谢模型(GEM)的建立对缩短设计—构建—测试—学习(DBTL)循环的时间,满足多元化菌株构建的需求有重要意义。根据基因组详细功能注释定义并将所有代谢基因的基因-酶-反应相关联,共同描述该细胞的代谢网络即GEM,代表着生物体特定的生理和遗传知识库[82]。已有研究从酿酒酵母GEM出发,基于基因组同源性建立了解脂耶氏酵母的GEM,并用于指导脂质的高效生产[83-84]。高质量和广泛适用的GEM需要将酶促反应动力学、蛋白质结构和蛋白组学等基于新的耦合算法和模拟策略整合来建立和优化解脂耶氏酵母的GEM,以指导多样化工程改造解脂耶氏酵母[85]。这将在解脂耶氏酵母的基础研究和各类化学品合成细胞工厂设计中发挥重要作用。
5 结论与展望
在“碳达峰”与“碳中和”的背景下,工业生产正趋向低碳低能耗的绿色发展。微生物合成具备反应条件温和、可循环的特点,有望成为未来合成高价值萜类化合物的重要途径。代谢工程和合成生物学的发展促进了解脂耶氏酵母细胞工厂的构建,为萜类化合物化学合成和植物组织提取提供了替代方案。不同层次改造策略的精细协作、功能基因组学研究的逐步深入、基因组编辑工具的不断完善和高质量可视化GEM的建立将加深研究人员对解脂耶氏酵母独特生理特性的认识,丰富精准高效遗传改造的手段,都可加速多样高效的萜烯生产菌株的构建与工业化应用进程。
