益母草属萜类化学成分及其药理作用研究进展
2020-06-04卜兰刘菲熊亮
卜兰 刘菲 熊亮


摘要 益母草属植物中的化合物类型多样、结构丰富,其中萜类化合物是目前发现数量最多的一类,同时具有广泛的生物活性。因此,作者对益母草属萜类化合物及其药理活性进行总结归纳,为该属萜类化合物的进一步研究提供参考。
关键词 益母草属;萜类;化学成分;药理作用;研究进展
Abstract There are various types and rich structures of the compounds in genus Herba Leonurus,among which terpenoids are the most abundant and have a wide range of biological activities.Therefore,the authors summarized the terpenoids compunds and their pharmacological activities of genus Herba Leonurus to provide a reference for the further study of the terpenoids compound.
Keywords Herba Leonurus; Terpenoids; Chemical constituents; Pharmacological effects; Research progress
益母草属植物品种繁多,资源丰富,至今世界上已发现益母草属植物23种,广泛分布于欧亚大陆温带,少数分布于美洲、非洲等地[1]。目前益母草属研究较多的主要有6种植物:益母草(L.japonicus)、细叶益母草(L.sibiricus)、欧益母草(L.cardiaca)、大花益母草(L.macranthus)、波斯益母草(L.persicus)及突厥益母草(L.turkestanicus)。其中作为“经产良药”的益母草由于量大质优在我国备受青睐,是《中华人民共和国药典》多次收载至今的品种;而细叶益母草在内蒙古、河北、山西等主要产区有少量商品;此外,原产于东欧、西亚的欧益母草在欧洲的药用历史源远流长[2]。
现代研究发现,益母草属植物中含有生物碱、萜类、苷类[3]等活性成分,其中萜类成分数量最多,类型丰富,涵盖单萜、倍半萜、二萜和三萜,且该类成分表现出较好的抗炎[4]、抗血小板聚集[5]、抑制胆碱酯酶[6]等活性。本文归纳总结了研究较多的6种益母草属植物的萜类化合物及其药理活性,以期为资源的合理分配及开发利用提供一定的基础。
1 化学成分
迄今为止,已从益母草属6种植物中分离鉴定了240个萜类化合物,其编号、名称、植物来源见表1。
1.1 单萜
益母草属植物中分离得到的单萜类成分较少,包括无环单萜及其苷和环烯醚萜及其苷。3个无环单萜化合物(1~3)均以月桂烷为基本母核,C-1、C-6位分别有双键,其中1与2十分相似,均与β-D-葡萄糖形成氧苷,不同点在于化合物1在C-3位羟基成苷,而化合物2在C-8位羟基成苷。12个环烯醚萜类化合物(4~15)均以C1-OH与糖成苷,其中C-4位甲基常被氧化为羧基如11~13;部分苷元的五元环上存在三元氧环如10、11;C-5和C-8位常被羟基或乙酰氧基取代。化合物结构见图1。
1.2 倍半萜
益母草属倍半萜类化合物根据碳环骨架可分为单环倍半萜和双环倍半萜。化合物16~26为单环倍半萜,其中16~24为紫罗兰酮的衍生物,其中24可能为紫罗兰酮类经降碳、成酯形成,25为螺环倍半萜,26为没药烷型倍半萜,且19、20、23为苷类。化合物27~32为双环倍半萜,其中27为花侧柏烷型倍半萜,28为桉叶烷型倍半萜,29、30为恰米烷型倍半萜,31为杜松烷型倍半萜,且28为苷类。化合物结构见图2。
1.3 二萜
益母草属二萜类化合物是目前分离数量最多的一类化合物,结构类型以半日花烷型为主,根据C-9位侧链环合的方式,可分为C-9侧链链状型、呋喃环型、单螺环型、双螺环型4类。
1.3.1 C-9侧链链状型半日花烷型二萜
C-9侧链链状型半日花烷型二萜存在于益母草和大花益母草中,以半日花烷型为基本母核,C-9位侧链为链状。来源于益母草的13个化合物,其中C-7位以羰基居多,少数化合物C-7与C-8之间有双键,部分化合物C-13与C-14形成不饱和反式双键,侧链末端为炔键的化合物50是特殊的15,16-降二萜结构,个别化合物如51~53侧链末端为羧基或成酯。来源于大花益母草的8个化合物42~49的B环中均有α、β不饱和酮,且侧链末端多为羟基取代如42~44、46~48,少数为乙酰氧基取代如45、49。化合物结构见图3。
1.3.2 呋喃环型半日花烷型二萜
呋喃环型半日花烷二萜存在于多种益母草属植物中,包括益母草、细叶益母草、波斯益母草和欧益母草。其中具有呋喃内酯环结构的二萜(54~69、107)均是在C-9侧链末端形成的五元内酯环,根据酯羰基所在位置不同又可进一步细分,54~60、107的酯羰基在C-15位,并且59、107在C-13位有羟基取代,而61~69的酯羰基在C-16位。除呋喃内酯环结构外,绝大部分化合物侧链末端为呋喃环(71~98、108~124),少数为四氢呋喃环(99~105)。另外从细叶益母草中分离到的107~111、119~120有C-6与C-18形成的内酯环,而112~114有特殊的C-18與C-20形成的内酯环。10个B环裂环的化合物(115~124)具有C-8与C-9断裂的特殊结构,其中121~124中C-8和C-9通过醚键相连,形成四氢呋喃环结构;另外化合物119与120是一对C-7差向异构体,但并未确定两者准确构型。化合物99~105则是侧链末端为四氢呋喃环且C-13有羟基取代。化合物结构见图4。
1.3.3 单螺环型半日花烷型二萜
目前发现的单螺环型化合物均来源于大花益母草。该类化合物的特点是C-9位为螺原子,C-15与C-16未发生环合,C-3位与侧链末端为羟基或乙酰氧基取代。结构式见图5。
1.3.4 双螺环型半日花烷型二萜
双螺环类半日花烷型是二萜化合物中数量仅次于呋喃环型的一种,广泛存在益母草、细叶益母草、欧益母草、波斯益母草中。该类化合物显著特征是C-9和C-13是2个螺原子,C-9位与C-13位环合成醚,形成五元环氧结构;并且C-15和C-16也通过氧桥相连,形成9,13;15,16-双环氧片段的双螺环结构。含氧取代基如羟基或羰基常出现在C-6、C-7位等,C-8位有α-甲基取代,C-10位有β-甲基取代。
从益母草属中分离得到11个不饱和双键的双螺环结构二萜(137~146、199),通常,C-7位被含氧取代基羟基或羰基取代。从益母草和波斯益母草中分离到10个具有内酯环结构的二萜(147~155、200),其中147~153、200在C-15处形成五元内酯羰基,而154与155则在C-16处形成羰基,C-15含有α-甲氧基取代。除此之外,还报道有双螺环片段为饱和结构的二萜(156~198、201~202),这些化合物有较多取代基且结构相似易于混淆,可通过羰基在C-6或C-7的取代位置区分。C-7位被羰基取代的双螺环二萜(156~180、201~202)与C-6位被羰基取代的双螺环二萜(181~198)在C-13位螺原子处均有R和S 2种构型,在一定程度上丰富了化合物结构的多样性。另外化合物199~202有C-6与C-18形成的五元内酯环。结构式见图6。
1.3.5 其他类型二萜
半日花烷型是二萜类化合物最常见的结构,随着研究的深入,其他结构类型的二萜逐渐从益母草中发现,包括新骨架、海里曼型和克罗烷型。化合物203具有新颖的螺缩酮结构的四环二萜骨架;海里曼型结构的化合物204与半日花结构差异在于C-10位甲基迁移至C-9位;化合物205属于克罗烷型,是半日花烷二萜1,2-甲基迁移重排而来的。结构式见图7。
1.4 三萜
存在于益母草及欧益母草中的三萜类化合物数量虽较少,但结构新颖,包括较罕见的降碳三萜化合物,按缺碳原子位置可分为24-降,27-降,28-降,30-降24,28-二降,24,30-二降6种类型[61]。此外,三萜化合物根据母核结构可分为羽扇豆烷型、螺环降三萜型及其他类型化合物。
1.4.1 羽扇豆烷型三萜
目前分离鉴定的9个该类化合物均来源于益母草,包含降碳羽扇豆烷型三萜,如化合物206~209为28-降类型,而化合物211则为1-降类型。另外C-17位易被羟基、羧基、酯基等含氧基团取代,化合物210有特殊的氧桥。结构式见图8。
1.4.2 螺环降三萜型三萜
益母草中分离得到11个新颖的28-降类型螺环三萜,该类结构C-17为螺原子。另外,C-3位、C-23位多被羟基取代且与苯丙酸类化合物成酯;C-12位与C-13位常为双键。结构式见图9。
1.4.3 其他类型三萜
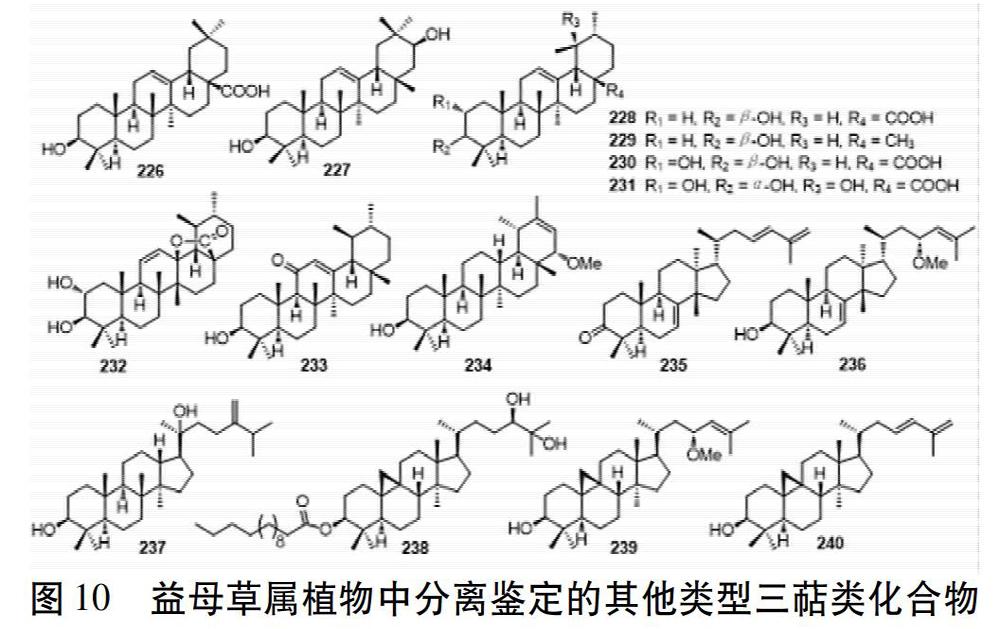
除羽扇豆烷型与螺环降三萜型三萜,还从益母草与欧益母草中发现少量齐墩果烷型、乌苏烷型、蒲公英烷型、羊毛脂甾烷型、达玛烷型、环菠萝蜜烷型三萜。齐墩果烷型如化合物226与227;乌苏烷型如化合物228~233,C-19为β-甲基,C-20为α-甲基;蒲公英烷型如化合物234,是乌苏烷型化合物的异构体,C-19位与C-20位上的甲基构型与乌苏烷型正好相反;羊毛脂甾烷型如化合物235~236,侧链常有不饱和双键;达玛烷型如化合物237,有31个碳;环菠萝蜜烷型如化合物238~240,C-9位与C-10位脱氢形成三元环。结构式见图10。
2 药理作用
益母草属萜类化合物具有广泛的生物活性,据报道,益母草属中二萜类成分有较好的抗血小板聚集[5]、舒张血管[55]、抑制胆碱酯酶[6]等生物活性。而三萜類化合物具有良好的抗炎[60]、神经保护[58]、保肝[62]等活性,所以受到了研究人员的广泛关注。根据目前的研究报道,主要从抗凝血、神经保护、抗炎、肝细胞保护、激素调节、细胞毒活性及其他活性进行阐述。
2.1 抗凝血活性
研究表明,益母草属中倍半萜类成分[14]和二萜类成分[19]具有明显抗凝血作用,且在凝血四项指标中以抗血小板聚集的报道最为常见。螺环倍半萜化合物25在体外可以抑制血小板聚集,且对凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)和凝血酶时间(TT)有延长趋势,具有一定的抗凝血活性[19,63]。此外,二萜类化合物前益母草素也具有显著的抗凝血活性,Lee等[64]使用体外放射配体结合法检测血小板活化因子(PAF)受体,证实前益母草素是一种新型的特定的PAF拮抗剂,能竞争性抑制血小板上的PAF受体,从而达到抗凝血目的,其IC50=4 μmol/L。Zizyberenalic acid(211)和羽扇豆醇(Lupeol,212)具有抗ADP诱导的体外血小板聚集活性,在浓度为1×10-4M时,抑制率分别为16.06%和15.19%[19]。另外,研究者发现C-13位具有R构型的化合物(185,186)也表现出显著的抗血小板聚集活性[5]。
2.2 神经保护活性
Moon[30]报道益母草的甲醇提取物具有抑制谷氨酸诱导大鼠原代培养皮层细胞的毒性,并进一步发现化合物Leojaponin(71)在0.1~10 μmol/L浓度范围内可显著抑制谷氨酸诱导的神经毒性;而Rauwald[13]等在大鼠模型中发现益母草碱可通过与GABAA受体结合发挥显著的神经保护作用。从益母草中分离得到的齐墩果烷型螺环降三萜具有多种活性,Phlomistetraol B(215)在1 μmol/L和10 μmol/L的浓度下可促进神经生长因子(NGF)处理过的PC12神经细胞轴突生长,但是当浓度高于30 μmol/L时,则表现出一定的细胞毒性。Leonurusoleanolide A(216)和Leonurusoleanolide B(217)的混合物以及Leonurusoleanolide C(218)和Leonurusoleanolide D(219)的混合物在1~30 μmol/L的浓度范围内也可促进NGF处理过的PC12神经细胞轴突生长[58]。除此之外,通过抑制胆碱酯酶活性,也可发挥神经保护作用。Hung TM等[6]报道益母草70%的乙醇提取液具有显著抑制乙酰胆碱酯酶活性的作用,并进一步从中分离得到Leoheteronin D(36)和Leoheteronin F(37)具有较强的活性,采用Ellman法对其进行乙酰胆碱酯酶活性测定,显示中度酶抑制活性,IC50值分别为18.4 μmol/L和16.1 μmol/L;分离得到的Leopersin G(54)和Leoheteronin A(55),在乙酰胆碱酯酶的抑制活性测定中,IC50值分别为1.29×10-5mol/L和1.16×10-5mol/L。
2.3 抗炎活性
研究者对大花益母草中分离的多数化合物进行了抗炎活性研究,发现其能够减少脂多糖(LPS)诱导的BV-2小胶质细胞一氧化氮(NO)的释放。15,16-Epoxy-3α-hydroxylabda-8,13(16),14-trien-7-one(78)[36]具有一定的抗炎作用,可通过抑制核转录因子-κB(NF-κB)信号通路,下调一氧化氮合酶(iNOS)和环氧化酶(COX-2)蛋白质表达,从而降低NO和PGE2的释放,其抑制NO释放的IC50为2.70×10-5M。另外,3,6,15-Triacetylmacranthin F(45)和Macranthin F(47)具有抗炎活性,均能够减少脂多糖(LPS)诱导的BV-2小胶质细胞一氧化氮(NO)的释放,IC50值分别为12.7 μmol/L和53.6 μmol/L[4]。另有研究报道,熊果酸有显著的抗炎活性,而Corosolic acid(230)、Euscaphic acid(231)、Ilelatifol D(232)也有一定的抗炎活性,但与熊果酸相比相对较弱[60]。
2.4 肝细胞保护作用
目前,对齐墩果酸保肝活性的研究比较深入,张明发等人[62]对此进行了系统的综述,齐墩果酸不仅可以抗CCl4、对乙酰氨基酚、镉(Cd)、D-氨基半乳糖等引起的急性肝损伤,对急性免疫性肝损伤和缺血再灌注性肝损伤以及肝纤维化和肝炎都有一定的治疗作用。另外,也有学者报道化合物19对D-GalN引起的肝细胞损伤有保护作用[15]。
2.5 激素调节活性
雌激素作为一种女性激素,对于维持内环境平衡及疾病预防方面发挥重要作用,过高的雌激素水平可能导致乳腺癌等疾病。研究发现,益母草属部分化合物具有抑制雌激素磺基转移酶的活性,从而使雌激素水平相对平衡。化合物76和77具有一定的抑制雌激素磺基转移酶的活性,IC50分别为31.3和19.8 μmol/L[26]。另有研究报道,在抑制雌激素磺基转移酶活性实验中,分离得到的Leosibiric acid A(115)活性最为显著,IC50=7.9 μmol/L;Leosibiric acid B(121)活性稍弱,IC50=23.2 μmol/L,此外,化合物123也具有一定的抑制雌激素磺基转移酶活性,IC50=40.5 μmol/L[26]。
2.6 细胞毒活性
有文献报道化合物108~110、112~114这6个化合物对白血病细胞株L 1210均有较强的细胞毒作用,IC50值为50~60 μg/mL[45]。此外,文献[58]还报道,Leonurusoleanolide I(224)和Leonurusoleanolide J(225)对人胃癌细胞BGC-823、KE-97,人肝癌细胞Huh-7,Jurkat T淋巴母细胞,人乳腺癌细胞MCF-7都具有显著的细胞毒作用。其中224对BGC-823、KE-97的IC50值大于10 μmol/L,对Huh-7、Jurkat、MCF-7的IC50值分别为(9.7±0.7),(9.7±5.7),(4.3±0.1)μmol/L,而225对BGC-823、KE-97、Huh-7、Jurkat、MCF-7的IC50值分别为(7.5±1.3),(3.0±0.3),(1.9±0.5),(3.9±0.9),(4.6±0.08)μmol/L。
2.7 其他活性
除了上述的主要活性外,从益母草属中分离的化合物还有促进凝血、镇痛、心脏保护、抗菌等活性。Zhong WM等[21]采用佛波醇酯(PMA)诱导的T细胞为模型,发现化合物92具有抑制IL-2分泌的作用。另外,化合物78还具有抑制肿瘤坏死因子-α(TNF-α)产生的作用[36]。在凝血四项测定中,化合物50表现出一定的促进凝血活性[22]。此外,研究发现化合物203具有明显的抑制KCl致离体大鼠主动脉环收缩的作用,EC50值为2.32 μmol/L[55]。此外,230~232 3种化合物有超氧化物清除活性,IC50值分别为(549.26±18.94),(787.32±12.03),(776.25±12.53)μmol/L[60]。Fierascu等人[10]证明了熊果酸的心脏保护作用,他們的研究显示,熊果酸诱导心脏线粒体中的氧化磷酸化解偶联,而不会影响呼吸速率,同时以剂量依赖性方式抑制了分离的线粒体中的过氧化氢产生。有研究报道[19]Chamigrenal(29)和Arteannuin B(31)表现出弱的抗菌活性;前者抑制了三株革兰氏阳性菌株的增殖,这些菌株含有干酪球菌,金黄色葡萄球菌和金黄色葡萄球菌,而后者则对大肠杆菌和产气肠杆菌起作用。
3 小结
通过查阅国内外文献,总结归纳了益母草属萜类化合物的化学成分及其药理作用。化合物共计240个,根据异戊二烯单元数目按照单萜、倍半萜、二萜、三萜进行分类。其中单萜类15个;倍半萜类17个;二萜类173个,数量最多的化合物类型是呋喃环型有71个,占比41%,双螺环型次之有66个,支链链状型与单螺环型较少分别为21个和12个,其他类型3个;三萜类35个,以螺环降三萜型为主有11个,占比31%,羽扇豆烷型次之有9个,其他类型有15个。同时对化合物的药理活性进行总结,主要集中在抗凝血、神经保护、抗炎、肝细胞保护、激素调节、细胞毒活性等方面。
4 讨论
益母草属植物资源丰富,种类繁多,其中以益母草研究最为深入,细叶益母草、欧益母草、大花益母草、波斯益母草及突厥益母草的研究次之。在充分利用益母草的同时,也不懈追求上述益母草的新颖化合物及显著的药理活性,这既在一定程度上丰富了对益母草属植物的认识,也可作为益母草的补充及有力的后备资源,使具有显著活性的化合物得到进一步的开发利用。
随着益母草属化学成分研究的不断深入,药理作用的研究也逐渐从总提取物转向活性部位,再以藥理活性为导向从活性部位中定位到单体化合物。但是相对而言,化合物的活性报道数量与化合物数量相比依然有欠缺,同时活性显著的化合物并未做进一步的系统的机制探索,稍显遗憾,这可能与天然产物研究中化合物获得量较少有关。因此,未来可将获取的化合物尽可能多的筛选药理活性,从而寻找更多显著活性成分,而对于活性显著但是量少的化合物可采取生物合成或化学合成等方法获得并做进一步的机制靶点研究,充分挖掘其机制内涵,以期为临床药物研究与开发提供一定基础。
《中华人民共和国药典》2015年版记载活血化瘀药益母草归肝、心包经,具有活血调经、利尿消肿、清热解毒的功效。而现代药理学显示益母草具有显著的抗凝血、抗炎、细胞毒活性、肝保护活性,这与传统认识中的活血、清热解毒、归肝经有着千丝万缕的联系,同时现代药理学对传统功效做了详细补充如神经保护活性。中药化学、中药药理学、中药药代动力学等现代科学技术的应用让中药的传统功效有了现代的诠释与补充,传统中医药的精华传承与现代科学技术融合创新必将推进中医药事业高质量发展,不断提升中医药现代化、国际化水平。
参考文献
[1]厚毅清,王乃亮,欧巧琴,等.益母草属植物种子发芽、细胞培养及其化学成分研究进展[J].中国农学通报,2010,26(18):75-78.
[2]晁志,周秀佳.益母草类中药的研究概况和进展[J].中草药,1998,29(6):414-417.
[3]张娴,彭国平.益母草属化学成分研究进展[J].天然产物研究与开发,2003,15(2):162-166.
[4]Huang Z,Zhu ZX,Li YT,et al.Anti-inflammatory labdane diterpenoids from Leonurus macranthus[J].J Nat Prod,2015,78(9):2276-2285.
[5]Xiong L,Zhou QM,Peng C,et al.Bis-spirolabdane diterpenoids from Leonurus japonicus and their anti-platelet aggregative activity[J].Fitoterapia,2015,100:1-6.
[6]Hung TM,Luan TC,Vinh BT,et al.Labdane-type diterpenoids from Leonurus heterophyllus and their cholinesterase inhibitory activity[J].Phytotherapy Research,2011,25(4):611-614.
[7]Horstmann U,Pachaly P,Sin KS.Leonurenosid I and II,two new glycosides from Leonurus japonicus Houtt[J].Eur J Pharm Sci(Posters),1994,2(1-2):120.
[8]Hu YM,Wen J,Li MX,et al.Two new labdane diterpenoids from aerial parts of Leonurus japonicus and their anti-inflammatory activity[J].Nat Prod Res,2019,33(17):2490-2497.
[9]Tasdemir D,Scapozza L,Zerbe O,et al.Iridoid glycosides of Leonurus persicus[J].J Nat Prod,1999,62(6):811-816.
[10]Fierascu RC,Fierascu I,Ortan A,et al.Leonurus cardiaca L.as a source of bioactive compounds:An update of the European Medicines Agency Assessment Report(2010)[J].Biomed Res Int,2019,2019:4303215.
[11]王金辉,丛悦,李铣,等.益母草化学成分的分离与鉴定[J].中国药物化学杂志,2002,12(3):146-148.
[12]Isaev IM,Agzmova MA,Isaev MI.Genkwanin and iridoid glycosides from Leonurus turkestanicus[J].Chem Nat Compd,2011,47(1):132-134.
[13]Rauwald HW,Savtschenko A,Merten A,et al.GABAA receptor binding assays of standardized Leonurus cardiaca and Leonurus japonicus extracts as well as their isolated constituents[J].Planta Med,2015,81(12-13):1103-1110.
[14]Xiong L,Zhou QM,Peng C,et al.Sesquiterpenoids from the herb of Leonurus japonicus[J].Molecules,2013,18(5):5051-5058.
[15]Li YX,Chen Z,Feng ZM,et al.Hepatoprotective glycosides from Leonurus japonicus Houtt[J].Carbohydrate Research,2012,348:42-46.
[16]Lai KY,Hu HC,Chiang HM,et al.New diterpenes leojaponins G-L from Leonurus japonicus[J].Fitoterapia,2018,130:125-133.
[17]叢悦,王金辉,郭洪仁,等.益母草化学成分的分离与鉴定Ⅱ[J].中国药物化学杂志,2003,13(6):349-352.
[18]Wu HK,Mao YJ,Sun SS,et al.Leojaponic acids A and B,two new homologous terpenoids,isolated from Leonurus japonicus[J].Chin J Nat Med,2016,14(4):303-307.
[19]周勤梅.益母草的化学成分研究[D].成都:成都中医药大学,2014.
[20]Peng Y,Zheng C,Wang YN,et al.Novel labdane diterpenoids from the aerial parts of Leonurus japonicus[J].Phytochem Lett,2017,20:45-48.
[21]Zhong WM,Cui ZM,Liu ZK,et al.Three minor new compounds from the aerial parts of Leonurus japonicus[J].Chinese Chem Lett,2015,26(8):1000-1003.
[22]Peng F,Xiong L,Zhao XM.A bicyclic diterpenoid with a new 15,16-dinorlabdane carbon skeleton from Leonurus japonicus and its coagulant bioactivity[J].Molecules,2013,18(11):13904-13909.
[23]Nguyen LTT,Vo HKT,Dang SV,et al.Labdane and norlabdane diterpenoids from the aerial parts of Leonurus japonicus[J].Phytochem Lett,2017,22:174-178.
[24]Tasdemir D,Sticher O.Further labdane diterpenoids isolated from Leonurus persicus[J].J Nat Prod,1997,60(9):874-879.
[25]Boalino DM,McLean S,Reynolds WF,et al.Labdane diterpenes of Leonurus sibiricus[J].J Nat Prod,2004,67(4):714-717.
[26]Narukawa Y,Niimura A,Noguchi H,et al.New diterpenoids with estrogen sulfotransferase inhibitory activity from Leonurus sibiricus L[J].J Nat Med,2014,68(1):125-131.
[27]Wu HK,Sun T,Zhao F,et al.New diterpenoids isolated from Leonurus japonicus and their acetylcholinesterase inhibitory activity[J].Chin J Nat Med,2017,15(11):860-864.
[28]Qin J,Li HM,Gao LH,et al.New labdane diterpenoids from Leonurus japonicus and their anti-inflammatory activity[J].Phytochem Lett,2014,10:313-317.
[29]Li HY,Peng X,Jin X,et al.Labdane-Type Diterpenoids from Leonurus japonicus and their plant-growth regulatory activity[J].J Nat Prod,2019,82(9):2568-2579.
[30]Moon HI.Three diterpenes from Leonurus japonicus Houtt protect primary cultured rat cortical cells from glutamate-induced toxicity[J].Phytotherapy Research,2010,24(8):1256-1259.
[31]Romero-González RR,ávila-Núez JL,Aubert L,et al.Labdane diterpenes from Leonurus japonicus leaves[J].Phytochemistry,2006,67(10):965-970.
[32]Wu HK,Wang SS,Xu ZY,et al.Isoleojaponin,a new halimane diterpene isolated from Leonurus japonicus[J].Molecules,2015,20(1):839-845.
[33]Tasdemir D,alis I,Sticher O.Labdane diterpenes from Leonurus persicus[J].Phytochemistry,1998,49(1):137-143.
[34]Papanov G,Malakov P,Tomova K.19-Hydroxygaleopsin,a labdane diterpenoid from Leonurus cardiac[J].Phytochemistry,1998,47(1):139-141.
[35]Wu HK,Wang SS,Liu HJ,et al.Diterpenoids from Leonurus japonicus[J].J Korean Chem Soc,2015,59(2):179-182.
[36]Khan S,Shehzad O,Jin HG,et al.Anti-inflammatory mechanism of 15,16-epoxy-3α-hydroxylabda-8,13(16),14-trien-7-one via inhibition of LPS-induced multicellular signaling pathways[J].J Nat Prod,2012,75(1):67-71.
[37]Savona G,Piozzi F,Bruno M,et al.Diterpenoids from Leonurus sibiricus[J].Phytochemistry,1982,21(11):2699-2701.
[38]Wu H,Fronczek FR,Ferreira D,et al.Labdane diterpenoids from Leonurus sibiricus[J].J Nat Prod,2011,74(4):831-836.
[39]Fuchino H,Daikonya A,Kumagai T,et al.Two new labdane diterpenes from fresh leaves of Leonurus japonicus and their degradation during drying[J].Chem Pharm Bull,2013,61(5):497-503.
[40]Cai XH,Che CT,Lam CK,et al.A new labdane diterpene from Leonurus heterophyllus[J].J Asian Nat Prod Res,2006,8(7):599-603.
[41]Zhang L,Cai XH,Gao HY,et al.Full assignments of a labdane diterpene,Heteronone B[J].Asian J Trad Med,2008,3(3):121-124.
[42]Baudry NN,Gill E,Alvaro V.“Wild cannabis”:A review of the traditional use and phytochemistry of Leonotis leonurus[J].J Ethnopharmacol,2015,174:520-539.
[43]Liu ZK,Wu DR,Shi YM,et al.Three new diterpenoids from Leonurus japonicus[J].Chinese Chem Lett,2014,25(5):677-679.
[44]Jiang MH,Hu Y,Jiao L,et al.A new labdane-type diterpenoid from Leonurus japonicus[J].J Asian Nat Prod Res,2018,21(7):1-6.
[45]Satoh M,Satoh Y,Isobe K,et al.Studies on the constituents of Leonurus sibiricus[J].Chem Pharm Bull,2003,51(3):341-342.
[46]Tasdemir D,Wright AD,Sticher O,et al.New furanoid and seco-labdanoid diterpenes from Leonurus persicus[J].J Nat Prod,1996,59(2):131-134.
[47]Hon PM,Wang ES,Lam SKM,et al.Preleoheterin and leoheterin,two labdane diterpenes from Leonurus heterophyllus[J].Phytochemistry,1993,33(3):639-641.
[48]Hon PM,Lee CM,Shang HS,et al.Prehispanolone,a labdane diterpene from Leonurus heterophyllus[J].Phytochemistry,1991,30(1):354-356.
[49]Papanov GY,Malakov PY,Rodriguez B,et al.A prefuranic labdane diterpene from Leonurus cardiac[J].Phytochemistry,1998,47(6):1149-1151.
[50]Tasdemir D,Wright AD,Sticher O.Detailed 1H-and 13C-NMR investigations of some diterpenes isolated from Leonurus persicus[J].J Nat Prod,1995,58(10):1543-1554.
[51]Giang PM,Son PT,Matsunami K,et al.New bis-spirolabdane-type diterpenoids from Leonurus heterophyllus Sw[J].Chem Pharm Bull,2005,53(11):1475-1479.
[52]Moon HT,Jin Q,Shin JE,et al.Bis-spirolabdane-type diterpenoids from Leonurus sibiricus[J].J Nat Prod,2010,73(2):123-126.
[53]Seo HK,Kim JS,Kang SS.Labdane diterpenes and flavonoids from Leonurus japonicus[J].Helv Chim Acta,2010,93(10):2045-2051.
[54]Knss W,Zapp J.Accumulation of furanic labdane diterpenes in Marrubium vulgare and Leonurus cardiac[J].Planta Med,1998,64(4):357-361.
[55]Xiong L,Zhou QM,Zou Y,et al.Leonuketal,a spiroketal diterpenoid from Leonurus japonicus[J].Org Lett,2015,17(24):6238-6241.
[56]Zhou QM,Zhu H,Feng R,et al.New triterpenoids from Leonurus japonicus(Lamiaceae)[J].Biochem Syst Ecol,2019,82:27-30.
[57]Ye M,Xiong J,Zhu JJ,et al.Leonurusoleanolides E-J,minor spirocyclic triterpenoids from Leonurus japonicus fruits[J].J Nat Prod,2014,77(1):178-182.
[58]Liu Y,Kubo M,Fukuyama Y.Spirocyclic nortriterpenoids with NGF-potentiating activity from the fruits of Leonurus heterophyllus[J].J Nat Prod,2012,75(7):1353-1358.
[59]Miao LL,Zhou QM,Peng C,et al.Leonurus japonicus(Chinese motherwort),an excellent traditional medicine for obstetrical and gynecological diseases:A comprehensive overview[J].Biomed Pharmacother,2019,117:109060.
[60]Ali MS,Ibrahim SA,Jalil S,et al.Ursolic acid:apotent inhibitor of superoxides produced in the cellular system[J].Phytotherapy Research,2007,21(6):558-561.
[61]曲影,梁敬钰,冯煦.齐墩果烷型降三萜化学成分研究进展[J].天然产物研究与开发,2011,23(3):577-581.
[62]张明发,沈雅琴.齐墩果酸和熊果酸保肝药理作用的研究进展[J].抗感染药学,2012,9(1):13-19.
[63]彭成,熊亮,谢晓芳,等.一种萜类化合物的用途[P].中国:CN 103211809 A.2013-07-24.
[64]Lee CM,Jiang LM,Shang HS,et al.Prehispanolone,a novel platelet activating factor receptor antagonist from Leonurus heterophyllus[J].Brit J Pharmacol,1991,103(3):1719-1724.
(2020-04-05收稿 責任编辑:徐颖)
