SRSF1通过调控VEGFA mRNA可变剪接促进食管鳞状细胞癌Eca9706细胞增殖、侵袭和迁移
2022-04-15段玉青贾云泷郑文雅刘丽华
段玉青,夏 宁,贾云泷,郑文雅,刘丽华
河北医科大学第四医院肿瘤免疫科,河北 石家庄 050035
食管癌是常见的消化系统恶性肿瘤,也是导致肿瘤相关死亡的主要原因[1]。食管癌的病理学类型主要分为食管腺癌(esophageal adenocarcinoma,EAC)和食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[2]。中国是食管癌高发地区,主要病理学类型为ESCC,占所有食管癌类型的90%[3]。ESCC具有高度侵袭性等恶性临床特征,易出现肿瘤局部复发及远处转移[4],其5年生存率为25%~30%[5]。因此,研究ESCC的恶性生物学行为及其机制,对探索ESCC的新诊断方法和治疗靶点具有重要意义。
可变剪接是前体mRNA通过选择不同的剪接位点进行剪接调控,从而产生不同mRNA剪接异构体的过程,是调节基因和蛋白表达的重要机制[6]。基因剪接调控的紊乱与恶性肿瘤的发生、发展密切相关[7-8]。丝氨酸/精氨酸富集剪接因子1(serine/arginine-rich splicing factor 1,SRSF1)属于可变剪接因子家族成员,可通过调控肿瘤相关基因可变剪接影响肿瘤细胞增殖、侵袭和迁移等恶性生物学行为,从而参与肿瘤的发生、发展过程[9-10]。但SRSF1在食管癌中的作用及其分子机制罕见报道。因此,本研究检测SRSF1在ESCC组织和细胞系中的表达,并通过小干扰RNA(small interfering RNA,siRNA)技术降低SRSF1表达水平,进一步研究其对ESCC细胞增殖、侵袭和迁移的影响,并初步探讨SRSF1在ESCC中的作用机制,旨在为ESCC的诊断和治疗提供新的信息。
1 材料和方法
1.1 临床资料
随机选取2020年1月—2021年12月在河北医科大学第四医院行根治性切除术的40例ESCC患者的癌及癌旁组织(取自距离癌灶边缘5 cm以外)标本。纳入标准:患者术前未行任何抗肿瘤治疗,并于术后经病理学检查确诊为ESCC。本研究患者均签署知情同意书,研究方案经河北医科大学第四医院伦理委员会批准。
1.2 实验材料、试剂
人ESCC细胞系Eca9706、Kyse170、TE1、Yes-2和Kyse150来自河北医科大学第四医院东院科研中心。胎牛血清(fetal bovine serum,FBS)、DMEM培养基购自美国Invitrogen公司。TRIzol试剂购自北京索莱宝科技有限公司。反转录试剂购自美国Thermo Fisher Scientific公司。实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQPCR)Mix购自武汉爱博泰克生物科技有限公司。SRSF1、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、VEGFA Iso8a、VEGFA Iso8b、GADPH引物均由生工生物工程(上海)股份有限公司合成。siRNA购自上海吉玛制药技术有限公司。LipofectamineTM2000购自美国Invitrogen公司。细胞计数试剂盒-8(cell counting kit-8,CCK-8)试剂购自大连美仑生物技术有限公司。Transwell小室购自美国Corning公司。Matrigel基质胶购自美国BD公司。SRSF1和β-actin抗体购自英国Abcam公司。辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔免疫球蛋白G(immunoglobulin G,IgG)二抗购自北京西美杰科技有限公司。
1.3 实验方法
1.3.1 免疫组织化学染色
用4%多聚甲醛溶液固定标本,石蜡包埋,切片,脱蜡,水化,磷酸缓冲盐溶液(phosphate-buffered saline,PBS)清洗。抗原修复后采用山羊血清封闭液室温封闭20 min,直接加入SRSF1特异性抗体(1∶100),4 ℃冰箱过夜。第2天,室温下放置30 min,滴加山羊抗兔IgG二抗,37 ℃温育60 min,PBS清洗3次,DAB显色,苏木精复染及脱水,中性树胶封片。采用两级评分法进行判定。根据染色细胞计数百分比 <1%、1%~10%、10%~50%、50%~80%、>80%分别判定为0、1、2、3、4分;根据染色强度按无着色、淡黄色、棕黄色、褐棕色分别判定为0、1、2、3分。根据两项积分之和判定结果,0~3分为阴性,4~7分为阳性。
1.3.2 细胞培养
在含10% FBS的DMEM培养基中培养ESCC细胞,在37 ℃、CO2体积分数为5%的条件下培养细胞,视细胞生长情况换液,待细胞生长至80%融合时,加入0.25%胰蛋白酶消化传代,取对数生长期细胞进行实验研究。
1.3.3 RTFQ-PCR检测ESCC细胞中SRSF1、VEGFA Iso8a和Iso8b的表达水平
TRIzol试剂提取ESCC细胞系Eca9706、Kyse170、TE1、Yes-2及Kyse150细胞的总RNA,以1 μg总RNA为模板,反转录为cDNA,反应条件为:40 ℃ 60 min,25 ℃ 5 min,75 ℃5 min。后以1 μL cDNA配置RTFQ-PCR体系,GAPDH作为内参,SRSF1上游引物序列为5′-AGGAGGATTGAGGAGGATCAG-3′,下游引物序列为5′-CGCTCCATGAATCCTGGTAA-3′。VEGFA Iso8a上游引物序列为5′-TTCCTGC AAAAACACAGACTCGC-3′,下游引物序列为5′-TCACCGCCTCGGCTTGTCACAT-3′。VEGFA Iso8b上游引物序列为5′-TTCCTGCAAAAAC ACAGACTCGC-3′,下游引物序列为5′-TC AGTCTTTCCTGGTGAGAGATCTGCA-3′。GAPDH上游引物序列为5′-GGACCTGACCTG CCGTCTAG-3′,下游引物序列为5′-GTAGCCC AGGATGCCCTTGA-3′。RTFQ-PCR扩增条件设定为:95 ℃ 3 min;95 ℃ 5 s、60 ℃ 32 s,共40个循环。扩增结束后,相对表达量用2-ΔΔCt法计算。
1.3.4 细胞转染
筛选ESCC细胞系中SRSF1高表达的ESCC细胞株进行后续研究。取对数生长期的Eca9706细胞接种于6孔板中,1×105个/孔,培养24 h后分为转染组(siRNA-SRSF1组)及空白对照组(siRNA-NC组)。SRSF1干扰片段分别命名为实验组siRNA-SRSF1(5′-GCUAUGAUUACGAUGGGUATT-3′)和对照组siRNA-NC(5′-UUCUCCGAACGUGUCACGU TT-3′)。将LipofectamineTM2000及siRNA-SRSF1以5 μL∶5 μL的比例形成转染试剂混合物,转染至Eca9706细胞中,并分别转染LipofectamineTM2000和siRNA-NC形成转染复合物作为对照组。
1.3.5 RTFQ-PCR和蛋白质印迹法(Western blot)实验检测SRSF1转染效率
上述1.3.4转染的Eca9706细胞置于培养箱中5 h,弃去含转染复合物的无血清培养基,加入含血清新鲜培养基继续培养。24 h后提取各组细胞内的总RNA,采用RTFQ-PCR检测各组细胞中的SRSF1 mRNA表达,48 h后提取各组细胞内的总蛋白,采用Western blot检测各组细胞中的SRSF1蛋白水平。
1.3.6 CCK-8法检测细胞增殖能力
制备转染后24 h各组Eca9706细胞悬液,分为对照组和实验组,以1×103个/孔接种于96孔板中,每组设4个平行复孔,在37 ℃、CO2体积分数为5%的条件下连续培养0、24、48、72及96 h。每个检测时间点加入10 μL/孔的CCK-8试剂,培养1 h后用酶标仪检测450 nm波长处的吸光度(D)值。
1.3.7 Transwell实验检测细胞迁移能力
Transwell小室模型置于24孔板中,将转染细胞悬浮于无血清的细胞培养液中,于小室的上层加入4×104个细胞/200 μL,下室加入600 μL含10%FBS的DMEM培养液,每组细胞重复2个小室。在37 ℃温箱中培养24 h后,用棉签擦净上室细胞,PBS清洗后,用4%多聚甲醛溶固定30 min,用0.1%结晶紫染色30 min,冲洗后晾干,在显微镜下观察并拍照,比较实验组和对照组细胞迁移数量。
1.3.8 Matrigel基质胶实验检测细胞侵袭能力
以不含血清的DMEM培养基1 ∶7 稀 释Matrigel基质胶后,加入20 μL到预冷的Transwell上室,于37 ℃培养箱中放置约2 h使Matrigel基质胶凝固。后续实验操作步骤与1.3.7相同。
1.3.9 Western blot检测转染前后Eca9706细胞中SRSF1的蛋白水平
转染步骤同1.3.4,48 h后收取实验组和对照组的细胞悬液,加入细胞裂解液,冰上裂解30 min,12 000×g离心30 min,取上清液,采用二辛可宁酸(bicinchoninic acid,BCA)法测定蛋白浓度,后将样品进行12%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)并转移至PVDF膜上。用5%脱脂奶粉于37 ℃封闭1 h,加入一抗SRSF1/β-actin(1∶1 000),在4 ℃环境下温育过夜,含有吐温-20三乙醇胺缓冲盐溶液(Tris-buffered saline Tween,TBST)洗膜3次,加入二抗(1∶10 000),37 ℃温育1 h,采用电化学发光(electrochemical luminescence,ECL)进行放射显影。β-actin作为内参蛋白,与各个检测蛋白条带的灰度值之比表示蛋白的相对表达量。
1.4 统计学处理
采用SPSS 20.0软件对数据进行分析,计量资料以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析。采用GraphPad Prism 8对实验数据进行相关图片的绘制。P<0.05为差异有统计学意义。
2 结果
2.1 SRSF1在ESCC组织和细胞系中的表达水平
免疫组织化学染色结果显示,ESCC组织中SRSF1表达水平明显高于癌旁组织(P=0.013 6),提示SRSF1在ESCC中可能发挥致癌作用(图1A和表1)。进一步采用RTFQ-PCR(图1B)和Western blot(图1C)检测,结果显示,SRSF1 mRNA表达和蛋白水平在ESCC Eca9706细胞系中最高,其次分别为Kyse170、TE1、Yes-2、Kyse150(F=593.2,P<0.01vsF=4.944,P=0.0185)。鉴于Eca9706细胞的表达水平最高,遂选用Eca9706细胞系进行后续实 验。
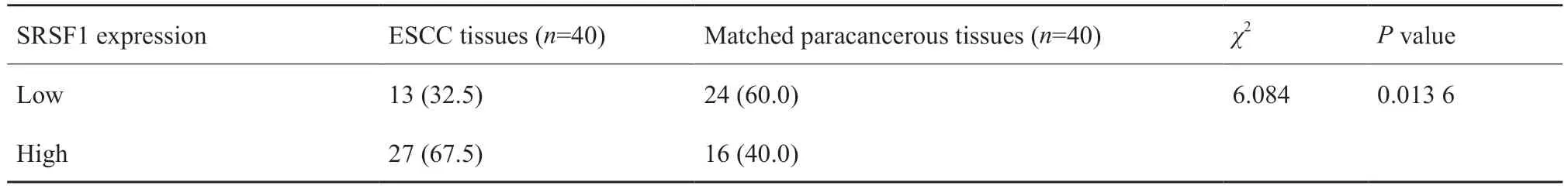
表1 ESCC组织和癌旁组织中SRSF1染色水平Tab.1 Expression of SRSF1 staining between ESCC tissues and matched paracancerous tissues [n(%)]
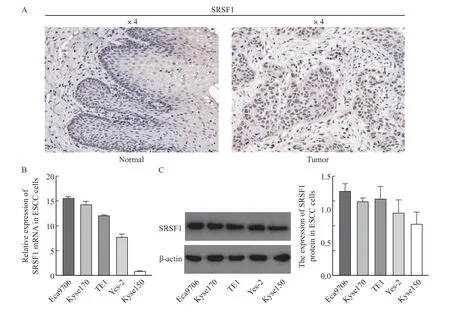
图1 SRSF1在ESCC组织和细胞中表达水平Fig.1 Expression level of SRSF1 in ESCC tissues and cells
2.2 成功构建SRSF1低表达的ESCC Eca9706细胞系
siRNA沉默ESCC Eca9706细胞中的SRSF1基因表达,RTFQ-PCR(图2A)和Western blot(图2B)检测结果显示,与siRNA-NC组比较,siRNA-SRSF1组Eca9706细胞中的SRSF1 mRNA表达和蛋白水平均显著降低(t=36.91,P=0.000 7vst=5.031,P=0.007 3),提示本研究成功构建了SRSF1低表达的ESCC Eca9706细胞系。
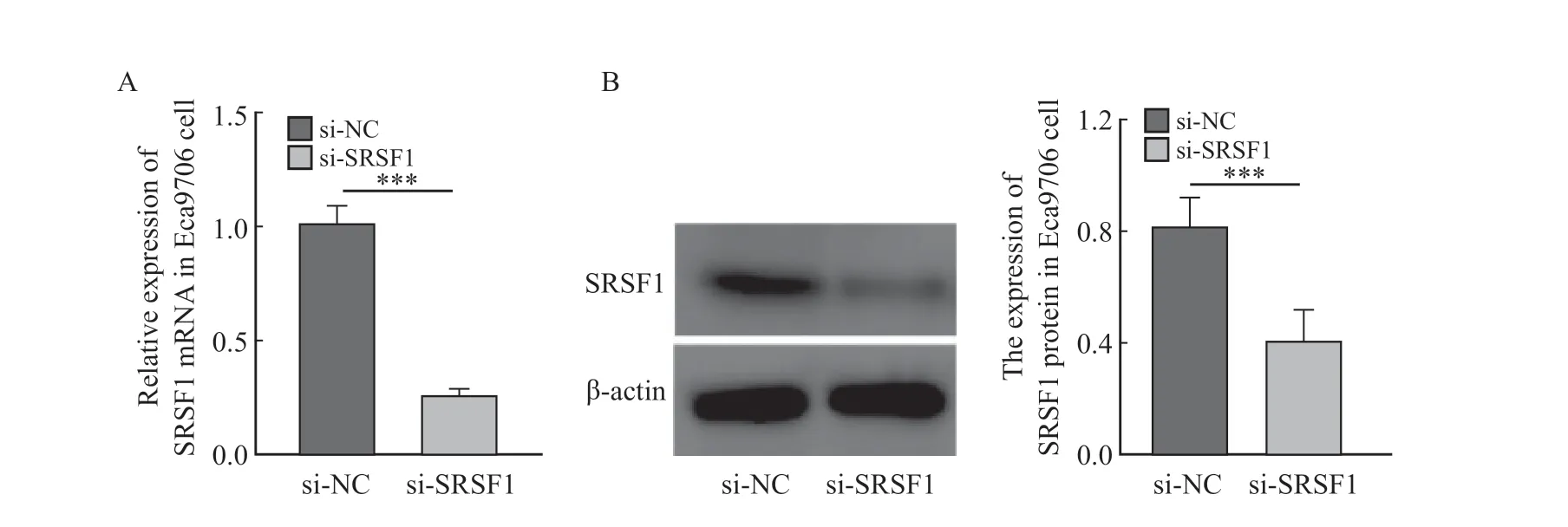
图2 RTFQ-PCR和Western blot检测转染siRNA-SRSF1后Eca9706细胞中的SRSF1 mRNA表达和蛋白水平Fig.2 mRNA expression and protein level of SRSF1 in Eca9706 cells after transfection of siRNA-SRSF1 by RTFQ-PCR and Western blot
2.3 SRSF1对ESCC Eca9706细胞增殖的影响
CCK-8法结果显示,与siRNA-NC组相比,沉默SRSF1表达在48、72和96 h的Eca9706细胞增殖能力显著低于对照组,分别为2.920、5.547和8.626(P=0.0432、0.0051和0.0009,图3),提示沉默SRSF1表达可抑制Eca9706细胞增殖能力。

图3 SRSF1促进Eca9706细胞增殖能力Fig.3 SRSF1 promotes proliferation of Eca9706 cells
2.4 SRSF1对ESCC Eca9706细胞迁移的影响
Transwell实验检测结果显示,siRNA-SRSF1转染组细胞迁移数目与siRNA-NC组相比明显减少(t=6.954,P=0.0022,图4),提示SRSF1在体外可提高ESCC细胞迁移能力。

图4 SRSF1提高Eca9706细胞迁移能力Fig.4 SRSF1 enhanced migration of Eca9706 cells
2.5 SRSF1对ESCC Eca9706细胞侵袭的影响
Matrigel基质胶侵袭实验结果显示,与siRNANC组相比,siRNA-SRSF1组Eca9706细胞侵袭能力明显下降(t=12.91,P=0.000 2,图5),提示SRSF1在体外可提高ESCC细胞侵袭能 力。
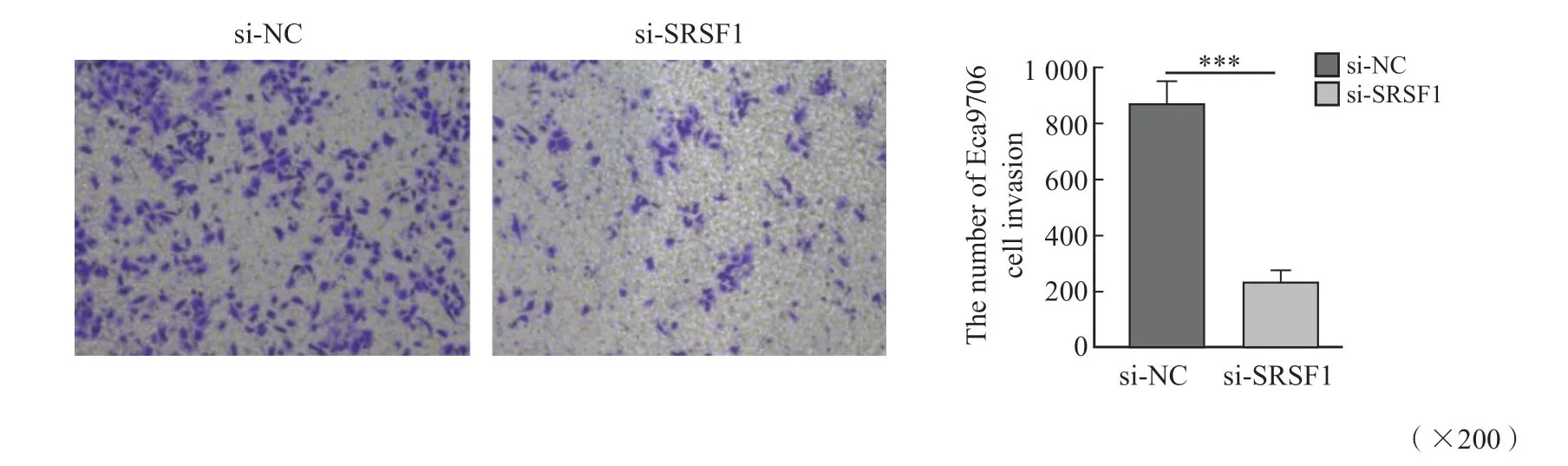
图5 SRSF1提高Eca9706细胞的侵袭能力Fig.5 SRSF1 enhanced invasion activity of Eca9706 cells
2.6 SRSF1对ESCC Eca9706细胞VEGFA可变剪接调控的影响
检索TCGA数据库,发现ESCC组织中VEGFA表达明显高于食管正常组织(图6A,P<0.05)。进一步检索GEPIA数据库,发现ESCC中SRSF1与VEGFA的表达呈正相关(图6B),且差异有统计学意义(P=0.006 2)。RTFQ-PCR检测结果显示,Eca9706细胞VEGFA Iso8a亚型表达明显高于VEGFA Iso8b亚型(t=21.39,P<0.000 1,图6C)。进一步检测SRSF1对ESCC Eca9706细胞VEGFA可变剪接调控的影响,结果表明,敲低SRSF1后,VEGFA Iso8a亚型表达显著降低,VEGFA Iso8b亚型表达明显提高(t=21.82,P<0.000 1,图6D)。上述结果提示,SRSF1可能通过作用于VEGFA可变剪接影响ESCC细胞的生物学行为。
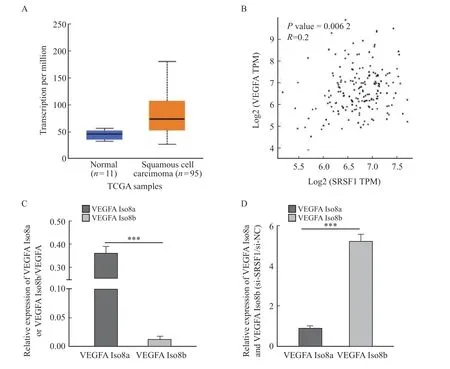
图6 SRSF1对ESCC Eca9706细胞VEGFA可变剪接调控作用Fig.6 Regulation of SRSF1 on VEGFA alternative splicing in ESCC Eca9706 cell
3 讨 论
近年来,随着免疫治疗的不断发展,程序性死亡[蛋白]-1(programmed death-1,PD-1)抗体获批用于ESCC治疗,可延长晚期ESCC患者的无进展生存期和总生存期[11-12],但由于ESCC缺乏早期特异性标志物且具有高度侵袭性,其总体预后仍然不理想。因此,寻找ESCC早期诊断和判断预后的分子标志物,并探讨ESCC发生、发展的相关分子机制,对ESCC临床治疗具有重大意义。SRSF1作为可变剪接因子家族的代表性成员,参与前体mRNA剪接、加工和mRNA运输,并调控细胞周期及凋亡等生理功能[13-14]。另有研究[10,15]表明,SRSF1在多种肿瘤中表达上调,通过调控癌症相关基因的可变剪接促进肿瘤的发展。
本研究首先通过免疫组织化学法证实ESCC组织中的SRSF1表达水平显著增高,与本课题组前期研究[16]结果一致。进一步从细胞水平探讨SRSF1在ESCC细胞系中的表达和功能。RTFQPCR检测ESCC细胞系中的SRSF1 mRNA表达水平,结果显示,Eca9706细胞系中的SRSF1表达丰度最高,明显高于Kyse170、TE1、Yes-2和Kyse150细胞系。另外,通过Western blot检测SRSF1蛋白在ESCC细胞系中的水平,结果显示,SRSF1在Eca9706细胞系中高表达,与前期SRSF1基因表达结果一致。为研究SRSF1在ESCC细胞中的作用,选择Eca9706细胞进行后续的相关研究。通过siRNA技术转染Eca9706细胞,RTFQ-PCR和Western blot检测转染前后的SRSF1基因表达和蛋白水平,结果显示,与对照组相比,转染si-SRSF1后,Eca9706细胞中的SRSF1基因表达和蛋白水平显著降低,证实成功构建低表达SRSF1的Eca9706细胞系。CCK-8实验显示,SRSF1可提高Eca9706细胞增殖能力,同时transwell和Matrigel基质胶实验显示,SRSF1可提高Eca9706细胞迁移和侵袭能力。综上所述,SRSF1在ESCC细胞中高表达,体外可促进ESCC细胞增殖、侵袭和迁移能力,进一步提示SRSF1可作为癌基因参与ESCC细胞的恶性生物学行为,进而促进ESCC的发生、发展。
可变剪接涉及基因转录、转录后加工、翻译及翻译后修饰,在细胞发育和分化过程中发挥至关重要的作用[6]。多项研究[17-18]表明,异常的可变剪接参与肿瘤的发生、发展。SRSF1作为可变剪接因子家族的代表性成员,可通过mRNA可变剪接作用参与基因转录后调控[10,19]。本课题组前期研究[20]发现,SRSF1在非小细胞肺癌细胞系中表达水平升高,并通过可变剪接上调BIN1+12A亚型的表达,进而抑制BIN1的抗肿瘤作用。另有研究[21]显示,circSMARCA5通过结合SRSF1可变剪接调控VEGFA前体mRNA的剪接,促进促血管生成亚型(VEGFA Iso8a)的升高和抗血管生成亚型(Iso8b)的降低,进而影响脑胶质瘤的发展。为进一步探讨SRSF1在ESCC中的分子调控作用,本研究通过检索TCGA和GEPIA数据库发现,VEGFA在ESCC组织中高表达,并发现SRSF1与VEGFA成正相关。综上,我们推测SRSF1可能通过调节VEGFA信号转导通路影响ESCC的发展。
VEGFA作为VEGF家族成员,是肿瘤生长过程中血管生成的关键性调节因子,可以促进肿瘤的转移、增殖、血管生成和诱导耐药等[22-23]。有研究[24]报道,VEGFA异常可变剪接可导致结肠癌中促血管生成亚型与抗血管生成亚型比例的改变,进而影响结肠癌的进展。通过数据库分析发现,VEGFA在ESCC组织中高表达。进一步采用RTFQ-PCR检测VEGFA Iso8a和VEGFA Iso8b亚型在Eca9706细胞系中的表达,结果显示,促血管生成亚型(Iso8a)的表达水平明显高于抗血管生成亚型(Iso8b),证实VEGFA Iso8a在ESCC中发挥重要的促肿瘤作用。有研究[25]报道,SRSF1靶向调控VEGFA前体mRNA可变剪接发挥恶性生物学作用。本研究进一步探讨SRSF1在ESCC中对VEGFA的剪接调控作用。采用RTFQPCR检测转染SRSF1后对VEGFA Iso8a和VEGFA Iso8b亚型表达的影响,结果表明,敲低SRSF1后,VEGFA Iso8a亚型的表达水平显著下降,而VEGFA Iso8b亚型的表达明显升高,表明SRSF1可以促进VEGFA的剪接调控进而影响ESCC的发生、发展。但SRSF1在ESCC中对VEGFA下游信号转导通路的具体作用机制目前尚未清楚,需要后续深入研究。
综上所述,SRSF1在ESCC组织和细胞中高表达,沉默SRSF1可促进ESCC细胞增殖、侵袭和迁移,可能是通过影响VEGFA可变剪接调控进进而发挥促癌作用,这可能成为ESCC临床治疗的新靶点。
利益冲突声明:所有作者均声明不存在利益冲突。
