乳腺导管原位癌的单中心预后分析
2022-04-15杨贻兰陈星星汪宣伊金恺睿邵志敏郭小毛俞晓立
杨贻兰,赵 旭,陈星星,汪宣伊,金恺睿,章 真,邵志敏,郭小毛,俞晓立
1.复旦大学附属肿瘤医院放射治疗中心,复旦大学上海医学院肿瘤学系,上海 200032;2.上海市放射肿瘤学重点实验室,上海 200032;3.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032
乳腺导管原位癌(ductal carcinomainsitu,DCIS)是一种病变局限在乳腺导管内的非浸润性肿瘤,总体预后较好[1]。随着钼靶X线筛查的普及,DCIS的发病率显著升高,目前约占中国新发乳腺癌病例的20%[2-3]。DCIS的治疗以手术为主,20世纪90年代前,全乳切除术是主流的治疗方式[4]。随着NSABP B-17和EORCT 10853等临床试验[5-6]的开展,保乳手术(breastconserving surgery,BCS)联合术后放疗逐渐取代全乳切除术,成为主要的治疗方式。目前已有多项临床试验[5-9]表明,BCS后的辅助放疗可以降低约50%的局部复发,由此奠定了放疗在DCIS治疗中的地位。对于内分泌治疗,一项基于NSABP B-24的回顾性临床研究[10]证实,接受他莫昔芬治疗可显著地降低雌激素受体(estrogen receptor,ER)阳性DCIS患者术后乳腺癌复发的风险(风险比为0.58,95% CI:0.4~0.8,P=0.001 5)。关于抗人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的靶向治疗,NSABP B-43研究[11]探索了放疗联合曲妥珠单抗对比单纯放疗在预防HER2阳性DCIS患者同侧复发中的作用,结果显示,放疗联合曲妥珠单抗可以降低约19%的同侧乳房内复发风险,但差异无统计学意义(风险比为0.81,95% CI:0.56~1.17,P=0.26)。目前抗HER2靶向治疗在DCIS中的价值尚不明确,仍有待进一步的观察研究。现有的DCIS治疗策略主要基于欧美大型随机对照研究,本研究旨在探索中国人群中DCIS患者的临床特征、复发模式和预后因素,以便优化临床决 策。
1 资料和方法
1.1 研究人群
回顾性分析2008年1月—2017年1月于复旦大学附属肿瘤医院接受手术治疗、病理学检查确诊为单纯DCIS、病理学分期为pTisN0M0的1185例患者的病历资料。排除既往确诊过恶性肿瘤、伴有微浸润、病理学诊断为佩吉特病、接受过新辅助治疗、随访时间小于3个月的患者。本研究通过复旦大学附属肿瘤医院伦理审查委员会的批 准。
1.2 病理学指标
本研究通过免疫组织化学方法检测激素受体(hormone receptor,HR)和HER2状态。HR阳性指ER阳性细胞的百分比≥1%或孕激素受体(progesterone receptor,PR)阳性细胞的百分比≥20%,HR阴性指ER阳性细胞的百分比<1%且PR阳性细胞的百分比<20%[12]。HER2免疫组织化学结果为0或1+视为HER2阴性,结果为3+视为HER2阳性,结果为2+且进行荧光原位杂交(fluorescenceinsituhybridization,FISH)检测的以FISH结果为准。由于HER2状态在DCIS中的治疗和预后价值尚不明确,多数免疫组织化学分析结果为2+的患者并未进行FISH检测,这部分病例则视为HER2状态不详。
1.3 研究终点
本研究的主要研究终点为无局部复发生存(local recurrence-free survival,LRFS)和无病生存(disease-free survival,DFS)。局部区域复发包括局部复发和区域复发,前者指同侧胸壁、乳房的复发,后者指同侧腋窝、内乳淋巴结和锁骨上下淋巴引流区的复发。LRFS定义为从诊断日期开始至局部区域复发或末次随访的时间。DFS定义为从诊断日期开始至疾病发生进展、死亡或末次随访的时间。次要研究终点为总生存(overall survival,OS),指从诊断日期开始至任何原因死亡或末次随访的时间。
1.4 统计学处理
生存率通过Kaplan-Meier法计算,采用COX风险比例回归模型进行单因素和多因素分析。由于次要研究终点多未达到,因此并未对OS进行单因素和多因素分析。单因素分析中,P<0.1的变量被纳入多因素分析。由于DFS的单因素分析中,所有变量的P>0.1,因此并未对DFS进行多因素分析。采用SPSS 26.0软件对数据进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 患者的临床病理学特征和治疗情况
纳入分析的1185例患者的临床病理学特征和治疗情况见表1。肿瘤最大径≤2.5 cm的患者占总病例数的77.6%,>2.5 cm的患者占13.9%,8.5%的患者由于病变弥散,难以评估大小,肿瘤大小为不详。核分级为低、中和高级别的患者分别占25.3%、46.2%和24.1%,另有4.3%的患者核分级不详。经历了手术或二次扩大切除后,99.1%的患者切缘为阴性,仍有0.9%的患者切缘为阳性。手术方式以全乳切除+前哨淋巴结活检(sentinel lymph node biopsy,SLNB)为主,有51.5%的患者接受了此术式。接受全乳切除的患者中,约有11.0%(99/896)接受了乳房重建手术。接受BCS的患者中,73.4%(212/289)接受了辅助放疗,放疗方案包括:①全乳放疗50 Gy/25次;② 全乳放疗50 Gy/25次,瘤床加量10 Gy/5次;③全乳大分割放疗40.05 Gy/15次;④ 部分乳腺放疗39.9 Gy/15次;⑤ 部分乳腺放疗38.5 Gy/10次。另有6例接受全乳切除的患者也进行了放疗,方案为胸壁放疗50 Gy/25次。HR阳性的患者中,67.5%(648/960)接受了内分泌治疗,治疗药物包括他莫昔芬、托瑞米芬和芳香化酶抑制剂。
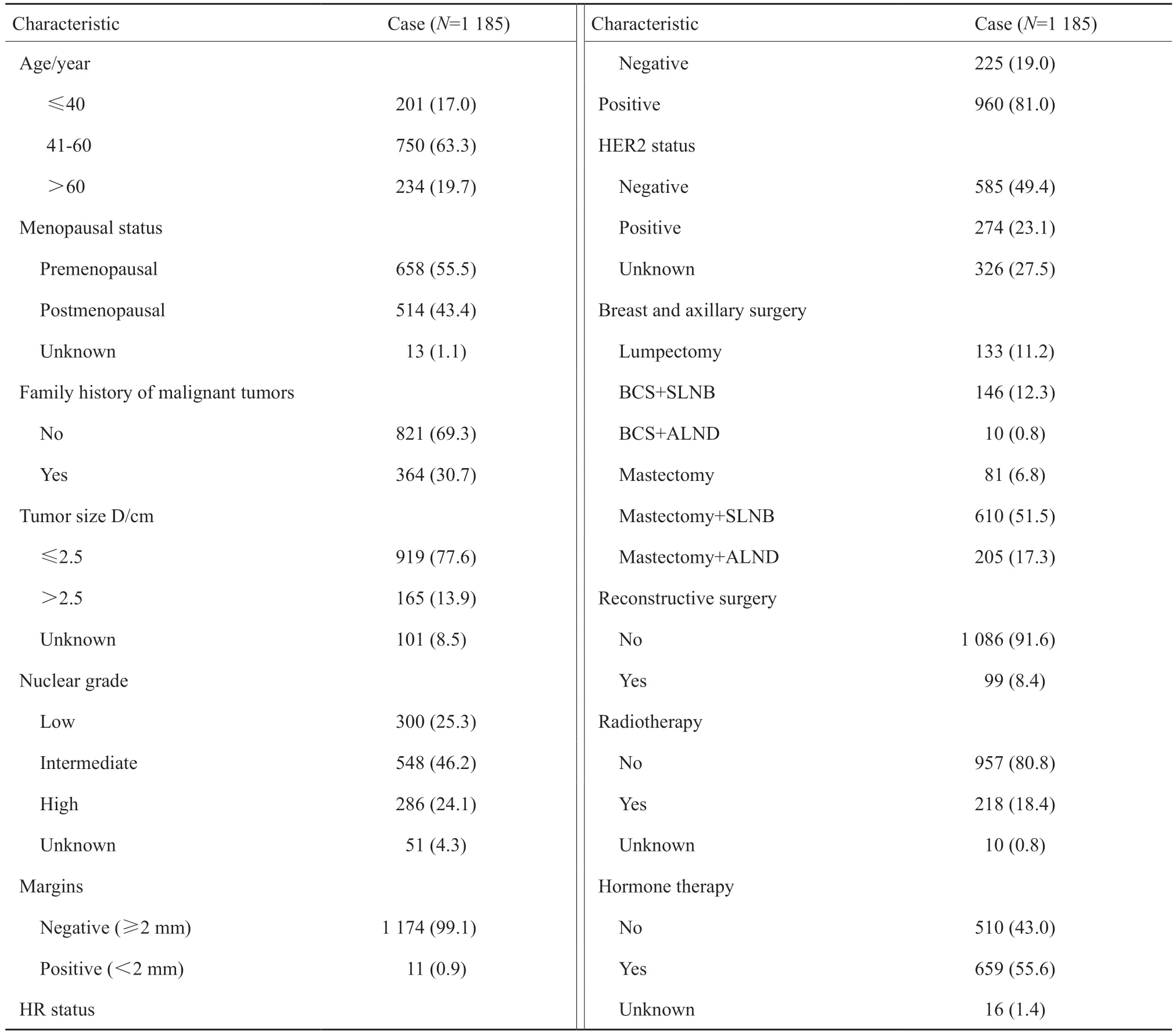
表1 1185例DCIS患者的临床病理学特征和治疗情况Tab.1 Clinicopathological characteristics of and treatment 1185 DCIS patients [n(%)]
2.2 生存和复发情况
纳入分析的1185例患者整体的中位随访时间为61个月(3~150个月),5年OS率、LRFS率和DFS率分别为99.9%(95% CI:99.7%~100.0%)、98.7%(95%CI:97.9%~99.5%)和96.6%(95% CI:95.4%~97.8%),10年OS率、LRFS率和DFS率分别为99.5%(95% CI:99.3%~100.0%)、97.8%(95% CI:96.6%~99.0%)和90.5%(95%CI:86.6%~94.4%),生存曲线见图1。3例患者在随访过程中死亡,其中2例死亡原因为乳腺癌,另1例死亡原因为其他恶性肿瘤。共发生50例治疗失败事件,包括局部区域复发16例、对侧乳腺事件30例和远处转移4例,具体失败模式见表2。对侧乳腺事件是治疗失败的主要原因,占所有治疗失败事件的60%,其中原位癌18例、浸润性癌12例。局部区域复发中最常见的是同侧乳房内复发,共11例,占所有治疗失败事件的22%。4例远处转移患者中,2例为骨转移,2例为肺转移。

表2 1185例DCIS患者的治疗失败模式Tab.2 Treatment failure patterns of 1185 DCIS patients
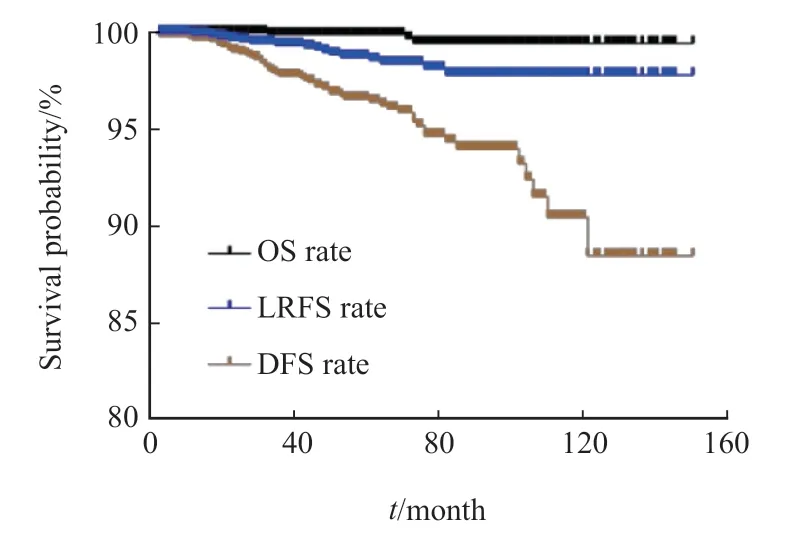
图1 1185例DCIS患者的OS率、LRFS率和DFS率生存曲线Fig.1 OS rate,LRFS rate and DFS rate survival curves of 1185 DCIS patients
2.3 单因素和多因素预后分析
单因素分析未发现与LRFS和DFS有关的预后因素。多因素分析显示,HER2阳性(风险比为4.2,95% CI:1.2~15.5,P=0.029)是LRFS的不良预后因素。单因素和多因素分析结果详见表3、4。

表3 1185例DCIS患者LRFS和DFS单因素预后分析Tab.3 Univariate prognostic analysis of LRFS and DFS in 1185 DCIS patients
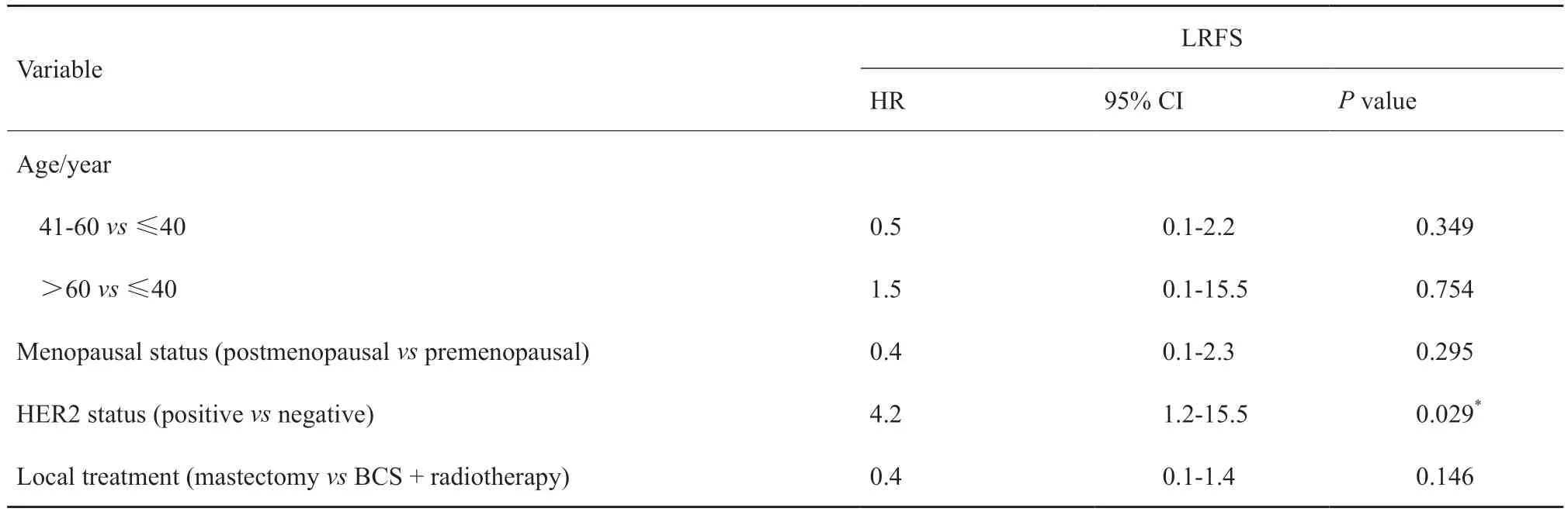
表4 1185例DCIS患者LRFS多因素预后分析Tab.4 Multivariate prognostic analysis of LRFS in 1185 DCIS patients
3 讨 论
随着乳腺癌早期筛查的普及,中国DCIS的发病率逐渐升高。本研究回顾性分析复旦大学附属肿瘤医院收治的1185例DCIS患者的病理学特征、生存复发情况和相关预后因素,结果显示,DCIS患者总体预后极好,5年OS率、LRFS率和DFS率分别为99.9%、98.7%和96.6%,10年OS率、LRFS率和DFS率分别为99.5%、97.8%和90.5%。随访期间共发生50例治疗失败事件,主要的失败模式为局部区域复发(16/50)和对侧乳腺事件(30/50)。术后局部区域复发率低,仅为1.35%(16/1185),这一数值与RTOG 9804临床试验[8]的结果大致相当,在RTOG 9804临床试验中,放疗组的局部复发率为0.9%,而未放疗组的局部复发率为6.7%(P<0.001)。本研究患者局部复发较少的原因可能有以下几点:①治疗方案方面,接受全乳切除术的患者占总人群的75.6%(896/1185),而接受BCS的患者中,73.4%(212/289)进行了辅助放疗;② 病理学特征方面,77.6%(919/1185)的患者肿瘤最大径≤2.5 cm,Fuhrman核分级又以低中级别为主,仅有24.1%(286/1185)的患者肿瘤为高级别;③手术切缘方面,99.1%(1 174/1185)的患者切缘阴性。上述原因造成局部区域复发不是本研究的主要治疗失败事件,超过半数的治疗失败事件是对侧乳腺事件,而早期乳腺癌试验协作组(Early Breast Cancer Trialists’ Collaborative Group,EBCTCG)的一项meta分析[13]显示,在接受了BCS加放疗的DCIS患者中,对侧乳腺事件只占所有乳腺事件的30%左右。
单因素分析显示,HER2阳性对LRFS的预后并没有提示作用(P=0.098),而在排除混杂因素后进行多因素分析显示,HER2阳性的患者LRFS更差(P=0.029),具有更高的局部区域复发风险。目前已有多项研究证实了该结论。Thorat等[14]在UK/ANZ DCIS临床试验的基础上回顾性地评估了患者的HER2状态,结果发现,HER2阳性可显著增加同侧乳腺复发(风险比为2.29,P<0.000 1)和原位同侧乳腺复发(风险比为2.90,P<0.000 1)的风险。另外,将HER2状态纳入包括病理学特征和治疗情况的预后模型中,可显著提高该模型的预测准确度(P=0.000 5)。Han等[15]研究也发现,在接受过BCS的DCIS患者中,HER2阴性患者的5年LRFS率为84%,而HER2阳性患者的5年LRFS率则只有65%(P=0.04)。HER2阳性对不良预后的提示作用可能与其肿瘤自身的组织病理学特征有关。Di Cesare等[16]曾报道,HER2阳性的DCIS肿瘤具有更高的Fuhrman核分级(P<0.001),并与高的Ki-67增殖指数(P=0.003)相关。关于DCIS的抗HER2靶向治疗,虽然NSABP B-43研究[11]并未获得预期结果,但该研究证实了放疗联合曲妥珠单抗的安全性,并且发现联合治疗具有减少同侧复发的趋势。关于靶向治疗在DCIS患者中的临床应用价值可能需要筛选高危人群进行进一步研究。
本研究虽然病例数较大,但仍为回顾性研究,不可避免地具有选择性偏倚和部分病例信息缺失。尤其是HER2状态,本研究中多数免疫组织化学结果为2+的患者并未进行FISH检测,因此HER2状态不详的患者高达27.5%,这一部分信息的缺失很有可能使结果出现一定偏差。
综上所述,在中国人群中,DCIS患者预后极好,局部复发率低,HER2阳性的患者具有更高的局部区域复发风险,但上述结果仍需大样本或前瞻性研究进一步证实。
利益冲突声明:所有作者均声明不存在利益冲突。
